서 론
비만은 과도한 체지방 축적으로 정의되며, 전 세계적으로 유병률이 급격히 증가하면서, 공중보건의 주요 과제로 대두되고 있다. 국내에서도 서구화된 식습관으로 인해 비만이 2형 당뇨병, 심혈관 질환 및 이상지질혈증과 같은 대사 질환의 주요 위험 요인으로 인식되고 있다(Huh and Park, 2024). 비만의 병인은 유전, 환경 및 장내 미생물군집의 불균형과 같은 다층적 요인으로 구성되며(Concepción-Zavaleta et al., 2024; Hamjane et al., 2024; Kumari et al., 2022), 특히 장내 미생물은 에너지 대사, 염증 반응 및 지질 축적에 영향을 미쳐 비만 억제를 위한 새로운 접근법으로 주목받고 있다(Zhang et al., 2024).
유산균(lactic acid bacteria)은 장내 환경을 개선하고 대사 건강을 증진하는 프로바이오틱스로, 지방 생성(adipogenesis) 억제와 지질 대사(lipid metabolism) 조절을 통해 비만 예방 및 치료에 기여할 수 있다는 증거가 축적되고 있다(Drissi et al., 2014; Million et al., 2012). Lactococcus lactis는 우유, 치즈 및 김치와 같은 발효식품에서 흔히 발견되는 유산균으로, 단쇄 지방산, 펩타이드, 박테리오신과 같은 생물학적 활성 물질을 생성하며(Cavanagh et al., 2015), Lactococcus lactis가 생성하는 nisin은 박테리오신으로 항염증, 항산화, 면역 조절 효과를 통해 대사 조절과 비만 억제에 기여할 가능성이 제기되고 있다(Song et al., 2017). Lactobacillus와 Bifidobacterium 속 유산균에서 비만 조절이 활발히 연구되고 있다. Lactobacillus plantarum은 고지방식이 유도 비만 모델에서 체중 증가를 억제하고 지질 대사를 개선하며(Park et al., 2014), Bifidobacterium animalis subsp. lactis는 비만 관련 지표를 개선하는 항비만 잠재력을 보여주었다(Pedret et al., 2019).
최근 연구에서는 Lactococcus lactis subsp. lactis CAB701이 3T3-L1 세포의 지방 세포 분화를 억제하고, 고지방식이 유도 비만 마우스에서 체중 증가와 지질 축적을 감소시킨다는 결과가 보고되었다(Jeong et al., 2023). 또한, Lactococcus chungangensis CAU 28은 고지방식이 마우스에서 체중 감소와 지방 조직 대사를 개선하는 효과를 입증하였다(Zhang et al., 2020). 그러나 김치에서 분리된 Lactococcus lactis JNU534 (LLJ)의 항비만 효과와 그 분자 메커니즘은 아직 충분히 규명되지 않았다.
이에 본 연구는 3T3-L1 전지방세포에서 LLJ의 항비만 잠재력을 평가하고, 지방 생성, 지질 대사 및 관련 분자 메커니즘에 미치는 영향을 조사함으로써 LLJ의 비만 억제 효과를 밝히고, 기능성 소재로서의 치료적 가능성을 탐구하고자 한다.
재료 및 방법
김치에서 분리한 LLJ (KCCM10869P)의 배양액은 접종액 준비 전에 M17 한천 배지(Merck, Germany)에 0.5% (w/v) 포도당을 첨가하여 먼저 활성화시켰다. LLJ의 단일 집락을 MRS broth (BD Difco, USA)에 접종하고 30℃, 24시간 동안 배양했다. 이 배양액의 1% (v/v)를 취하여 30℃에서 16~18시간 동안 계대배양한 후 접종액으로 사용하였으며, 배양액의 밀도는 1.89–2.00으로 표준화되었다. 모든 실험은 7.5 L 용량의 jar 발효기(Bioengineering, Swiss)에서 4 L의 MRS 액체 배지(BD Difco)를 사용하여 수행되었다. 배양은 30℃에서 80 g으로 교반하며 16시간 동안 진행되었고, 0.5 vvm으로 공기를 공급하였다. 107 CFU/mL로 배양된 LLJ 세균 세포는 회수된 후 동결 건조기(MG Industry, Republic of Korea)를 이용해 −50°C, 0.05 mbar, 36시간 동안 건조되었다.
3T3-L1 세포주는 한국세포주은행 (Korean Cell Line Bank, Seoul, Korea)에서 분양받아 사용하였다. 세포는 10% bovine calf serum (BCS)과 1% penicillin-streptomycin (PS)이 첨가된 DMEM 배지에서 37°C, 5% CO₂ 조건으로 배양하였다. 세포가 6-well 플레이트에서 100% 포화 상태(confluency)에 도달하면 분화를 유도하였다. 분화 유도는 0.5 mM 3-isobutyl-1-methylxanthine (IBMX), 0.25 μM dexamethasone, 4 mg/mL insulin, 10% fetal bovine serum (FBS) 및 1% PS가 포함된 DMEM을 사용하여 수행하였다. 분화 2일 차에는 insulin, 10% FBS, 1% PS가 포함된 DMEM 배지로 교체하였으며, 4일 차와 6일 차에는 10% FBS와 1% PS가 첨가된 DMEM으로 교체하여 배양을 지속하였다. 분화는 총 8일 동안 진행하여 Lactococcus lactis가 지방 생성(adipogenesis)에 미치는 영향을 평가하였다.
세포독성은 WST-1 분석법(Biomax Co., Ltd., Seoul, Republic of Korea)을 사용하여 측정하였다. 3T3-L1 세포를 96-well 플레이트에 1 × 104 cells/mL의 밀도로 분주하고, LLJ 0.5, 1, 1.5, 2 mg/mL를 처리한 후 24시간 동안 배양하였다. 흡광도는 450 nm에서 측정되었으며, 세포 생존율은 대조군 대비 상대적으로 계산되었다.
3T3-L1 세포의 분화 및 지질 축적을 평가하기 위해 Oil Red O 염색을 수행하였다. Oil Red O 0.5 g을 2-propanol (Sigma-Aldrich, St. Louis, MO, USA) 60 mL에 용해한 후, 0.22 μm 필터로 여과하고 4°C에서 하룻밤 보관하였다. 이후 저장 용액 9 mL을 증류수 6 mL와 혼합하여 작업 용액을 제조하였다. 분화가 유도된 세포는 PBS (HyClone Laboratories Inc., UT, USA)로 세척한 후, 10% 포르말린 용액(Tech & Innovation Co. Ltd., Chuncheon, Korea)을 사용하여 4°C에서 1시간동안 고정하였다. 고정 후 세포를 증류수로 세척하고 40°C에서 30분간 건조한 뒤, Oil Red O 작업 용액으로 염색하였다. 염색은 실온에서 암실 조건으로 20분간 진행되었다. 과량의 염료를 제거한 후, 2-propanol을 사용하여 염색된 물질을 용출하였다. 지질 축적량은 마이크로플레이트 리더(Tecan, Männedorf, Swiss)를 이용하여 520 nm에서 흡광도를 측정함으로써 정량화하였다.
LLJ가 처리된 분화 세포는 분석을 위해 서로 다른 시점에서 수확되었다. 초기 지방세포 분화 인자는 4시간 후, 후기 분화 인자는 4일 후, 콜레스테롤, 트리글리세라이드 및 보조인자 합성 인자는 6시간 후에 수집되었다. 수집된 세포는 PBS로 2회 세척한 후, TRIzol 시약(Invitrogen, Carlsbad, CA, USA)을 이용하여 총 RNA를 분리하였다. mRNA는 Power SYBR® Green PCR Master Mix (Thermo Fisher Scientific, MA, USA)를 사용하여 실시간 PCR 검출 시스템(Applied Biosystems, CA, USA)에서 증폭하였다. 유전자 발현 분석에 사용된 프라이머 서열은 Table 1에 제시하였으며, 상대적 mRNA 발현량은 ∆∆Ct법을 사용하여 대조군과 비교하여 계산하였다. PCR을 통해 분석된 유전자 정보는 Table 2에 제시하였다.
단백질은 RIPA 완충액을 사용하여 추출하였으며, BCA 키트(Thermo Fisher Scientific)를 이용하여 정량하였다. 단백질(30 μg)을 SDS-PAGE로 분리한 후, polyvinylidene difluoride (PVDF) membrane으로 전이시켰다. Membrane은 5% BSA에서 30분간 반응한 뒤, 1차 항체(1:1000)와 함께 4°C에서 12시간 이상 반응시켰다. Tween-20이 포함된 Tris-완충 식염수(TBS-T)로 10분씩 5회 세척하고, 2차 항체(Cell Signaling Technology, #7074, 1:2,000)와 실온에서 2시간 동안 배양했다. 2차 항체에 결합된 horseradish peroxidase (HRP)를 활성화하기 위해 ECL 용액을 membrane에 처리하였다. 단백질 밴드는 ECL 검출 시약(Thermo Fisher Scientific)과 EZ-Capture ST 시스템(Tokyo, Japan)을 사용하여 가시화하였으며, 정량 분석은 ImageJ 소프트웨어를 통해 수행하였다. 분석에 사용된 1차 항체는 다음과 같으며, 항체정보는 Table 3에 제시하였고 약어 정보는 Table 4에 제시하였다.
결 과
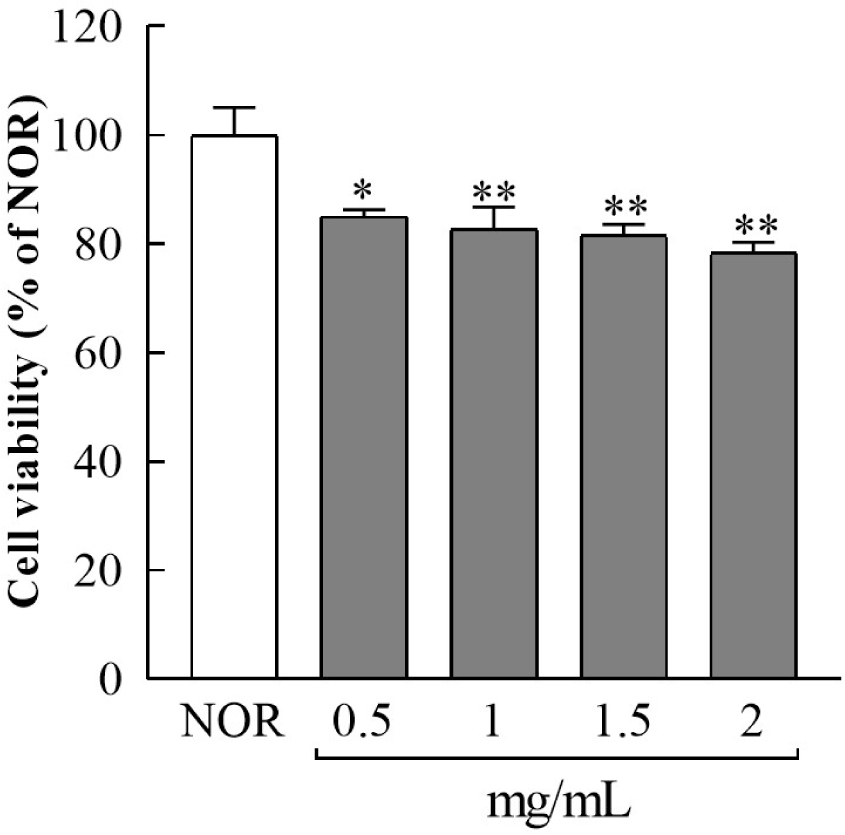
LLJ가 3T3-L1 지방세포의 생존율에 미치는 영향을 평가하기 위해, 다양한 농도(0.5 – 2 mg/mL)의 LLJ를 24시간 처리한 후, WST-1 assay를 수행하였다(Fig. 1). LLJ 0.5-2 mg/mL 처리에 의해 세포 생존율이 NOR 군 대비 15.00, 17.36, 18.38 및 21.26% 감소했으며, 모든 농도에서 유의적인 차이를 보였다. 특히, 2 mg/mL의 고농도에서 세포 생존율이 가장 낮게 나타났다. 이는 LLJ 가 3T3-L1 세포에 대해 일정 농도 이상에서 세포 생존율에 영향을 미칠 가능성을 시사한다. 기존에 상업적으로 활용 중인 유산균주들 Lactobacillus rhamnosus GG, Bifidobacterium animalis subsp. lactis는 3T3-L1 또는 다른 세포주에서 1–5 mg/mL 범위 내 처리 시 약 10–25% 수준의 생존율 감소를 유도하는 것으로 보고되고 있다. LLJ 저농도(0.5 mg/mL)에서는 감소폭이 상대적으로 작았으며, 이에 따라 후속 실험에서는 독성이 최소화된 0.5 mg/mL 농도를 기준으로 진행하였다.
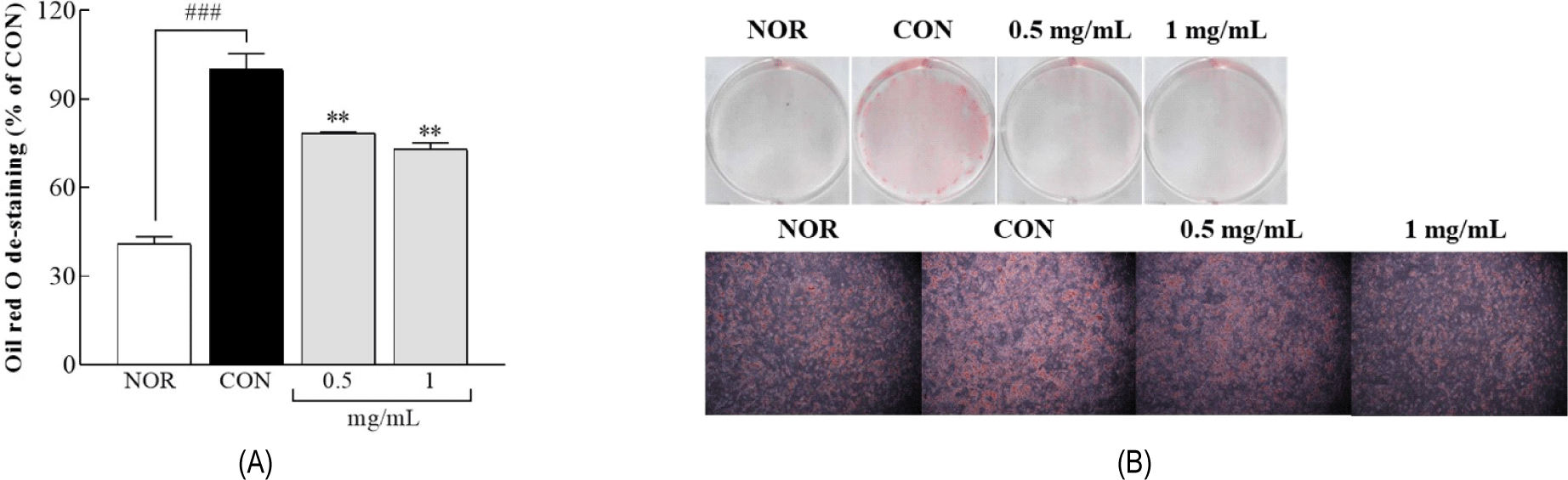
LLJ가 지방세포 분화 중 지질 축적에 미치는 영향을 확인하기 위해 분화가 유도된 3T3-L1 세포에 LLJ (0.5 및 1.0 mg/mL)을 처리하고 Oil Red O 염색을 수행하였다(Fig. 2). 분화유도(CON)군은 분화유도제를 처리하여 지방세포로 분화시킨 군으로, NOR군 대비 지질 축적이 143.92% 증가하였다(p<0.001). LLJ 처리군에서는 CON군 대비 지질 축적이 농도 의존적으로 억제되었으며, 0.5 mg/mL에서 21.54%, 1.0 mg/mL에서 26.26% 감소하였다(all p<0.01, Fig. 2A). 현미경 관찰에서는 CON군에서 지질 방울(lipid droplet)의 크기와 수가 현저히 증가한 반면, LLJ 처리군에서는 지질 방울의 크기와 빈도가 눈에 띄게 감소한 것이 확인되었다(Fig. 2B). 이러한 결과는 LLJ가 지방세포 분화 과정에서 지질 축적을 효과적으로 억제하며, 이는 분화 억제 효과와 연관될 가능성을 나타낸다.
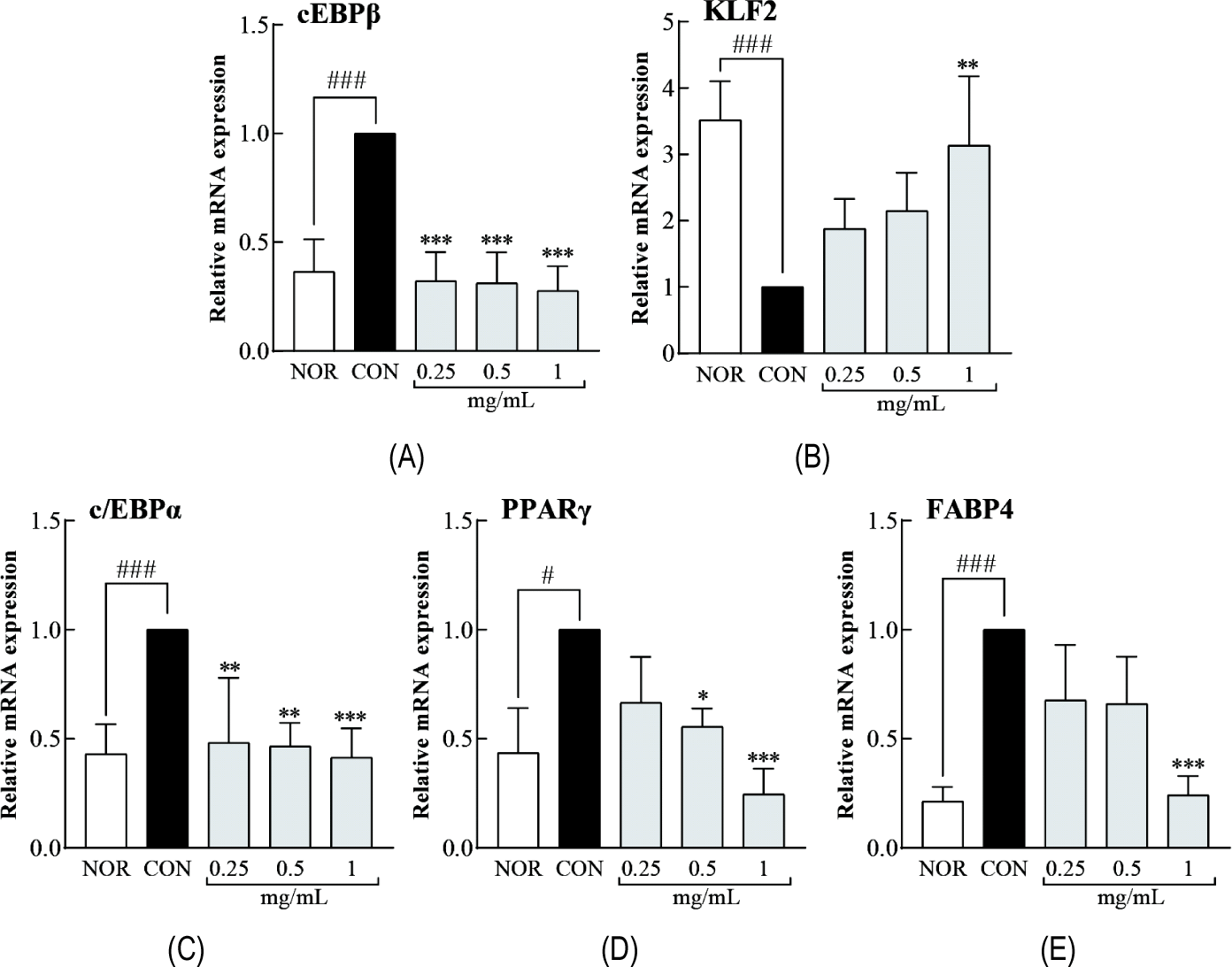
LLJ가 지방세포 분화 과정에서 초기 및 후기 인자의 유전자 발현에 미치는 영향을 조사하기 위해 분화된 3T3-L1 세포에 LLJ (0.25, 0.5 및 1.0 mg/mL)를 처리하고 qRT-PCR로 mRNA 발현 수준을 분석하였다(Fig. 3). 초기 분화 마커인 C/EBPβ는 CON 군에서 NOR군 대비 유의적으로 증가했으며(p<0.001), LLJ 처리군에서 유의적으로 감소하여 CON군 대비 억제되었다(all p<0.001, Fig. 3A). 반면, 지방세포 분화 억제 인자인 KLF2는 CON군에서 NOR 대비 감소하였으나(p<0.001), LLJ 처리에 의해 증가하였으며, 특히 1.0 mg/mL에서 현저하게 증가하였다(p<0.01, Fig. 3B). 후기 분화 마커인 C/EBPα, PPARγ, FABP4의 발현은 NOR군 대비 CON군에서 유의적으로 증가했으나, LLJ 처리군에서는 농도 의존적으로 감소하였다. 구체적으로, C/EBPα는 0.25, 0.5 및 1.0 mg/mL (p<0.01, p<0.01, p<0.001, Fig. 3C), PPARγ는 0.5 및 1.0 mg/mL (p<0.05, p<0.001, Fig. 3D), FABP4는 1.0 mg/mL (p<0.001, Fig. 3E)에서 CON군 대비 감소를 보였다.
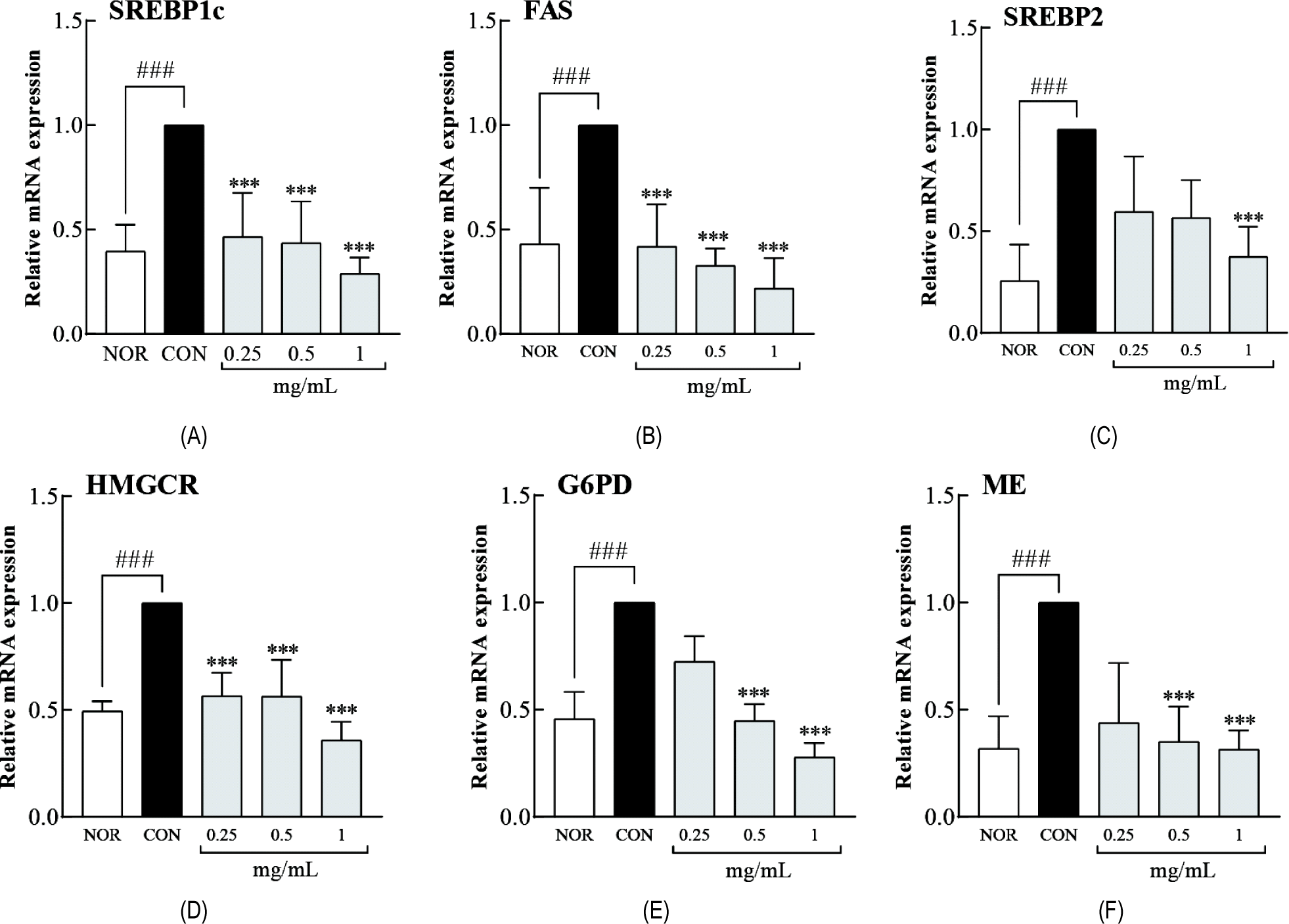
LLJ가 지질 합성 및 NADPH 생성 관련 유전자 발현에 미치는 영향을 평가하기 위해 분화된 3T3-L1 세포에 LLJ(0.25, 0.5, 1.0 mg/mL)를 처리하고 RT-qPCR로 분석하였다(Fig. 4). 중성지방 합성 경로(SREBP1c, FAS), 콜레스테롤 합성 경로(HMGCR, SREBP2), NADPH 생성 경로(G6PD, ME)에 관여하는 유전자를 분석하였을 때, 이들 유전자의 발현이 NOR군 대비 CON군에서 모두 유의적으로 증가하였다(all p<0.001). LLJ 처리 후 유전자 발현 변화는 농도에 따라 뚜렷한 차이를 나타냈다. 1.0 mg/mL 농도에서는 SREBP1c와 FAS가 중성지방 합성 조절에 관여하는 주요 유전자로서 CON군 대비 눈에 띄게 감소하였고, 콜레스테롤 합성 관련 유전자인 HMGCR과 SREBP2 역시 마찬가지로 감소한 수준을 보였다(all p<0.001, Fig. 4A-D). NADPH 생성에 기여하는 G6PD와 ME 또한 1.0 mg/mL에서 CON군 대비 발현이 줄어들며, 지방산 생합성에 필요한 환원력 공급이 제한될 가능성을 보여주었다(all p<0.001, Fig. 4E-F). 한편, 0.5 mg/mL 농도에서는 SREBP1c와 FAS의 발현이 감소하였으나, HMGCR, G6PD 및 ME의 경우 1.0 mg/mL에 비해 변화 폭이 작아 농도 의존적 억제 경향이 확인되었다. 0.25 mg/mL에서는 대부분의 유전자에서 미미한 감소만 관찰되어, 저농도에서는 LLJ의 영향이 제한적일 수 있음을 시사한다. 이러한 결과는 LLJ가 중성지방과 콜레스테롤 합성 경로를 억제하는 데 효과적이며, 특히 NADPH 생성 유전자의 발현 조절을 통해 지방산 생합성의 초기 단계에도 영향을 미칠 수 있음을 나타낸다. 이는 LLJ가 단순히 지질 합성 억제뿐 아니라 세포 내 대사 환경을 변화시켜 지질 대사 전반에 관여할 가능성을 보여준다.
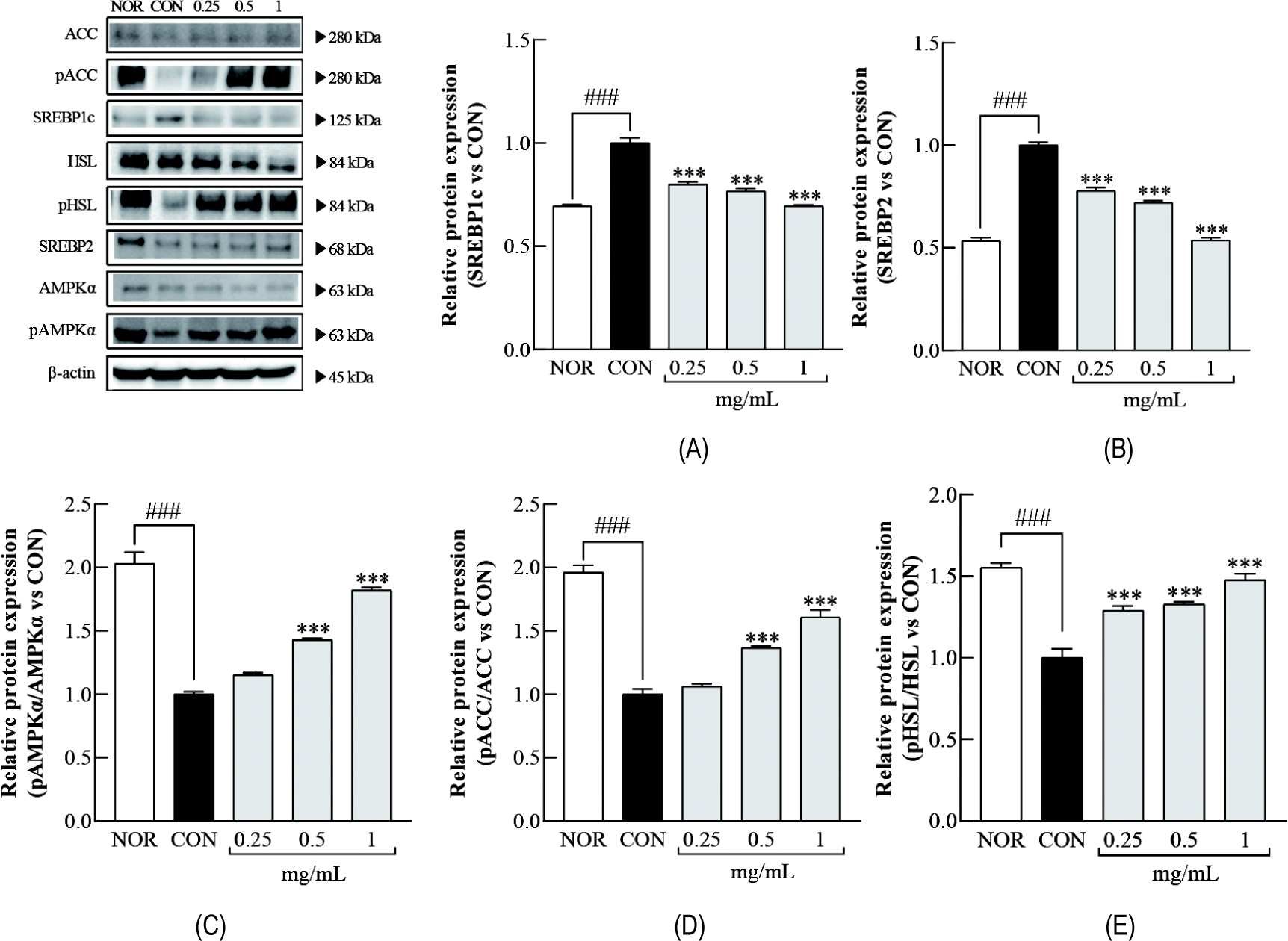
LLJ가 지질 대사 관련 단백질 발현에 미치는 영향을 확인하기 위해, 분화된 3T3-L1 세포에 LLJ (0.25, 0.5, 1.0 mg/mL)를 처리하고 Western blot 분석을 수행하였다(Fig. 5). CON군에서는 지질 합성 조절 단백질인 SREBP1c와 SREBP2의 발현이 NOR군 대비 증가하였으나, LLJ 처리 후에는 농도 의존적인 감소가 관찰되었다(all p<0.001, Fig. 5A-B). 반면, 에너지 대사와 지방 분해 관련 단백질에서는 상이한 변화가 나타났다. CON군에서 p-AMPKα/AMPKα 비율은 NOR군 대비 감소하였으나, LLJ 처리 시 0.5와 1.0 mg/mL 농도에서 증가하여 에너지 대사 활성화가 유도되었다(all p<0.001, Fig. 5C). 지방산 합성 억제 단백질인 p-ACC/ACC 역시 CON군 대비 감소 상태에서 LLJ 0.5 와 1.0 mg/mL 처리로 증가하였고(all p<0.001, Fig. 5D), 지방 분해를 촉진하는 p-HSL/HSL은 0.25, 0.5 및 1.0 mg/mL에서 모두 현저한 증가를 보였다(Fig. 5E). 이 결과는 LLJ가 지질 합성 억제와 동시에 지방 분해 경로를 활성화하는 이중적 효과를 발휘할 수 있음을 시사한다.
고 찰
본 연구에서는 김치 유래 유산균인 LLJ가 전지방세포에 미치는 영향을 확인하고 지방세포 분화 및 지질 대사 관련 유전자 및 단백질 발현 양상을 분석하였다. 지방세포 분화는 초기 및 후기 단계의 전사 인자들에 의해 조절되며, 이 과정은 지방 축적과 밀접하게 연관되어 있다(Rosen and MacDougald, 2006). 초기 분화 인자인 C/EBPβ는 지방세포의 초기 유전자 발현을 유도하며, PPARγ 및 C/EBPα와 같은 후기 분화 인자의 발현을 증가시킨다(Guo et al., 2015; Lee and Ge, 2014; Wu et al., 1999). 반면, KLF2는 지방세포 분화를 억제하는 인자로 알려져 있다(Wu et al., 2005). 본 연구 결과, LLJ 처리 시 C/EBPβ의 발현은 감소하고, KLF2의 발현은 증가하는 양상을 보였다(Fig. 3). 이러한 결과는 LLJ가 KLF2 발현을 유도함으로써 C/EBPβ 발현을 억제하거나, 이들 사이의 상호작용을 통해 지방세포 분화를 저해할 가능성을 시사한다. 또한, PPARγ 및 C/EBPα의 발현 역시 LLJ 처리 농도에 따라 유의하게 감소하여, LLJ가 지방세포 분화의 초기와 후기 단계를 모두 억제할 수 있음을 보여준다. 지질 대사는 지방산의 합성, 저장, 분해 등 복합적인 과정을 포함하며, 다양한 대사 인자에 의해 조절된다. 이 중 SREBP1c와 SREBP2는 각각 지방산 합성과 콜레스테롤 합성을 조절하는 주요 전사 인자로, 지질 대사에 핵심적인 역할을 한다(Horton et al., 2002). 본 연구에서 LLJ 처리에 의해 SREBP1c 및 SREBP2의 유전자 및 단백질 발현이 유의적으로 감소하였으며(Fig. 4 & 5), 이와 함께 지방산 합성 효소인 FAS와 콜레스테롤 합성 효소인 HMGCR의 발현도 억제되었다(Fig. 4). 이러한 결과는 LLJ가 지질 합성 경로를 저해할 수 있음을 시사한다. 또한, 지방산 생합성에 필요한 환원력을 제공하는 NADPH 생성 효소인 G6PD와 ME의 발현이 LLJ 처리군에서 감소함에 따라, LLJ가 환원력 공급을 제한함으로써 간접적으로 지질 합성을 억제할 가능성도 제기된다. 이러한 분자적 변화는 Oil Red O 염색 결과와도 일치하며(Fig. 2), LLJ가 지질 축적을 감소시키는 데 효과적이라는 것을 보여준다.
에너지 항상성 유지에 중요한 역할을 하는 AMPK는 세포 내 에너지 부족 상태에서 활성화되며, 지방산 합성을 억제하고 산화를 촉진한다(Hardie et al., 2012). 본 연구에서 LLJ 처리 시 AMPK의 인산화 수준이 증가하였으며, 이는 LLJ가 AMPK 신호 경로를 활성화하여 지방 대사를 조절할 수 있음을 의미한다. 더불어, ACC와 HSL의 인산화 역시 증가하였다(Fig. 5). 이는 각각 지방산 생합성 억제와 지방 분해 촉진에 관여하는 기전으로(Frühbeck et al., 2014; Wakil and Abu-Elheiga, 2009), LLJ가 지질 대사의 균형을 조절함으로써 지방 축적을 억제할 수 있는 생리적 기전을 뒷받침한다. 이러한 결과는 LLJ가 에너지 대사 경로를 통해 항비만 효과를 나타낼 수 있음을 시사한다.
본 연구 결과는 Lactococcus lactis가 지방세포 분화 및 지질 대사 조절에 미치는 영향을 보여주는 추가적인 증거를 제공하며, 기존의 프로바이오틱스 관련 연구들과도 일치한다. Lactobacillus fermentum MG4231과 MG4244는 3T3-L1 세포에서 PPARγ 및 C/EBPα와 같은 지방 생성 관련 전사인자의 발현을 억제하고, AMPK 및 HSL의 인산화를 유도함으로써 지질 축적을 감소시키는 효과를 나타냈다(Kim et al., 2020). 또한, Lactobacillus plantarum HAC01 유래 세포 용해물은 PPARγ, C/EBPα, SREBP1c의 발현을 억제하고 AMPK를 활성화함과 동시에 MAPK 경로를 조절함으로써 항지방세포 분화 효과를 보였다(Kim et al., 2022). 본 연구에서도 LLJ 역시 PPARγ 및 C/EBPα의 발현을 억제하고 AMPK 신호 경로를 활성화하는 유사한 작용을 보였으며, 이는 기존 연구 결과와의 일관성을 보여준다. 특히, Lee 등(2021)의 연구에서는 Lactococcus lactis 유래 대사산물이 지방세포 분화를 억제하는 것으로 보고되었으며(Hyun et al., 2021; Lee et al., 2021), Jeong 등(2023)은 역시 Lactococcus lactis subsp. lactis CAB701이 FAS 발현 억제를 통해 지질 대사를 조절할 수 있음을 제시하였다(Jeong et al., 2023). 본 연구의 SREBP1c 및 FAS 발현 억제 결과는 이러한 연구들과 부분적으로 부합한다.
본 연구는 LLJ가 지방 생성 및 지질 합성을 억제하여 항비만 효과를 나타낼 수 있음을 시험관 내 모델에서 처음으로 입증한 연구로, 전통 발효식품 유래 유산균의 기능성을 강조한다는 점에서 의의가 있다. 그러나 본 연구는 세포 수준에 국한된 결과로, 향후 동물 모델이나 임상 연구를 통해 LLJ의 항비만 효과를 생체 내에서 검증할 필요가 있다. 또한, LLJ의 대사 효과에 관여할 수 있는 단쇄지방산, 펩타이드 등 특정 생리활성 물질은 아직 규명되지 않았기 때문에, 후속 연구를 통해 이들 물질을 확인하고 LLJ의 작용 메커니즘을 보다 명확히 밝히는 것이 필요하다. 결론적으로, 본 연구 결과는 LLJ가 지방세포 분화를 억제하고, 지질 축적을 감소시키며, 주요 대사 조절 인자의 발현을 변화시킴으로써 항비만 기능성 소재로서의 활용 가능성을 제시한다.
요 약
본 연구는 김치에서 분리된 Lactococcus lactis JNU534 (LLJ)의 3T3-L1 전지방세포에서의 항비만 효과 및 그 분자적 작용기전을 규명하고자 하였다. LLJ 처리에 따라 세포 내 지질 축적이 유의하게 감소하였으며, 지방세포 분화와 관련된 주요 전사인자(C/EBPβ, C/EBPα, PPARγ, FABP4) 및 지질 합성과 관련된 유전자(SREBP1c, FAS, HMGCR)의 발현이 농도 의존적으로 억제되었다. 또한, AMPK, ACC 및 HSL의 인산화 수준이 증가함에 따라, LLJ는 지질 합성을 억제하고 지방 분해를 촉진하는 데 기여하는 것으로 나타났다. 이러한 결과는 LLJ가 AMPK 신호 경로를 매개로 하여 지방 생성 및 지질 대사를 조절함으로써 항비만 효과를 나타낼 수 있음을 시사한다. 본 연구는 LLJ의 프로바이오틱스로서의 기능성과 비만 예방을 위한 잠재력을 제시하지만, 이는 시험관 내 연구에 국한되므로 후속 동물실험 및 임상 연구를 통해 LLJ의 효능과 생리활성 물질을 규명할 필요가 있다.
