서 론
최근 장내 미생물 균형이 인간의 전반적인 건강, 특히 뇌 기능과 노화 과정에 미치는 영향에 대한 연구가 급증하고 있다. 이에 따라 장내 미생물 군집 조절(microbiota modulation)을 통한 질병 예방 및 치료 전략 개발이 활발히 이루어지고 있다(Desbonnet et al., 2010).
장내 미생물 구성의 변화는 염증성 및 기능성 장 질환과 함께 나타나는 정신 질환에 기여하는 것으로 알려져 있다(Bercik et al., 2011; Pinto-Sanchez et al., 2017). 특히 최근 관심이 증가하고 있는 우울증, 불안증, 주의력 결핍 과잉행동장애(ADHD) 등의 정신 질환과 관련하여 장-뇌 축(gut-brain axis)의 중요성이 부각되면서, 장내 미생물의 균형 회복과 뇌 건강 증진을 목표로 한 연구가 계속되고 있다(Aarts et al., 2017; Barros-Santos et al., 2020; Bharwani et al., 2017; Ming et al., 2018).
뇌 건강에 있어 뇌유래신경영양인자(brain-derived neurotrophic factor, BDNF)의 역할은 매우 중요하다. BDNF는 신경세포의 성장과 생존을 촉진하고 손상된 신경 회복을 돕는 핵심 인자로서, 노화로 인한 인지 기능 저하와 신경 기능 장애의 진행을 늦추거나 회복력을 향상시켜 노화 예방에 직접적으로 기여하기 때문이다(Faraji and Metz, 2025). 또한, 장내 미생물이 장에서 생산하는 대사산물을 통해 BDNF를 조절할 수 있다는 연구 결과들이 보고되고 있으며, 이는 노화 예방을 위한 유망한 치료 전략 중 하나가 될 수 있다(Molska et al., 2024).
본 종설은 장-뇌 축을 기반으로 장내 미생물, BDNF, 그리고 노화 간의 관계와 상호작용에 대한 최신 연구를 종합적으로 정리하고자 한다. 특히, 장내 미생물 조절을 통한 BDNF 발현 증진이 건강한 노화를 어떻게 촉진할 수 있는지에 대한 기전과 치료적 가능성을 탐구할 것이다.
장-뇌 축은 장내 미생물과 뇌 사이의 복잡한 양방향 소통 체계를 의미하며, 이는 전반적인 건강과 질병에 중요한 역할을 한다(Matin and Dadkhah, 2024). 이 중 장내 미생물은 뇌 발달과 기능을 조절할 수 있는 '제2의 뇌'로서 뇌 건강, 뇌 노화, 그리고 신경퇴행성 질환에서의 역할이 주목되어 왔다(Sarubbo et al., 2023). 중추신경계와 장내 미생물은 신경학적, 면역학적, 내분비 경로를 통해 정보를 교환하며, 장-뇌 축 이론은 장내 미생물이 복합적인 경로를 통해 뇌 기능에 영향을 줄 수 있음을 시사한다(Fig. 1).
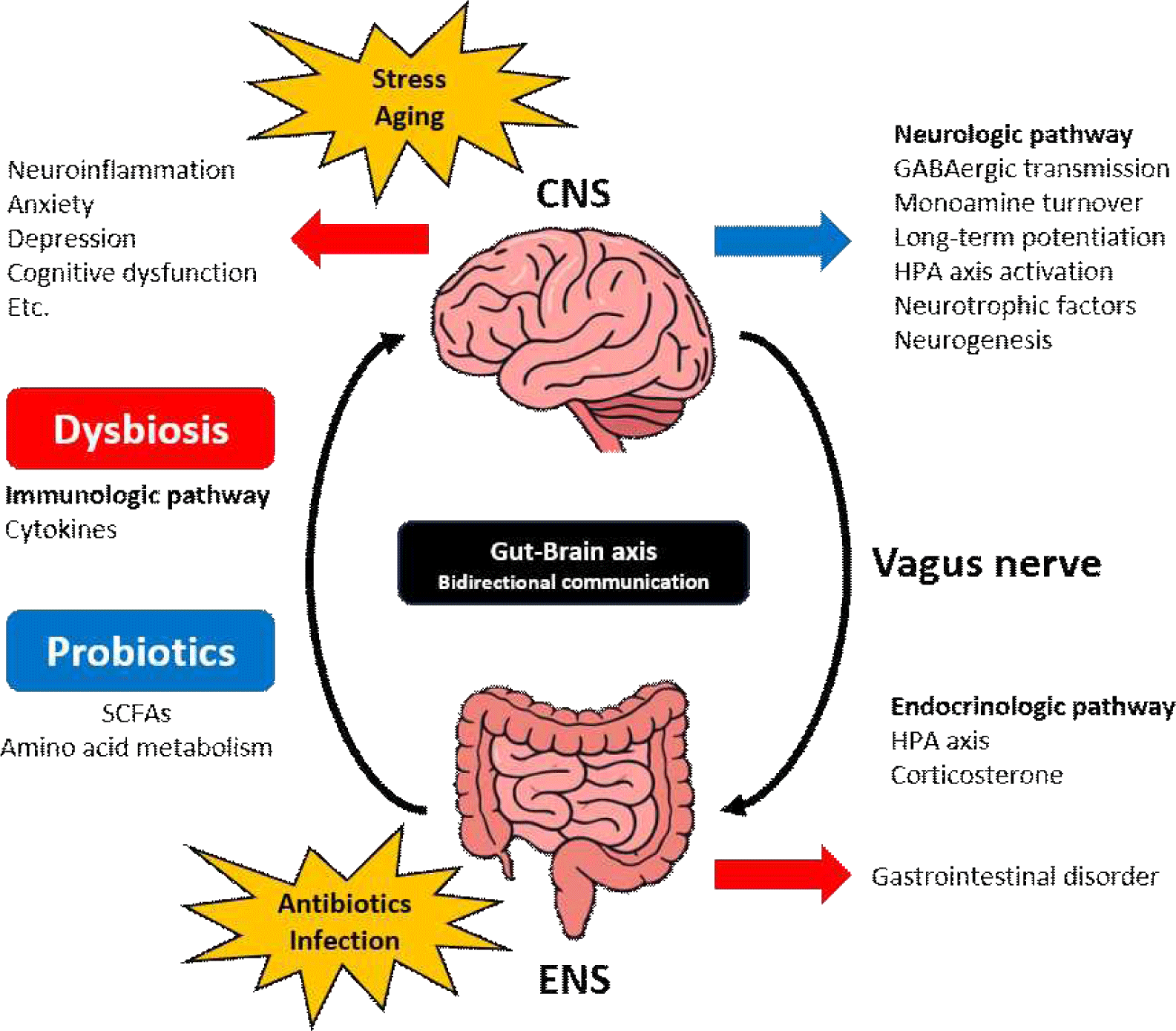
장내 미생물 대사와 정신 건강 사이의 관계는 미생물 군집 연구에서 가장 흥미롭고 논란이 많은 주제 중의 하나이다(VallesColomer et al., 2019). 장-뇌 축의 변화는 위장관의 신경 조절뿐만 아니라, 우울증, 불안증, 자폐증, ADHD, 알츠하이머 등 신경정신학적 증상의 발현과 질병의 병인에 기여하는 것으로 확인되었으며(Athari Nik Azm et al., 2018; Bravo et al., 2011; Naseribafrouei et al., 2014; Rezaeiasl et al., 2019; Valles-Colomer et al., 2019; Wan et al., 2020), 동물 실험을 통해 프로바이오틱스 섭취와 분변 이식이 신경정신학적 질병에 미치는 영향을 확인한 결과들을 Table 1에 정리하였다. Bifidobacterium infantis의 섭취 시, 모성 분리 랫 모델의 강제 수영 시험(forced swim test, FST)에서 부동성이 회복되었고, 뇌간의 기저 노르아드레날린 농도를 회복시켜 프로바이오틱스 처리가 항우울제인 citalopram 처리와 유사한 효과를 나타낸다는 것을 입증하였다(Desbonnet et al., 2010). Lacticaseibacillus rhamnosus JB-1을 28일 동안 경구 투여한 마우스는 스트레스 유도 불안 행동이 감소되었으며, 사회적 상호작용 부족이 예방되었다. 또한, 치료군의 분변 미생물 구성이 변화하였고, 프로바이오틱스 투여 중단 후에도 3주 동안 효과가 지속되었음을 보고하였다(Bharwani et al., 2017). Lactiplantibacillus plantarum 286을 경구 투여한 마우스는 강제 수영 시험(FST), 십자 미로 차별 회피 시험(plus-maze discriminative avoidance task, PM-DAT)을 통해 항우울 효과와 불안완화 효과를 보여주었다(Barros-Santos et al., 2020). 자폐 스펙트럼장애(autistic spectrum disorders, ASD) 동물모델에 Limosilactobacillus reuteri를 처리했을 때는 사회성 결핍이 개선되었고, 미주 신경 의존적 행동을 나타냄을 보고하였다(Sgritta et al., 2019). ADHD 환자의 분변과 건강한 대조군의 분변을 각각 이식한 무균 마우스들은 분변 미생물 군집의 명확한 차이를 나타내었다. ADHD 환자의 분변을 이식한 마우스의 뇌 구조에서 내포와 해마의 백질과 회백질 구간의 감소, fMRI 분석을 통해 오른쪽 운동 피질과 시각 피질 간 연결성 감소를 확인하였으며, Open field test(OFT)를 통해 불안 행동이 증가하였음을 보고하였다(Tengeler et al., 2020). 알츠하이머 동물 모델에서 Lactobacillus acidophilus, Limosilactobacillus fermentum, Bifidobacterium lactis, Bifidobacterium longum을 포함하는 프로바이오틱스 보충제를 처리한 그룹은 Morris water maze(MWM) 시험을 통해 기억 결핍 향상을 관찰하였고, 해마의 산화 스트레스 생체지표들이 향상됨을 확인하였다(Athari Nik Azm et al., 2018). 아밀로이드 베타(Aβ) 유도 알츠하이머 랫 모델의 MWM 시험, 장기강화(long-term potentiation, LTP), Paired-pulse facilitation(PPF) 비 측정을 통해 프로바이오틱스 보충제가 유의적으로 학습 기능 향상, PPF 비 회복, 그리고 LTP에 긍정적인 영향을 주었음을 보고하였다(Rezaeiasl et al., 2019).
| Disorders | Subjects | Treatments | Effects | Reference |
|---|---|---|---|---|
| Depression and anxiety | Maternal separation (MS) rat model | Chronically treated with Bifidobacteria |
• Swim behavior ▼ and immobility ▲ in FST • Peripheral interleukin (IL)-6 release ▲ • Noradrenaline (NA) ▼ in brain • Corticotrophin-releasing factor (CRF) mRNA level ▲ in amygdala |
(Desbonnet et al., 2010) |
| Male Swiss mice | Orally treated with Lactiplantibacillus plantarum 286 over 30 days | • Open arm time ▲ in PM-DAT → Anxiolytic-like effect | (Barros-Santos et al., 2020) | |
| IBS patients | Bifidobacterium longum NCC3001 |
• Depression score ▼ • Quality of life score ▲ • Negative emotional stimuli ▼ in amygdala and fronto-limbic region |
(Pinto-Sanchez et al., 2017) | |
| Stress | Male C57BL/6 mice with chronic social defeat | Orally treated with Lacticaseibacillus rhamnosus JB-1 over 28 days |
• Stress-induced anxiety-like behavior ▼ • Social interaction with conspecifics ▲ • IL-10+ regulatory T cells ▲ |
(Bharwani et al., 2017) |
| ASD and ADHD |
ASD mice model • Shank3B-/- model • VPA (valproic acid) model • MHFD (maternal high-fat diet) model • BTBR model |
Treated with Limosilactobacillus reuteri over 4 weeks |
• Sociability ▲ after treatment → via the vagus nerve → synaptic plasticity ▲ in oxytocin-dopamine reward system (VTA DA neuron) |
(Sgritta et al., 2019) |
| Germ-free (GF) mice | Fecal microbiota transplantation of ADHD patients |
• Anxiety behavior ▲ in OFT • Structural integrity of white and gray matter regions ▼ in internal capsule and hippocampus |
(Tengeler et al., 2020) | |
| Newborn infants | Treated with Lacticaseibacillus rhamnosus GG during the first 6 month |
• At the age of 13 years, 17.1% diagnosis of ADHD or Asperger syndrome (AS) in the placebo and none in the probiotic group • Bifidobacterium species ▲ in feces during the first 6 month compared ADHD or AS diagnosis group |
(Pärtty et al., 2015) | |
| Alzhiemer’s disease (AD) | AD rat model | Lactobacillus acidophilus, Limosilactobacillus fermentum, Bifidobacterium lactis, Bifidobacterium longum |
• Memory function ▲ in MWM test • Oxidative stress biomarker MDA(malondialdehyde) ▲ and SOD(superoxide dismutase) activity ▲ in hippocampus |
(Athari Nik Azm et al., 2018) |
| AD rat model | Lactobacillus acidophilus, Bifidobacterium bifidum, Bifidobacterium longum |
• Leaning function ▲ in MWM test • LTP ▲ and PPF ratio ▼ in hippocampus → synaptic plasticity ▲ and presynaptic neurotransmitter release ▲ |
(Rezaeiasl et al., 2019) |
임상 연구에서 프로바이오틱스 섭취가 신경정신학적 질병에 미치는 영향을 확인한 결과도 Table 1에 같이 정리하였다. Bifidobacterium longum NCC3001을 섭취한 과민성 장 증후군(irritable bowel syndrome, IBS) 환자는 플라시보군 환자와 비교하여 우울증에 대한 점수가 감소하였고, 환자의 삶의 질 점수가 평균적으로 증가하였다. fMRI 분석을 통해 편도체(amygdala), 전두변연계(fronto-limbic) 구역을 포함한 다수의 뇌 부분에서 부정적인 감정 자극에 대한 반응이 감소하였음을 확인하였다(Pinto-Sanchez et al., 2017). 신생아의 프로바이오틱스 섭취에 대한 후속 연구에 따르면 Lacticaseibacillus rhamnosus GG를 공급하지 않은 그룹에서 ADHD 또는 ASD로 진단된 13세 어린이가 17.1%로 나타났고, 이들의 생후 6개월 동안 분변의 Bifidobacterium속 박테리아 평균 수를 측정하였을 때, 건강한 어린이(9.12±0.64 log cells/g)보다 진단된 어린이(8.26±1.24 log cells/g)가 더 낮게 나타났음을 확인하였다(Pärtty et al., 2015).
이상의 동물 실험과 임상 연구 결과들을 종합해 보면, 신경정신학적 질병을 가진 환자와 동물 모델의 경우 건강한 대조군의 장내 미생물 군집과 차이가 확인되었고, 프로바이오틱스 섭취를 통해 장내 미생물 군집 변화, 뇌와 신경 지표 향상, 그리고 신경정신학적 행동의 개선이 가능함을 보여주었다. 이러한 결과들은 장내 미생물, 장, 그리고 뇌가 양방향으로 소통하고 있다는 것을 뒷받침한다.
장내 미생물이 신경 발생과 신경영양인자 생성에 중요한 기여를 한다는 새로운 연구 분야가 최근 주목받고 있다. BDNF는 중추신경계에서 신경영양인자의 핵심 구성원으로서, 신경계의 발생, 유지, 가소성에 중요한 역할을 한다(Faraji and Metz, 2025). BDNF는 전구체인 proBDNF 형태로 합성되며, 세포 내외에서 절단 과정을 거쳐 성숙한 BDNF 단백질로 전환된다. 이때 proBDNF는 p75NTR 수용체에 결합하여 장기억압(long-term depression, LTD) 및 세포 자멸사(apoptosis)에 관여할 수 있는 반면, 성숙한 BDNF는 TrkB 수용체에 선택적으로 결합하여 세포 생존을 촉진함으로써 서로 다른 방식으로 신경 구조와 기능을 조절한다(Faraji and Metz, 2025).
장내 미생물은 생애 초기 중추신경계와 시상하부-뇌하수체-부신(hypothalamic-pituitary-adrenal, HPA) 축의 적절한 발달에 중요한 역할을 하며, BDNF 조절을 통해 신경 및 위장 발달을 촉진할 수 있다(Molska et al., 2024). 그러나, 장내 미생물의 불균형이 발생하면 BDNF 발현 감소, 기분 장애 발생, 더 나아가 뇌 질환까지 영향을 줄 수 있다(Agnihotri and Mohajeri, 2022; Bistoletti et al., 2019; Champagne-Jorgensen et al., 2019; Diamanti et al., 2022; Molska et al., 2024). 장내 미생물 불균형은 생활습관, 스트레스, 감염, 노화, 항생제 사용 등 여러 요인에 의해 발생할 수 있으며, 특히 항생제 사용이 장내 미생물 군집 형성에 크게 작용하는 것으로 보고되고 있다(Bercik et al., 2011; Diamanti et al., 2022; Sarubbo et al., 2023).
프로바이오틱스 보충, 분변 이식, 항생제 투여 등이 BDNF 발현을 변화시킬 수 있음이 다음의 동물 실험들을 통해 확인되었다(Table 2). Lactiplantibacillus plantarum 보충은 랫의 뇌와 장에서 BDNF 발현을 증가시켰으며, 그 대사물질은 스트레스 유도 우울증 마우스의 해마에서 BDNF 발현을 증가시키고 우울증 유사 행동을 감소시켰다(Choi et al., 2019; Ranuh et al., 2019). Lacticaseibacillus rhamnosus GG는 셀리악병을 유도한 랫모델에서 감소된 뇌 BDNF 수준을 회복시키면서 TrkB 감소를 동반하여 과도한 BDNF 효과를 차단하였다(Orlando et al., 2020). Lacticaseibacillus rhamnosus TF318은 코르티코스테론(CORT) 유도 우울증 랫 모델에서 장내 미생물 Firmicutes문의 상대적 풍부함을 유의하게 증가시키고, 해마 내 BDNF 발현을 상향 조절함으로써 우울 행동을 예방하는 것으로 보고되었다(Zhao et al., 2023). Lactobacillus gasseri NK109의 경구 투여는 마우스에서 지질다당류(Lipopolysaccharide, LPS) 유도 인지장애 유사 행동을 감소시키고, 낮아진 BDNF 발현을 증가시켰다(Yun et al., 2023). 또한, 무균 마우스는 해마와 대뇌 피질 영역에서 BDNF 발현이 낮게 나타났으며, 무균 마우스에 SPF (specific-pathogen-free) 마우스의 분변을 이식하거나 프로바이오틱스를 투여한 결과, BDNF 수치가 부분적으로 또는 완전하게 정상화되었다(Sudo et al., 2004). 이러한 결과는 프로바이오틱스 보충이 BDNF 발현을 변화시켜 신경 세포 생존, 분화 및 성장을 조절할 수 있는 가능성을 확인시켜 준다. Bercik 등(2011)은 두 가지 실험을 통해 장내 미생물의 변화가 중추신경계 BDNF 발현과 신경정신학적 행동에 영향을 줄 수 있다는 사실을 보여주었다. 첫번째, SPF 마우스에 항생제를 7일간 경구 투여하였을 때, 장내 미생물 조성이 일시적으로 변화하였고 탐색 행동과 해마의 BDNF 발현이 증가하였으나, 항생제 투여를 중단하면 정상화되는 것이 확인되었다. 이 결과는 장내 불균형에 의해 BDNF의 발현이 낮아지는 다른 실험들의 결과와는 다르게 나타났지만, 항생제 투여 중단에 의해 정상화되는 것을 통해 장내 불균형과 BDNF 발현의 관계성을 확인하는데 의미가 있을 것으로 해석된다. 두번째, 마우스 계통 간의 행동과 장내 미생물 구성의 차이를 활용하여 BALB/c 마우스의 분변 미생물을 NIH Swiss 마우스에 이식하였을 때 행동과 중추신경계 BDNF 수치의 변화를 확인하였다. NIH Swiss 마우스보다 BALB/c 마우스가 소심하다는 특징을 이용하여 step-down 검사를 하였을 때, 분변을 이식한 NIH Swiss 마우스가 더 주저하는 행동을 확인하였고 반대로 이식했을 때는 지연 시간이 감소하였다고 보고하였다(Bercik et al., 2011). 어린 마우스에 2주 간 항생제를 처리했을 때, 장내 미생물 불균형과 함께 해마에서 BDNF와 TrkB 발현이 하향 조절되었고, 이 결과는 항생제로 인한 장내 미생물 불균형이 어린 마우스의 위장관 질환과 정신질환 발생에 영향을 줄 수 있음을 보여주었다(Bistoletti et al., 2019). 또한, BDNF 유전자 결손 마우스는 대조군과 비교하여 장내 불균형을 나타냈으며 장 점막 장벽 기능이 감소하였다. 이 결과는 BDNF도 장내 미생물 군집과 위장관 기능에 영향을 줄 수 있음을 보여주었다(Li et al., 2018).
| Subjects | Treatments | Effects | Reference |
|---|---|---|---|
| Wistar rat | Lactiplantibacillus plantarum | • BDNF ▲ in brain and gut | (Ranuh et al., 2019) |
| Stress-induced depression mice model | Lactiplantibacillus plantarum |
• BDNF ▲ in hippocampus • Depression-like behavior ▼ |
(Choi et al., 2019) |
| Celiac disease (CD) rat model | Lacticaseibacillus rhamnosus GG | • BDNF ▲ and TrkB ▼ in brain | (Orlando et al., 2020) |
| CORT-induced depression rat model | Lacticaseibacillus rhamnosus TF318 |
• BDNF ▲ in hippocampus • Firmicutes ▲ in microbiota • Depression-like behavior ▼ |
(Zhao et al., 2023) |
| C57BL/6 mice | Lactobacillus gasseri NK109 |
• BDNF ▲ in hippocampus • LPS-induced cognitive impairment behavior ▼ |
(Yun et al., 2023) |
| GF BALB/c mice | Fecal microbiota transplantation of SPF BALB/c mice or Bifidobacterium infantis treatment | • BDNF ▲ in hippocampus and cerebral cortex | (Sudo et al., 2004) |
| GF BALB/c mice | Fecal microbiota transplantation of Swiss mice |
• Exploratory behavior ▲ • BDNF ▲ in hippocampus • Hesitancy ▼ in step-down test |
(Bercik et al., 2011) |
| C57BL/6J mice | Cocktail of antibiotics (vancomycin, neomycin, metronidazole, ampicillin) |
• Microbiota dysbiosis • BDNF ▼ and TrkB ▼ in hippocampus |
(Bistoletti et al., 2019) |
| BDNF gene knock-out mice | - |
• Microbiota dysbiosis • Intestinal mucosal barrier (IMB) function ▼ |
(Li et al., 2018) |
| >=18 years adults (meta-analysis) | Probiotic supplementation |
• BDNF ▲ in serum • Significant effect beyond 10 weeks treatment • Stronger effect in participants with cognitive impairment or mental disease or gastrointestinal or neurodegenerative disease compared to healthy participants |
(Hashemi et al., 2025) |
임상 연구에서도 프로바이오틱스 섭취가 BDNF 발현과 신경정신학적 질병에 미치는 영향이 확인되었다(Table 2). 최근 Hashemi 등(2025)의 리뷰에서 18세 이상 성인을 대상으로 최소 2주 이상 프로바이오틱스를 투여하고 혈청 BDNF 수치를 보고한 총 20개의 무작위 대조시험의 메타분석 결과, 10주 이상 장기간의 프로바이오틱스 투여하였을 때 혈청 BDNF 수치 변화가 더 뚜렷하게 나타난다고 보고하였다. 건강한 참여자보다 인지 장애, 정신 질환을 가진 참여자에게서 효과가 더 뚜렷했고, 위장관 또는 신경퇴행성 질환을 가진 집단에서 가장 큰 효과가 관찰되었다. 미생물 다양성의 회복과 그로 인한 대사산물 생산에 의해 BDNF 발현이 증가한 것으로 잠재적 기전이 추측 가능하나, 메타분석 데이터 설정에서 혈청 BDNF 수치에 초점을 맞춘 것이 뇌 특이적 BDNF 발현 변화를 충분히 반영하지 못했을 가능성이 있어 신경영상, 뇌척수액 분석 등의 추가적 연구를 필요로 하고 있다(Hashemi et al., 2025).
현재 BDNF를 직접적으로 조절하는 미생물을 특정할 수는 없지만, 프로바이오틱스 중재와 장내 미생물의 균형이 BDNF 발현을 긍정적인 방향으로 변화시킬 수 있음이 수많은 연구들로 입증되었다.
노화는 유전적, 환경적, 생활습관적 요인에 의해 영향을 받는 복잡한 생물학적 과정이다. 장내 미생물 군집은 전 생애에 걸쳐 건강과 질병을 조절하는데 중요한 역할을 하며, 모든 연령대에서 노화 관련 건강 저하와 여러 비감염성 질환에 영향을 미치는 요인이다. 장내 미생물 군집은 나이와 상호작용하는 관계를 가지며, 개인이 나이를 먹음에 따라 구성과 기능에서 상당한 변화를 겪고 종종 장내 불균형으로 이어진다. 이것은 염증 증가, 면역 약화, 대사 장애를 일으키며 염증성 노화와 연결되고, 결국 신경퇴행성 질환, 심혈관 질환, 대사 질환에 기여하게 된다(Ghosh et al., 2022; N V and M, 2025). 일반적인 노화 관련 변화는 장내 주요 공생균(예: Prevotella, Faecalibacterium, Eubacterium, Lachnospira, Coprococcus, Bifidobacterium 등)의 감소로 특징지어지며, 이는 잠재적으로 유익한 특정 공생균(Akkermansia, Christensenellaceae, Butyricimonas, Odoribacter, Butyricicoccus 등) 또는 잠재적 병원성균(Eggerthella, Bilophila, Fusobacteria, Streptococcus, Enterobacteriaceae)으로 대체된다. 장내 Akkermansia속의 미생물, 특히 Akkemansia muciniphila는 잠재적으로 단쇄 지방산(SCFAs)을 생산하는 유익한 미생물로 알려져 있어 염증성 노화 및 우울증을 예방하여 건강을 유지할 수 있다는 것을 보여주는 좋은 예이며(Shen et al., 2023; Wang et al., 2025; Zhang and Wang, 2023), 노화에 따른 감소된 장내 주요 공생균을 이들이 대체하는 것이 바람직한 것으로 사료된다.
Ghosh 등(2020)의 메타분석은 20-89세 2,500명 이상의 개인을 포함하는 다중 코호트 데이터에서 5가지 주요 질환(IBD, 제2형 당뇨, 대장 용종, 대장암, 간경변)에 따른 장내 미생물 군집 차이를 보고하였다. 다음과 같이 질병과 연령에 따라 변화하는 장내 미생물을 6가지 그룹으로 나누었다: 모든 연령대에서 질병과 함께 증가하는 G1(Clostridium, Streptococcus), 60세 이상 노인의 질병과 함께 증가하는 G2(Solobacterium, Ruminococcus, Streptococcus), 20-60세에서 질병과 함께 증가하는 G3(Bacteroides, Actinomyces, Bifidobacterium, Clostridium, Coprobacillus, Dialister, Eggerthella, Erysipelotrichaceae, Escherichia, Fusobacterium, Granulicatella, Lactococcus, Prevotella, Rothia, Ruminococcus, Streptococcus, Subdoligranulum, Veillonella), 모든 연령대에서 질병과 함께 감소하는 L1(Subdoligranulum, Bacteroidales, Alistipes), 60세 이상 노인의 질병과 함께 감소하는 L2(Roseburia, Pseudoflavonifractor, Odoribacter, Eubacterium, Coprobacter, Bifidobacterium, Barnesiella, Bacteroides, Alistipes, Akkermansia), 20-60세에서 질병과 함께 감소하는 L3 (Peptostreptococcaceae, Eubacterium, Dorea, Coprococcus, Butyrivibrio, Bacteroides, Anaerotruncus)(Ghosh et al., 2020). 이와 같은 연령과 질병에 따른 장내 미생물 군집의 변화는 Bradley와 Haran(2024)이 분석한 노인성 질환을 가지는 개인의 장내 미생물 군집과는 차이가 있었다. 노인성 질환을 가지는 개인의 장내 미생물 군집 특성은 낮은 다양성과 잠재적인 병원성을 가지는 Enterobacteriaceae과의 증가, Alistipes속, Bacteroidetes문의 증가, 혈관 죽종형성 대사산물 생산 증가와 단쇄 지방산 생산 미생물의 감소가 있다. 건강한 노화에 따른 장내 미생물은 높은 다양성을 나타냈고 Akkermansia속, Christensenellaceae과의 증가, Enterobacteriaceae과의 감소, 단쇄 지방산 생산 미생물의 증가를 특징으로 한다(Bradley and Haran, 2024). 질병의 종류와 데이터 규모 및 분석 방법에 따라 결과에 차이가 나타난 것으로 추측되며, 특징적으로 알츠하이머 노인에서 증가하는 Alistipes속, 성인이 되면서 Firmicutes와 함께 장내에서 안정적으로 존재하는 Bacteroidetes문의 변화가 다르게 나타나 연령 및 질병에 따른 장내 미생물 군집의 변화가 노화의 원인인지 결과인지 또는 보상의 결과인지는 명확히 알 수 없다(Haran et al., 2019; Saraswati and Sitaraman, 2015). 이러한 불확실성에도 불구하고 장내 미생물이 생산하는 대사산물의 역할은 분명하다. 장내 미생물 군집이 생산하는 대사산물은 장내 미생물의 기능적 역량을 나타내며, 장내에서 국소적으로 작용하거나 혈액을 통해 순환하며 말초신경계와 중추신경계에 전신적으로 작용하기도 한다(Bradley and Haran, 2024; Guo et al., 2022). 대표적으로 항염증 효과를 가지는 단쇄 지방산 생산 미생물의 증가는 노인에서 염증과 염증성 노화를 억제할 수 있다(Chang et al., 2014). 이 관점에서 건강한 노화를 위한 장내 미생물 균형 조절 전략은 중요한 연구 방향으로 고려될 수 있다.
BDNF는 염증, 과도한 스트레스 노출, 노화 과정 등 다양한 요인에 의해 영향을 받으며, BDNF의 선천적인 신경 보호 기능은 정상적인 노화 과정에서 기능 저하와 허약함에 대한 회복력을 향상할 수 있다(Faraji and Metz, 2025). 노화된 뇌에서는 proBDNF와 성숙한 BDNF 사이에 불균형으로 인해 proBDNF 비율이 증가하는 경향이 있으며, 이는 노화 관련 인지 저하 및 신경 기능 장애를 유발하는 병리적 과정으로 이어진다(Nagahara and Tuszynski, 2011).
Oh 등(2016)이 16-96세 209명 피험자의 안와전두피질(orbitofrontal cortex) 데이터 분석을 통해 BDNF 발현과 흥분성 및 억제성 시냅스 유전자 발현이 양의 상관관계를 나타내며 연령 증가에 따라 발현이 감소함을 확인하였다. BDNF 감소의 원인은 연령 관련 시냅스 손실의 기저에 있을 수 있으며, 결국 뇌 위축, 인지 저하, 정신질환 위험 증가로 이어질 수 있다. 이 결과는 우울증과 같이 가속화된 노화 분자 프로파일을 특징으로 하는 신경정신질환에 중요한 의미를 가진다(Oh et al., 2016). Molinari 등(2020)의 연구는 저용량 BDNF 순차적 운동 활성화(sequentially kinetic activated, SKA)를 이용하여 BDNF 대사를 변화함으로써 TrkB 수용체 활용을 높이는 결과를 보여주었다. 또한 뇌 노화와 관련한 생체지표인 아포지단백 E, β-아밀로이드와 Sirtuin 1 단백질의 감소를 통해 뇌 노화에 대응할 수 있었으며, 이 결과는 지속적인 BDNF 활성을 통해 노화를 지연시킬 수 있음을 의미한다(Molinari et al., 2020).
노화와 장내 미생물 및 BDNF가 서로 상호작용할 수 있다는 연구결과들을 토대로 건강한 노화에 따른 장내 미생물균총의 특징 중 하나인 단쇄 지방산 생산 미생물 증가가 BDNF 활성을 높이는데 핵심적인 역할을 할 수 있을 것으로 분석된다. 이를 뒷받침하는 연구 결과로, 마우스에 Bifidobacterium longum subsp. infantis CCFM687을 경구 투여하였을 때, 단쇄 지방산인 부티르산을 생산하는 박테리아 수와 BDNF 수치가 증가하였고, 마우스의 스트레스 유도 우울 행동이 개선되었음을 보고하였다(Tian et al., 2019).
단쇄 지방산 중 부티르산의 BDNF 발현 조절에 관한 연구는 다음과 같이 다수 보고되었다. 방사선에 노출된 마우스는 인지 기능 저하와 p-CREB/BDNF 발현이 감소하였으나, 복강 내 부티르산 나트륨을 사전에 투여한 경우에는 해마 내 p-CREB/BDNF 발현 감소를 억제함으로써 방사선 유발 인지 기능 장애를 개선할 수 있음이 보고되었다(Lee et al., 2019). 비만 환자에서 인지 저하와 관련된 신경염증성 신경독소인 퀴놀린산은 BDNF 수치를 감소시켰고, 부티르산이 BDNF 유전자 프로모터에서 H3K18ac의 후성유전학적 강화를 통해 퀴놀린산 유발 BDNF 감소를 예방하여 신경퇴행을 완화할 수 있음이 보고되었다(Ge et al., 2023). 만성적으로 납에 노출된 마우스는 학습 및 기억 장애와 불안 유사 증상을 나타냈고 해마에서 BDNF 단백질 수준이 감소되었다. 경구 투여한 부티르산은 해마 신경세포에서 아세틸-CoA 합성효소(ACSS2) 발현을 촉진하여 H3K9ac 및 하위 신경영양인자인 BDNF 발현을 회복시켰다(Li et al., 2024). 파킨슨병 마우스 모델에서는 부티르산의 항신경염증 효과가 BDNF-TrkB 신호 경로를 통해 매개된다는 것을 보고하였다(Duan et al., 2025). 이러한 실험 결과들은 단쇄 지방산인 부티르산이 아세틸-CoA 합성효소 활성, 히스톤 탈아세틸화 효소(HDAC2) 억제를 통해 DNA-히스톤(H3) 결합을 풀어주고, 전사인자인 cAMP response element-binding protein(CREB)에 인산기를 붙여주어 BDNF 유전자 프로모터의 작동이 가능하게 하는 기전에 기반함을 보여준다. 이는 부티르산이 BDNF 조절을 통해 신경염증 및 신경행동 변화에 중요한 영향을 미친다는 것을 보여주며, 장내 미생물이 생산하는 단쇄 지방산의 BDNF 조절 경로를 예측 가능하게 한다(Fig. 2).
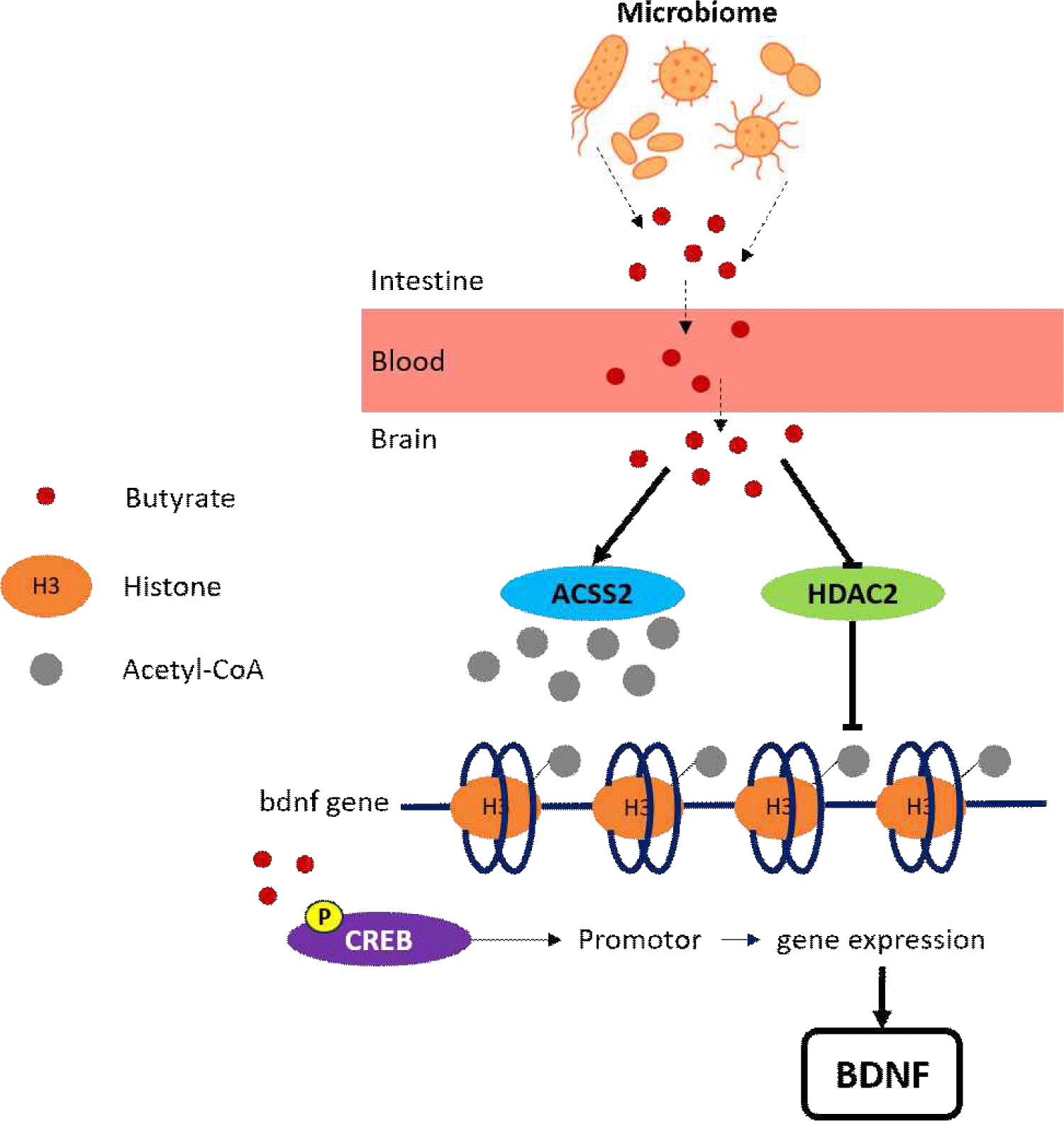
결론적으로, 건강한 노화를 실현하기 위한 방안으로 BDNF 조절과 장내 단쇄 지방산 생산 미생물 유지를 목표로 하는 새로운 프로바이오틱스 개발이 필요할 것이다.
결 론
본 종설은 장-뇌 축을 중심으로 장내 미생물, BDNF, 그리고 노화 간의 상호작용을 종합적으로 고찰하였다. 프로바이오틱스 보충과 장내 미생물 균형 회복은 BDNF 발현을 증가시키고, 인지 기능 저하, 우울증, 불안증, 알츠하이머 등 신경퇴행성 및 정신질환의 증상을 완화하는 효과를 나타냈다. 특히 장내 미생물이 생산하는 단쇄 지방산, 그 중에서도 부티르산은 후성유전학적 기전을 통해 BDNF 발현을 조절하는 핵심적인 역할을 한다. 노화 과정에서 나타나는 장내 미생물 군집의 변화와 BDNF 감소는 인지 기능 저하 및 염증성 노화와 밀접하게 연관되어 있으며, 건강한 노화를 위해서는 단쇄 지방산 생산 미생물의 유지와 증진, 이를 통한 BDNF 발현의 증진이 필요하다는 것을 시사한다.
