서 론
로타바이러스는 전세계적으로 영, 유아에게 심한 설사 등 감염성 질환을 유발한다 (Sanderson et al., 2011; Gladstone et al., 2011). 로타바이러스 감염증은 주로 5세 이하의 영, 유아에서 호발하는 설사성 감염질환으로서, 불현성 감염에서부터 가벼운 설사, 구토, 전해질 장애 및 사망에 이르는 심한 설사, 간혹 생명을 위협할 정도의 치명적인 탈수 등 다양한 임상증상을 보이기 때문에 초기 치료가 중요하다 (Matthijnssens et al., 2011). 백신으로는 HRV의 여러 혈청형에 의해 발병되는 질병을 충분히 광범위하게 방어하는데 어려움이 있으며, 백신 프로그램에 많은 비용이 소요되기 때문에 저소득 국가에서 백신 프로그램 진행에 어려움을 겪고 있는 실정이다 (Chen et al., 2012; Patel et al., 2011).
인체에 유익한 probiotics로서 감염성 설사를 완화하고, 장내 항상성을 향상시킬 수 있는 대체제로서 사용하고 있다(Vlasova et al., 2013). Lactobacillus, Bifidobacterium, Streptococcus의 probiotic 유산균들은 상피세포의 증식을 자극하고, 초기 면역반응을 촉진하는 것으로 보고되고 있다 (Preidis et al., 2011). Bifidobacterirum과 Lactobacillus를 대상으로는 로타바이러스의 부착능 및 복제 억제 또는 감염 예방에 대한 연구들이 이루어져 왔다. Muñoz는 Bifidobacterirum이 로타바이러스의 부착능을 방해하여 로타바이러스 감염을 억제한다고 보고하였다. Bifidobacterium longum CECT 7210이 HT-29에서 로타바이러스의 복제를 직접적으로 억제하는 항로타바이러스 효과가 있다고도 보고하였다(Muñoz et al., 2011). Hortensia는 Lactobacillus rhamnosus GG 및 Lactobacillus paracasei의 항로타바이러스 효과 등을 보고하였다(Hortensia et al., 2015; Ventola et al., 2012).
본 연구에서는 채식으로 섭취한 건강한 한국인의 분변으로부터 분리하였기에 항로타바이러스 효과가 기대되는 프로바이오틱스 Lactobacillus ruminis LR211과 Bifodobacterium longum BL205, BL206을 선별하였다. 3종 유산균 추출물들의 항바이러스 효능을 갖는 작용기전을 알아보기 위해 로타바이러스 감염 시 나타나는 chemokine의 변화를 알아보고자 하였다. 대표적인 chemokine 으로서 Interleukin-8 (IL-8)과 monocyte chemoattractant protein-1 (MCP-1)에 대하여 유산균 추출물을 처리한 그룹이 로타바이러스만을 감염시킨 대조군과 비교하여 IL-8 및 MCP-1의 분비량 변화 정도를 확인하고자 하였다.
재료 및 방법
채식으로 섭취한 건강한 한국 청년의 분변으로부터 분리한 유산균을 삼육대학교로부터 분양받아 general anaerobic medium(Nissui) 배지를 사용하여 anaerobic chamber(Baker Ruskinn)에서 37℃, 혐기조건 (90% N2, 5% H2, 5% CO2)으로 48시간동안 배양한 후 원심분리하여 상등액을 분리하고 PBS로 세척하였다. 세척한 유산균을 1×109 cfu/mL의 농도로 재현탁시킨 후 sonicator를 이용하여 amplitue 100%, pulse on-60s, pulse off-60s, 6 cycles의 조건으로 세포를 파쇄하고, 0.22 μm 필터로 여과하여 여과액을 실험에 사용하였다. Rotavrius는 human Rotavirus Wa strain (HRV Wa strain, KUMC-47)으로 Korea Bank for Pathogenic Vrius에서 분양 받았다. Vero 세포주는 Korean Cell Line Bank에서 구입하여 사용하였고, 10% fetal bovine serum(FBS)이 함유된 RPMI-1640 배지에 1% penicillin (10,000 U/mL) steptomycin (10,000 U/mL)을 혼합하여 37℃, 5% CO2 항온 배양기에서 배양하였다.
유산균 추출물 및 상등액에 의한 세포독성을 확인하고자 원숭이 신장세포 Vero에서 평가하였다. 각각의 세포들을 1×104 cell/well의 농도로 96 well plate에 seeding하여 37°C, 5% CO2 항온 배양기(Sanyo)에서 24시간 동안 배양한 후 유산균 추출물을 농도별로 처리하고 24시간 추가 배양하였다. 추가 배양 후 상등액을 제거하고 MTT (3-(4,5-dimethylthiazol-2-yl)-2,5-diphnyltetrazolium bromide, Sigma Aldrich) 용액을 100 μL를 넣고 37°C, 5% CO2 항온 배양기에서 반응시켰다. MTT 용액과 반응하여 형성된 formazan 을 100 μL의 DMSO를 가하여 용해시키고, ELISA microplate reader(Allsheng)를 사용하여 540 nm에서 흡광도를 측정하였다. 유산균을 처리하지 않은 세포를 control로 흡광도 100% 계산하여 세포독성을 확인하였다.
Rotavirus 증식에는 숙주로 Vero 세포를 사용하여 10 mL에 5×106 cells/mL의 농도로 접종하여 배양하였다. 배지를 제거하고 PBS로 세척한 후 바이러스를 접종하여 10~15분 간격으로 간헐적으로 흔들어주면서 2시간동안 바이러스가 숙주 내에 접종되도록 하였다. 2시간 후 바이러스액을 제거하고, 새로운 infection media (trypsin 5 μL/mL, DMEM)를 넣어 37°C 5% CO2항온 배양기에서 24시간 동안 바이러스를 증식시킨 후 수거하여 역가를 측정하기 전까지 –80°C deep freezer에서 보관하였다.
Rotavirus 역가 및 바이러스 감염 조건을 선정하기 위해 plaque assay를 실험하였다. 숙주세포인 Vero 세포를 6 well plate의 각 well에 1×106 cells/mL의 농도로 각 well당 2 mL씩 seeding하여 세포가 well 바닥에 90% 이상 confluence하게 붙을 때까지 배양하였다. 활성화된 Rotavirus를 well당 400 μL씩 세포 표면에 고르게 펴주고, 37°C, 5% CO2 항온 배양기에서 120분간 배양하여 바이러스를 감염시킨다. 120분후 바이러스액을 모두 제거하고 PBS로 두 번 세척해준 뒤 agarose overlay media (3% (w/v) agarose : 2.5% FBS-RPMI = 1 : 2)를 각 well당 2 mL씩 넣고, 실온에서 굳혔다. Agarose overlay media가 굳은 후 37°C, 5% CO2 항온 배양기에서 plaque가 생길 때까지 배양하였다. Plaque가 육안으로 관찰되면 10% formaldehyde를 각 well당 1 mL씩 넣어 1시간동안 고정시킨 후 고정액을 제거하고, 바닥의 고정된 세포가 떨어져 나가지 않도록 조심스럽게 agarose overlay media를 제거하였다. Crystal violet solution으로 염색하여 clear zone을 측정하여 바이러스 역가를 계산하였다.
로타바이러스 감염 시 스크리닝을 통해 선별된 유산균 추출물에 의한 숙주세포의 IL-8 분비 변화를 측정하기 위해 ELISA(BD OptEIA)를 이용한 immunoassay를 실시하였다. 숙주세포에 상술한 방법으로 Rotavirus를 감염시킨 뒤 infection 배양액을 넣고 배양하면서 일정 시간 간격에 따라 배양 상등액을 수집하여 human IL-8 ELISA (BD OptEIA)로 정량하였다. 바이러스 감염 후 수집한 배양액을 전날 코팅해 둔 IL-8의 1차 항체에 100 μL 처리하고, 2시간 실온에서 반응시킨 뒤 wash buffer로 5번 세척하였다. 세척 후 2차 항체를 각각 100 μL씩 처리하고, 1시간 반응 후 substrate solution을 처리하며, 30분간 암실에 방치 후 stop solution을 넣어 반응을 종결시킨 후 450 nm에서 흡광도를 측정하였다. Media를 양성대조군으로 하고, Rotavirus만 처리한 시료를 음성대조군으로 하였다. 유산균 추출물과 바이러스 모두 처리하지 않은 군을 control로 하여 비교하였다. IL-8 각각의 표준 용액을 단계 희석하여 검량선을 작성하여 IL-8 값을 정량하였다.
로타바이러스 감염 시 스크리닝을 통해 선별된 유산균 추출물에 의한 숙주세포의 MCP-1 분비 변화를 측정하기 위해 ELISA를 이용한 immunoassay를 실시하였다 (Wu, 2013). 숙주세포에 상술한 방법으로 Rotavirus를 감염시킨 뒤 infection media를 넣고 배양하면서 일정 시간 간격에 따라 배양 상등액을 수집하여 human MCP-1 ELISA (BD biosciences)로 정량하였다. 바이러스 감염 후 수집한 배양액을 전날 코팅해둔 MCP-1의 1차 항체에 100 μL 처리하고, 2시간 실온에서 반응시킨 뒤 wash buffer로 5번 세척하였다. 세척 후 2차 항체를 각각 100 μL씩 처리하고 1시간 반응 후 substrate solution을 처리하고 30분간 암실에 방치 후 stop solution을 넣어 반응을 종결시킨 후 450 nm에서 흡광도를 측정하였다. Media를 양성대조군으로 하고, Rotavirus만을 처리한 시료를 음성대조군으로 하였다. 유산균 추출물과 바이러스 모두 처리하지 않은 군을 control로 하여 비교하였다. MCP-1 표준 용액을 단계 희석하여 검량선을 작성하여 MCP-1 값을 정량하였다.
결과 및 고찰
로타바이러스에 대한 항바이러스 효능을 갖는 작용기전을 알아보기 위해 로타바이러스 감염 시 나타나는 chemokine의 변화를 확인하고자 하였다. 바이러스 역가 및 바이러스 감염 최적의 조건을 산정하기 위해 로타바이러스액을 cytopathic effect (CPE) 확인 및 plaque assay를 수행하였다. In vitro 감염된 초기에는 IL-8 및 MCP-1의 발현이 대조군과 비교하여 크게 차이 나지 않았으나, 감염된 24시간 후 로타바이러스만을 감염시킨 대조군보다 IL-8 및 MCP-1의 분비량 증가를 유도하여 면역반응을 촉진시키는 것을 확인하였다.
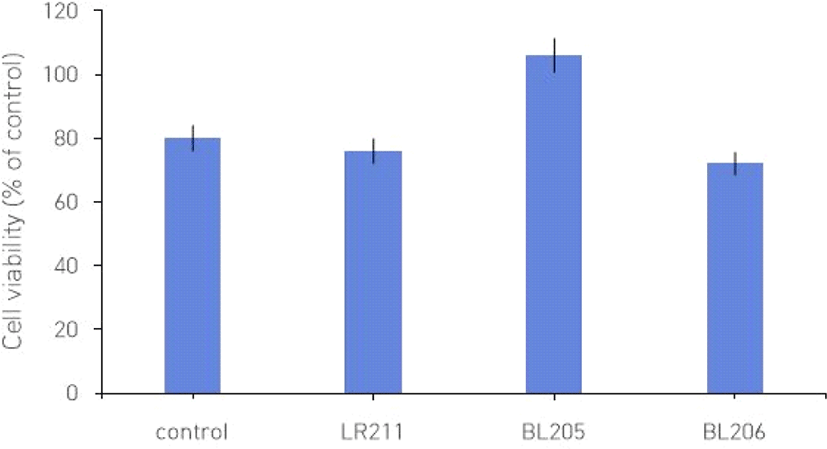
건강한 한국인의 소화관 미생물총으로부터 분리한 유산균 추출물의 세포독성을 확인하고자 원숭이 신장 세포인 Vero에서 MTT assay를 수행하였다. Vero 세포에서 76.69 ± 6.72 %와 108.79 ± 1.95 %로 최저와 최고의 생존율을 보였으며, 전체적으로 약 80% 이상의 cell viability를 보였다 (Fig. 1). 농도에 따른 유산균 추출물의 독성을 평가한 결과, 농도에 따른 차이는 없었으며, 세포 독성도 나타나지 않았다 (data not shown).
Rotavirus는 outer capsid 중 VP4를 trypsin으로 적절히 변형시켜 활성화를 시켜야만 replication이 일어난다. 이 VP4를 적절하게 변형시켜주는 trypsin의 농도가 매우 중요하며, 바이러스 활성화시키는 시간과 cell에 감염시키는 시간이 중요하다. 이러한 바이러스 감염 조건은 연구실에 선행된 실험에서 측정되었다. 이에 본 실험에서는 활성화 시간을 다양하게 조절하여 측정한 결과, trypsin 5 μL/mL, RPMI-1640으로 설정하였으며, 37℃에서 50분간 활성화시켜 가장 효과적인 감염성을 얻었다 (data not shown).
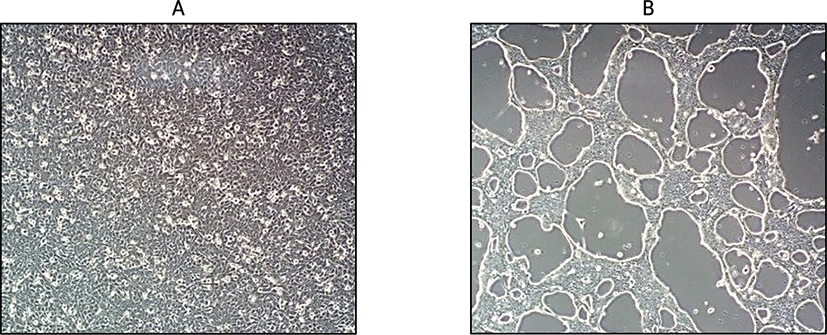
로타바이러스 감염으로 인한 세포의 병변을 확인하기 위하여 바이러스 감염 후 infection media를 넣고 24시간 배양시켜 Vero 세포의 CPE를 관찰하여 특이적인 병변을 관찰함으로써 확인하였다 (Fig. 2).
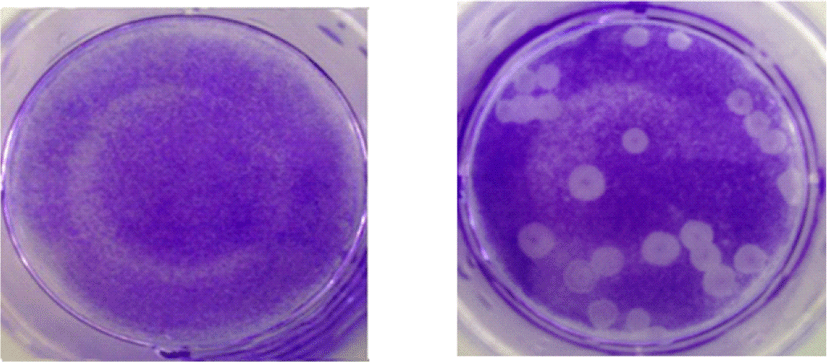
로타바이러스 증식 후 바이러스 titer를 위해 수거한 상등액을 10-fold 단계희석하여 Vero 세포에 감염시킨 뒤 plaque assay를 통해 clear zone을 측정함으로써 결정하였다 (Fig. 3). 바이러스 역가 및 최적의 감염조건을 결정하였고, 본 연구에서는 모두 1.5×105 pfu/mL 농도의 로타바이러스가 사용되었다.
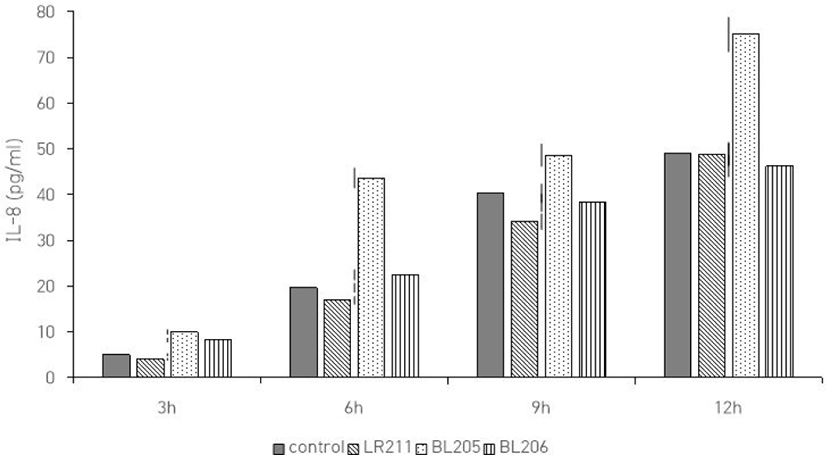
로타바이러스 감염 시 3종 유산균에 의해 나타나는 숙주세포의 IL-8과 MCP-1 변화를 측정하기 위해 ELISA를 이용한 immunoassay를 수행하였다. Vero 세포에 로타바이러스를 감염시킨 후 시간경과에 따라 상등액을 수거하여 ELISA를 이용하여 IL-8와 MCP-1의 변화를 측정한 결과로서 감염된 후 초기에는 분비량의 변화가 거의 없었으나, 시간이 경과됨에 따라 IL-8과 MCP-1의 분비량도 증가함을 확인할 수 있었다 (Fig. 4, 5). 즉, 로타바이러스가 세포 내에서 복제되므로 chemokine 분비량도 증가하는 것으로 추측된다. LR211은 IL-8의 발현량이 대조군에 비해 약 2.4배로 증가하였으며, MCP-1의 발현량도 역시 1.3배로 증가하였다. BL205, 206도 IL-8의 발현량이 각각 1.5배와 1.9배로 증가하였으며, MCP-1의 발현량도 역시 각각 1.4배와 2배로 증가함을 확인하였다.
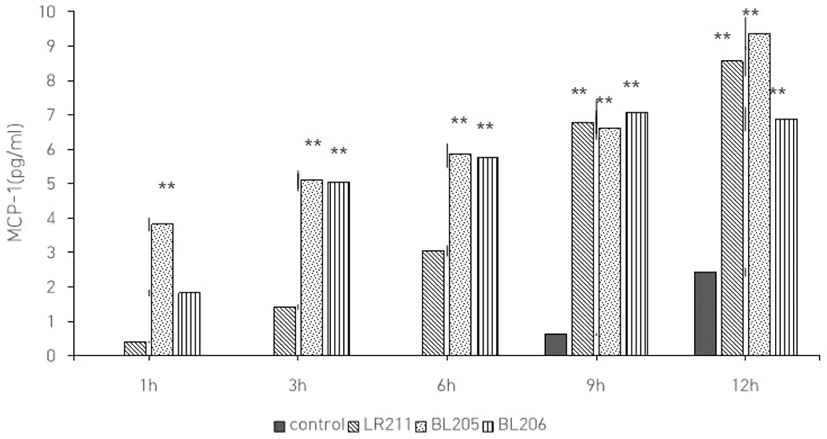
유산균 추출물들의 항바이러스 효능을 갖는 작용 기전을 알아보기 위해 로타바이러스 감염 시 나타나는 chemokine의 변화를 알아보고자 하였다. HT-29에 로타바이러스를 감염시켰을 때 IL-8과 MCP-1의 발현량이 증가한다고 보고되었다(Holloway, 2013). 본 실험에서 수행한 실험결과도 역시 로타바이러스 감염된 후 로타바이러스가 복제되고 증식되는 과정의 흐름에 따라 IL-8과 MCP-1이 증가함을 확인할 수 있었다. 본 연구에서 3종 유산균은 로타바이러스 감염 초기에는 IL-8 및 MCP-1의 발현이 대조군과 비교하여 크게 차이 나지 않았으나, 감염된 24시간 후 로타바이러스만을 감염시킨 대조군보다 IL-8 및 MCP-1의 분비량이 증가하였다.
IL-8과 MCP-1은 대표적인 chemokine으로 급, 만성 염증에서 IL-8은 호중구를, MCP-1은 T 림프구와 단핵구를 감염이 심한 국소 부위로 유도하는 기능을 한다. 따라서 LR211과 BL205, 206의 투여군이 로타바이러스 감염 초기에는 대조군에 비해 이들 chemokine의 분비량 변화가 미미하였으나, 감염이 진행되고 감염부위가 넓어짐에 따라 IL-8와 MCP-1의 발현을 유도하여 활성화된 면역세포를 감염된 부위로 유도하여 감염부위의 면역기능을 증가시키는 것으로 사료된다.
