서 론
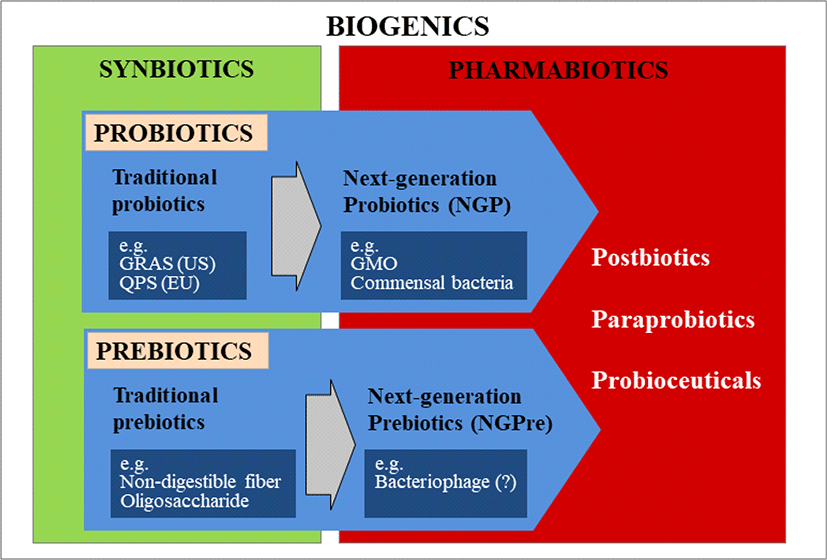
Probiotics의 역사는 1907년 Elie Metchnikoff가 젖산균(lactic acid bacteria)이 사람의 건강에 이로운 역할을 한다는 발표로부터 시작되었다고 볼 수 있다(Anukam and Reid, 2007; Mackowiak, 2013). 이후 식품이나 모유 등에서 유산균이 발견되었고, Werner Kollath(1953)에 의해 처음으로 ‘Probiotic’이란 단어가 사용이 되었다(Martín and Langella, 2019). 110년이 넘는 probiotics 연 구와 함께 관련된 다양한 용어들이 발표되어 왔다. 이에 International Scientific Association of Probiotics and Prebiotics (ISAPP)에서는 2014년 probiotics 관련 용어들을 정리한 바 있고, 지속적으로 갱신하고 있다. 이를 기반으로 한 연구방향성은 전통적 probiotics에서 차세대 probiotics(Next-Generation Probiotics, NGP)로 이동하고 있고, 장 건강에 국한된 연구에서 뇌건강 및 정신건강까지 확장된 개념의 연구개발이 활발히 이루어지고 있다. 2000년 이후 식품 유래의 probiotics 균주 중심의 연구에서 인간/동물의 장유래 마이크로바이옴(commensal microbiome) 연구로, 전형적인 젖산균(Lactobacillus spp., Bifidobacterium spp. etc) 중심의 연구에서 다양성을 고려한 신규 장내균주(Clostridium butyricum, Propionibacterium freudenreichii 등) 개발로 스크리닝 샘플의 다양화, 균주의 확장 및 기능의 확장이 동시에 이루어지고 있다(Collado et al., 2007; Liu et al., 2019). 확장의 방향성은 결국 질병 예방이나 치료를 목적으로 하는 pharmabiotics 분야로 향하고 있다(Fig. 1).
최근 미국에서는 2017년 건강보조식품용 박테리오파지(Bacteriophage) 칵테일제품(PreforPro®)이 등록되어 전통적인 probiotics 균주와 혼합된 형태의 제품이 마켓에 등장했다(Febvre et al., 2019; Gindin et al., 2019). 이는 장내 해로운 미생물들을 특이적으로 저감시키고, probiotics 균주의 장내정착성(colonization) 및 면역반응을 강화하여 probiotics 효율성을 개선하고, 질병 예방 및 개선 효능을 강화시키는 새로운 패러다임으로 주목 받고 있다. 마켓내 Pharmabiotics의 등장이라고 볼 수 있다. 본 총설에서는 probiotics 연구개발의 방향성과 이미 시작된 새로운 R&D 및 제품 트렌드에 대해 요약하고, 향후 연구의 방향성에 대한 제언을 하고자 한다.
본론
Probiotics는 2001년 FAO/WHO에 의해 정의된 바 있으나, 2014년 ISAPP에 의해 “Live microorganisms that, when administered in adequate amounts, confer a health benefit on the host”라고 수정되었다. Probiotics 분야는 probiotics 또는 prebiotics 각각의 연구 분야와 이를 통합한 synbiotics 개념의 중합효과를 중심으로 연구 및 제품화가 진행되고 있다. Probiotics는 전통적 probiotics를 중심으로 연구되고 있는데, 이 미생물들은 발효식품, 분변, 모유 등에서 분리된 미생물들로 미국 Food and Drug Administration(FDA)의 GRAS(Generally Recognized as Safe) 등록 균주, 유럽 European Food Safety Authority (EFSA)의 QPS(Qualified Presumption of Safety) 등록 균주, 한국 식약처 고시균주 등에 명시되어 있다. 이들 목록에서 인정하는 미생물들의 genera는 Lactobacillus, Bifidobacterium, Bacillus, E. coli, Saccharomyces, Enterococcus 등이 있다(George Kerry et al., 2018). 전통적인 probiotics 연구는 관련 정보가 많고 생물공학적 기법이 비교적 잘 연구되어 있어, 다양한 스크리닝 샘플에서 기능적으로 차별화된 균주를 찾기만 하면 제품화가 가능하다. 특히 GRAS, QPS 등의 인증이 된 균주들로 어느 국가에서도 등록절차가 간편하여 단기간내 제품화가 가능한 분야라 각광을 받고 있다. 하지만 제품별 차별화가 어렵고, 소비자에 따라 반응효과도 다양해 효능에 대한 의구심은 항상 이슈가 되고 있다.
Prebiotics의 정의는 2017년 ISAPP에서 “A substrate that is selectively utilized by host/commensal microorganisms conferring a health benefit”로 정의하였다. 1950년대 모유에서 Bifidobacterium의 성장을 돕는 성분을 찾게 되면서 prebiotics의 개념은 정립되었다. 대표적인 prebiotics는 fructo-oligosaccharides(FOS), galacto-oligosaccharides(GOS), trans-galacto-oligosaccharides(TOS) 등을 예로 들 수 있다. Prebiotics의 기능은 선택적으로 이를 이용할 수 있는 장내 유익균의 성장을 돕거나, 장내균에 의한 발효 후 대사산물로 인한 효과 등을 기대 할 수 있다.
예를 들어, Bifidobacterium longum subsp. infantis는 oligosaccharide를 binding하고, 세포 안으로 도입 및 이용할 수 있는 단백질을 생성할 수 있으며, 이를 성장에 활용할 수 있는 대표적인 미생물로 알려져 있다(Garrido et al., 2011).
또한, 장내 미생물에 의해 oligosaccharide 발효시 단쇄지방산(short-chain fatty acids)이 생성되는데 acetic acid, butyric acid, propionic acid 등이 대표적이다. 이들은 장내 점막세포의 발달, 면역 안정화(T-helper2, macrophage, dendritic cell 등) 등을 돕는다고 알려져 있다(Davani-Davari et al., 2019).
Probiotics와 prebiotics를 혼합으로 사용하는 것을 synbiotics 또는 symbiotics라고 한다. Synbiotics와 symbiotics를 종종 혼용하여 사용하는데 사전적인 의미로만 보면, synbiotics는 prebiotics와 probiotics를 혼합하는 것을 의미하고, symbiotics는 probiotics와 prebiotics를 혼합하여 미생물에 이로운 효과를 보이는 제품을 의미한다. Gibson(1995) 등은 synbiotics/symbiotics를 “Mixtures of probiotics and prebiotics that beneficially affect the host by improving the survival and implantation of live microbial dietary supplements in the gastrointestinal tract, by selectively stimulating the growth and/or by activating the metabolism of one or a limited number of health-promoting bacteria, thus improving host welfare”로 정의하였다(Gibson and Roberfroid, 1995). Synbiotics는 장내 내재되어 있는 미생물들 중 prebiotics를 이용할 수 있는 미생물들의 성장을 촉진시키거나 장융모의 건강을 증진시키고, 유용한 probiotics 균주를 함께 공급함으로써 소화를 돕거나 면역을 증진시키는 두 가지 효능을 모두 기대할 수 있다. 그러므로, probiotics의 부형제 개념에 prebiotics를 도입한 synbiotics 제품들이 많이 출시되고 있다.
하지만, 전통적인 probiotics, prebiotics 및 이를 혼합한 synbiotics연구 트렌드가 변화하고 있다. NGP와 신개념의 next-generation prebiotics(NGPre)가 등장하고 질병을 효과적으로 예방할 수 있는 pharmabiotics의 형태로 움직이고 있는 것이다. Shanahan 등(2009)은 pharmabiotics를 “Bacterial cells of human origin, or their products, with a proven pharmacological role in health or disease”로 정의하고 있다. 기존의 probiotics가 식품이나 분변에서 GRAS미생물들을 분리하고, 그 중 건강을 증진시키는 효능이 관찰된 미생물을 활용한다면, NGP는 사람 개체간의 미생물군을 metagenomic 분석을 통해 비교분석하고, 특정 현상을 보이는 개체내 상대적으로 풍부한 미생물(GRAS 및 기타 균주)을 개발하는 방법으로 접근한다. 마이크로바이옴 연구분야에서 진행되고 있는 개체별/그룹별 metagenome 분석 등이 NGP의 대표적인 개발 방법이 되고 있다.
최근 미국 FDA에서는 Live Biotherapeutic Products(LBP)라는 용어를 사용하기 시작했고, “A biological product that contains live organisms; is applicable to the prevention, treatment or cure of a disease or condition of human beings; and is not a vaccine.”라고 정의하고 있다. 일반적으로 NGP는 LBP를 포함할 뿐 아니라, 유전자변형 미생물, 장유래 미생물(commensal bacteria) 및 기타 조성물도 포함하는 광범위 개념이다(Martín and Langella, 2019). 대표적인 미생물 예로는 Akkermansia muciniphila(Cani and de Vos, 2017), Faecalibacterium prausnitzii(Martín et al., 2018), Bacteroides fragilis(Wang et al., 2017), Enterococcus mundtii(Grau et al., 2017) 등을 들 수 있다. 이들 미생물들은 면역이나 항균 등의 효능이 우수한 균주로 마이크로바이옴 분야에서 많은 과학자들이 연구하고 있다(Langella et al., 2019). 예를 들어, Akkermansia municiphila는 2004년 처음 연구발표되었으며(Derrien et al., 2004; de Vos, 2017), 비만, 당뇨, 면역 안정화 등에 효능이 있는 균주로 보고되고 있다(Cani and de Vos, 2017; Derrien et al., 2017; Everard et al., 2013).
NGPre란 용어는 publish 된 바 없으나, 최근 미국에서 prebiotics의 개념으로 bacteriophage가 등록되었고, 이는 차세대 prebiotics로 볼 수 있다(Febvre et al., 2019; Gindin et al., 2019). Bacteriophage는 1930년대부터 동유럽(러시아, 조지아, 폴란드)에서는 환자 치료용으로 사용이 되고 있고, 2006년부터 미국에서는 식품첨가물로 등록이 되었으며, 2010년부터 한국에서는 항생제를 대체하기 위한 사료첨가제로 등록되었다. 모두 세균성 질병을 예방하거나 치료의 목적으로 등록이 되어 사용되고 있으므로 prebiotics와는 개념이 다르다. 그럼에도 불구하고 bacteriophage의 사용이 장내 해로운 미생물을 사멸하고, 이로운 미생물들이 더욱더 잘 자랄 수 있도록 도와주는 개념을 적용하여 prebiotics로 등록이 되었다. 그동안 내재 미생물의 생육을 돕는 수동적 의미의 prebiotics 였다면, 이제는 직접 해로운 미생물의 균수를 줄여 장내 생태학적 환경을 개선하고, 상대적으로 이로운 미생물의 생장 기회가 증가할 수 있도록 하는 능동적 prebiotics가 될 것으로 기대된다. 그럼에도 불구하고 아직 bacteriophage의 prebiotics 포함 여부에 대한 논쟁은 있을 것으로 사료된다.
Pharmabiotics는 미생물에만 국한하는 것이 아닌 bacteriocin, bacteriophage, bioactive molecule등을 포함하고 있다. Pharmabiotics에 포함되는 대표적인 분야를 보면 postbiotics, paraprobiotics, probioceuticals(probiotaceuticals) 등이 있다.
Postbiotics는 “Non-viable bacterial products or metabolic products from microorganisms that have biologic activity in the host”(Patel and Denning, 2013)로 정의되고 있다. 예를 들면, 장내에서 미생물 발효에 의해 생성되는 butyrate와 같은 단쇄지방산(short-chain fatty acid)이 있다. Butyrate는 장점막을 건강하게 하고, 융모가 성장하는데 도움을 주는 물질로 알려져 있다(Canani et al., 2011). 또 다른 예로 Lactobacillus rhamnosus GG균이 생성하는 단백질(JM0539)이 장 상피세포를 안정화하여 LPS 또는 TNF-α에 기인한 유해성 증상들을 예방해주는 효과가 보고된 바 있다(Gao et al., 2019).
Parabiotics는 ghost 또는 불활성화 probiotics로 불리기도 하며, “Non-viable microbial cells(either intact or broken) or crude cell extracts which when administered(either orally or topically) in adequate amounts, confer a benefit on the human or animal consumer”(Taverniti and Guglielmetti, 2011)로 정의되고 있다. 사전 열처리를 통해 유산균을 불활성화(heat-killed probiotics)를 한 후 음료수 또는 사료첨가제로 사용하는 제품들이 parabiotics의 좋은 예라 할 수 있다(Patel and Denning, 2013; Piqué et al., 2019). 이 경우, 미생물의 안정성(stability)은 강화하면서 미생물 외부의 항원은 유지하여 장의 점막에서 면역작용을 유도할 수 있는 장점을 갖고 있다.
Probioceuticals(probiotaceuticals)는 “Probiotics derived factors”를 의미하며, 예를 들어 gram positive 미생물의 생장을 저해하는 Lactobacillus lactis 유래의 nisin, 미생물이나 기타 감염생물(yeast, molds, protozoa, viruses)의 성장을 방해하는 Lactobacillus reuteri 유래의 reuterin 등을 예로 들 수 있다(Talarico and Dobrogosz, 1989).
2017년 미국에서는 4개의 E. coli phage(LH01-Myoviridae, LL5-Siphoviridae, T4D-Myoviridae, LL12-Myoviridae)를 혼합한 prebiotics제품이 등장했다. 이 4개의 Phage 칵테일은 용균성(lytic) phage로 확인되었으며, E. coli K12, 16개 장독소성 E. coli(enterotoxigenic), 2개의 용혈성 E. coli(enterohemorrhagic)를 포함한 대장균을 사멸하는 활성 스펙트럼을 갖고 있다(Gindin et al., 2019). Bacteriophage 칵테일을 여러 probiotics제품들과 혼합 사용한 결과, 각각의 probiotics 단독 사용 대비 장정착능과 기대하는 질병학적 예방 효과가 모두 향상된 것을 관찰 한 바 있다(FloraphageTM, 2014).
Bacteriophage의 식품적용은 2006년 미국 FDA에서 식품첨가물로 승인하면서 시작되었다. 등록된 bacteriophage는 Listeria monocytogenes를 타겟하는 Listeria phage로서 ready-to-eat meat & poultry의 가공 후 포장 전 직접 표면에 분무하는 식품첨가물로 등록되었다(Moye et al., 2018). 이후 총 10건의 단독 또는 phage 칵테일이 미국 FDA로부터 GRAS 등록을 받고 식품 전분야 적용이 가능해졌다(Table 1).
사료 첨가제로서의 적용은 2010년 한국에서 처음으로 Salmonella Gallinarum bacteriophage가 등록되면서 허용이 되었다. 2011년 국내 사료에 사용되는 항생제의 전면 사용 금지가 시행되면서 항생제를 대체할 천연물로 사용이 되었다. 현재까지 총 5종 bacteriophage가 사료기준법령(보조사료의 범위)에 등재되었다(Salmonella Gallinatum phage, Salmonella Typhimurium phage, Salmonella Enteritidis phage, Clostridium phage, E. coli phage). 이렇듯 bacteriophage는 식중독균이나 가축 질병 세균을 직접 타겟하여 질병을 예방을 하기 위해 등록되어 왔으나, prebiotics 개념을 도입한 경우는 처음이다.
상기 bacteriophage 칵테일(PreforPro®)을 43명(연령 18–65세) 대상 28일 동안 복용시험(106pfu/dose)을 실시했을 때, Phyla-l evel에서의 변화는 관찰되지 않았으나, 피시험자의 71%가 대장균이 감소되었거나, 검증수준 이하로 관찰(위약그룹 피시험자 47%만 감소) 되었고, 이는 대장균 유래 lipopolysaccharides(LPS) endotoxin의 양을 줄여 inflammation의 기회를 낮추는 것을 확인하였다(Gindin et al., 2019). 또한, butyrate 생산 미생물군인 Eubacteria 는 위약그룹보다 4–5배의 증가가 관찰 되었다. 혈중 cytokine 지표 중 IL-4가 유의적으로 감소했는데(69.48 pg/mL → 59.83 pg/mL) 이는 아토피 등의 Th2 반응에서 많이 생성되는 것으로 알려져 있다. 상기 지표의 감소는 아토피 등의 과민성 면역반응을 안정화 시킬 수 있을 것으로 기대된다(Febvre et al., 2019).
상기 bacteriophage와 함께 사용하는 probiotics의 균종에 따라 기대하는 효과는 다양하게 나타나며, probiotics 단일 복용에 비해 장내 정착되는 균주의 수는 평균적으로 약 24배(적용 probiotics 제품에 따라 약 3배–50배 증가) 증가한다고 보고하고 있다(FloraphageTM, 2014). 현재 미국내 판매되는 “probiotics with phage” 제품은 증가 추세이며, 함께 적용되는 probiotics균주는 Lactobacillus spp., Bifidobacterium spp., Bacillus spp., Streptococcus sp. 등이 주로 사용되고 있다(Table 2). Probiotics 균주의 다양화에 따라 bacteriophag를 prebiotics개념으로 적용하여 그 효능을 강화하는 사례는 점차 증가할 것으로 예상된다.
결 론
최근 마이크로바이옴 연구가 증가하면서 probiotics와의 구분점이 불분명한 경우가 있다. ISAPP에 따르면, 마이크로바이옴은 NGP의 범주에 포함되며, 전통적 probiotics 균주의 범위가 장내미생물로 확대된 개념으로 볼 수 있다. 특히 probiotics의 기능성이 강조 되고 있고, 타겟도 점차 복잡한 질병을 타겟하는 pharmabiotics로 진화하고 있어서 미생물뿐 아니라, bacteriophage, endolysin (phage가 미생물 membrane을 해리할 때 사용하는 효소), 단쇄지방산 등의 개발 및 synbiotics 연구가 더욱더 활발해 질 것으로 예측된다. 특히 bacteriophage는 타겟하는 미생물에 대한 사멸 기작이 매우 명확한 바이러스성 천연물로, 마이크로바이옴 연구에 따라 유해한 미생물이 선정이 되면 이를 직접 저감 할 수 있는 매우 효과적인 소재가 될 것으로 예상된다. 단, 미국에서는 FDA내 GRAS 등록된 phage가 있어 신규 등록의 난이도가 높지 않으나, 국내의 경우 사료첨가제(농림축산식품부 담당) 외 식품이나 의약품으로는 등록(식품의약품안전처 담당) 되어 있지 않아 신규 등록의 어려움이 예측된다. 학계와 산업계는 정부 담당부처와 함께 NGP 및 NGPre를 최대한 활용하기 위한 연구, 응용 및 등록 등에 대해 함께 고민해야 할 때이다.
