서 론
최근 국민 건강영양조사를 통해 나타난 우리나라 국민의 식생활 형태는 만성질환의 예방과 식생활의 질을 개선하기 위해 다양한 영양 정보에 관심이 고조되고 있는 것으로 파악되었다(KDCA, Yun and Oh, 2018). 우리나라는 경제가 발전하면서 식생활이 풍부해지고, 식사패턴의 변화로 인해 대사증후군, 고혈압 등 만성질환이 증가하고 있다(Yook et al., 2015). 질병관리청에 따르면 만 30세 이상 고혈압 유병률은 2007년에서 2018년 3.8% 증가하였으며, 특히 남자가 여자보다 1.4배 높다고 보고하였다(KDCA, 2020).
유산균은 오랜 시간 동안 채소발효 식품 및 유제품과 같은 식품의 발효에 사용됐다(Lee et al., 2015; Park et al., 2014). Probiotics는 섭취 시 장내 환경에 유익한 영향을 주는 살아있는 미생물로 Lactobacillus sp.와 Bifidobacterium sp.이 대표적이다(Lee et al., 2017). 주로 인간의 장 건강에 유익한 영향을 미치며(Park and Lee, 2017; Zocco et al., 2006), 면역력 강화 및 항암 효과가 알려져 있다(Oh et al., 2020). 유산균은 일반적으로 안전하다고 인식되는 미생물(GRAS, generally recognized as safe)로서, Berger’s Manual에서는 그람양성 구균과 간균에서 다루고 있다. 유산균은 G+C 50 mol% 이하의 그람양성, non-spore-forming의 구균, 간균, 또는 구간균이다(Kim et al., 2011). 김치에서 검출된 Lactiplantibacillus 균주는 박테리오신을 생성하여 Listeria monocytogenes 성장을 억제하는 항균작용도 보고되었다(Castro et al., 1995; Olson and Aryana, 2007; Sheo and Seo, 2003). 박테리오신 및 유기산 등의 항균 활성 물질을 생성하여 식품의 저장성에도 기여함으로써(Kim et al., 2011; Nighswonger et al., 1996), 부패에 의한 식품 보존성의 향상, 대사산물에 의한 풍미 증진, 길항물질 생성 및 유용물질의 합성에 의한 건강증진을 목적으로 광범위하게 이용되고 있다(Lee et al., 2001). 변비 예방, 혈중 콜레스테롤 저하 및 병원성 식중독 억제 등 유산균의 기능성이 알려지면서 유산균의 활용 및 산업화에 대한 인식이 재평가되고 있다(Klaver and vander Meer, 1993; Ko et al., 2013). 이처럼 다양한 기능성 성분을 증진시키고, pH를 낮추어 식품의 저장성을 높이는 역할로 육류 등 다양한 식품에 많이 이용되고 있다(Oh et al., 2020). 또한 유산균은 각종 건강기능식품에도 광범위하게 이용되고 있으며(Kim et al., 2019), 최근에는 유산균을 첨가한 식품에 관한 연구가 많이 진행되고 있어 제품으로도 출시되고 있는 실정이다. 우리나라 건강기능식품 기능성 원료 인정 현황(식품의약품안전처, 2016)에 유산균을 포함한 프로바이오틱스의 기능성 내용은 “유산균 증식 및 유해균 억제, 배변 활동 원활에 도움을 줄 수 있음”으로 규정하고 있으며, 프로바이오틱스의 기능(지표) 성분은 “생균 수” 그리고 일일 섭취량은 프로바이오틱스로서 108–1010 CFU로 규정하고 있다. 이에 따라 국내 기업에서는 식품 성분 표시 및 표시된 기능성 홍보에 관한 마케팅을 활발하게 실시하고 있다(Song and Im, 2016). 소비자들은 식품의 양보다 품질과 효능을 중요시하며(Lee, 2012), 식생활과 지속 가능한 소비의 중요성이 부각되고 있어 기능성 식품 사용(Park et al., 2019)과 건강적인 측면에 대한 관심이 증가함에 따라 제품의 표시를 자세히 알고자 한다(Song and Im, 2016). 따라서 최근 유산균을 다양한 식품에 적용하는 추세로 본 연구에서는 시중에 유통되고 있는 유산균 함유 제품(비스킷류, 샌드류 및 초콜릿류)의 유산균 동정(identification)을 위해 MRS agar와 BCP agar를 이용하여 유산균을 분리한 후, 16S rRNA 유전자 염기서열 분석방법을 이용하며, 저장 기간에 따른 유산균 생균 수의 변화를 분석하였다. 또한 제품에 표시된 유산균의 함량이 유통기한(6개월) 동안 유지되는지를 확인하였다.
재료 및 방법
본 실험에 사용한 시료는 서울 광진구 대형마트에서 구입하여 30분 이내 실험실로 옮겼다. A는 비스킷류, B 및 F는 샌드류, C, D 및 E는 초콜릿류로, 실험이 끝날 때까지 실온(25℃)에서 저장하였다. Lactobacilli MRS agar(De Man, Rogosa and Sharpe, Difco, USA)와 BCP plate count agar(Bromocresol purple, Eiken Chemical Co., Ltd, Japan)를 사용하여 유산균의 집락을 분리 및 배양하였다. Stomacher bag(Stomacher 400 Circulator Bags, Seward, UK)에 시료를 넣고, 9배량의 멸균 증류수를 넣어 실온(25℃)에서 300 rpm, 10분간 균질하였다(Stomacher® 400 Circulator, Seward, UK). 균질액을 멸균 증류수로 희석한 후, MRS agar와 BCP agar 평판 배지에 각각 분주하였다(MFDS, 2021). 위 과정을 3 반복 진행하였으며, 시료가 접종된 petri dish를 37℃에서 48시간 배양 후 시료 g당 생균 수를 산출하였다. 유산균 생균 수 측정은 제조일로부터 1개월 간격으로 총 7개월간 실시하였다.
시험 용액 제조 희석액은 멸균 증류수 또는 펩톤 식염 완충액을 사용하였다. 시료 10 g에 희석액 90 mL를 가하여 균질하였다. 균질액 1 mL를 희석액 9 mL에 10진 희석법으로 희석하였다. 단계 희석 용액을 MRS agar와 BCP agar 평판 배지에 각 3 반복 접종 및 도말하였다. 시료가 접종된 petri dish는 37℃에서 48시간 배양하였다. 배양한 후 모양이나 크기가 다르게 나온 집락을 백금이로 새로운 MRS agar에 획선도말하여 유산균을 분리하였다.
위 과정에서 분리된 유산균 집락을 DNA extraction kit(PowerPrepTM DNA Extraction from Food and Feed Kit, Kogenebiotech, South Korea)로 DNA를 추출하였다. 시료에서 분리한 균주의 신속한 동정을 위하여 16S rRNA sequencing 동정을 수행하였다. 27F(5’-AGA GTT TGA TCC TGG CTC AG-3’)와 1492R(5’-GGT TAC CTT GTT ACG ACT T-3’) primer를 사용하여 중합효소연쇄반응(polymerase chain reaction, PCR, Marsiling Industrial Estate Road 3, Singapore 739256)으로 변성(95℃, 20초), 결합(50℃, 40초), 신장(72℃, 90초) 순으로 30회 반복하여 DNA를 증폭시켰다. PCR 산물은 purify 실시하여 1% agarose gel(invitrogen, New Zealand)로 전기영동한 후 Gel 이미지 분석장치(SYEGENE)에서 UV로 결과를 확인하였다. 염기서열 결정용으로는 27F, 1492R primer를 사용하였으며, 각각의 결과를 보정한 후 BLASTN program(http://blast.ncbi.nlm.nih.gov/Blast.cgi)을 사용하여 해당 균주를 동정하였다. 계통학적 분석은 Clustal X, BioEdit, MEGA 4(www.megasoftware.net/)를 이용하여 염기서열 간의 유전자 거리와 phylogenetic tree를 확인하였다.
결과 및 고찰
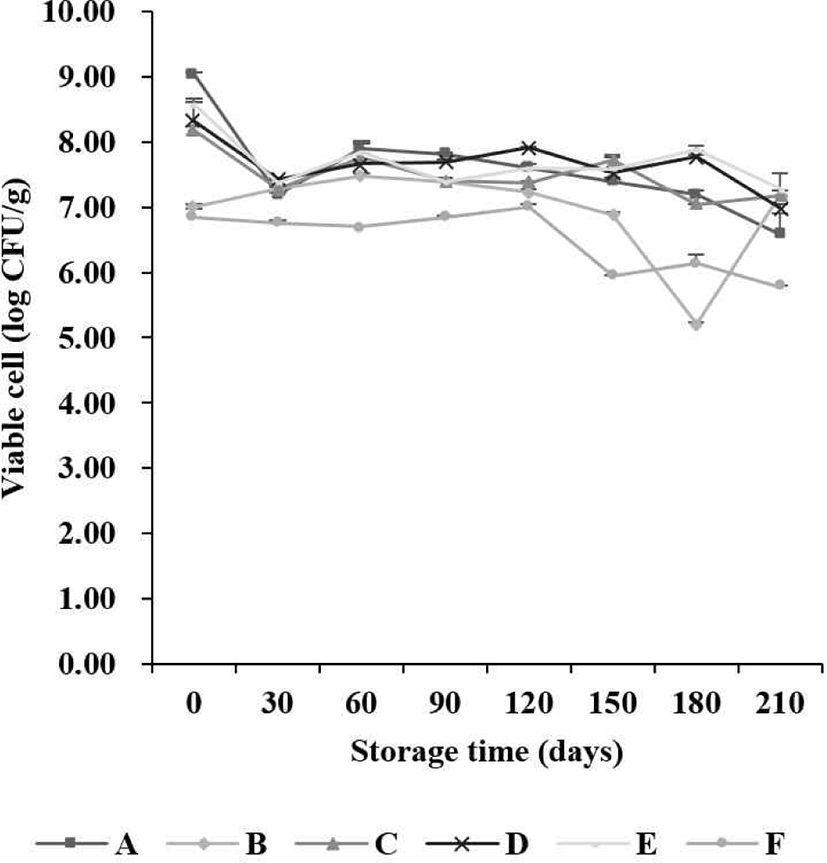
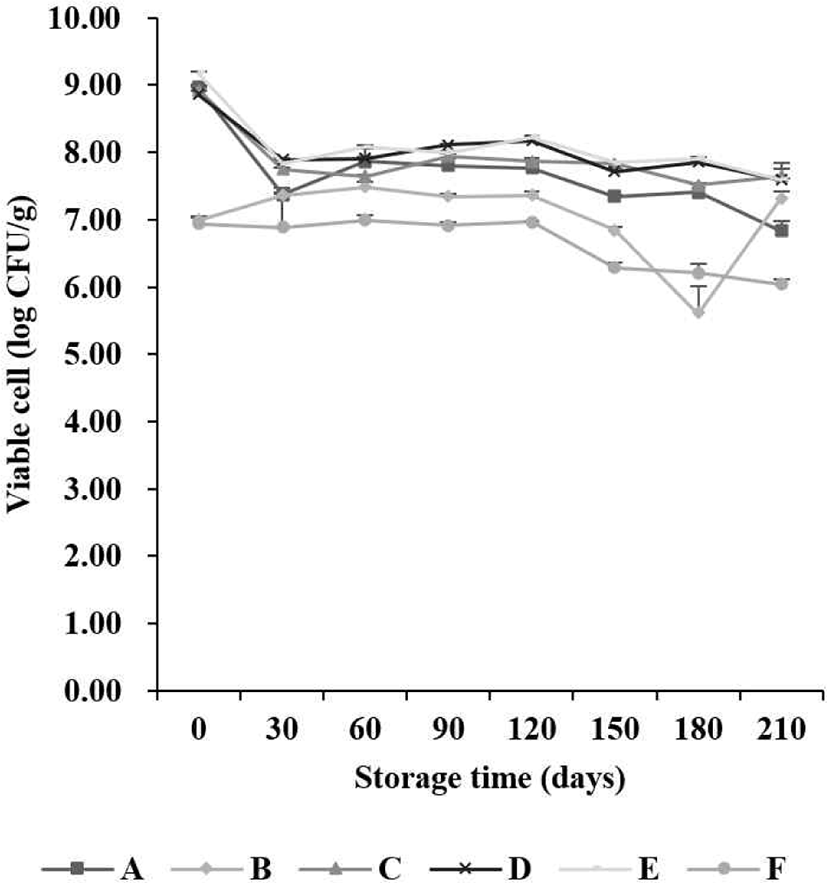
본 실험에서 유산균 첨가 6개 시료를 7개월 저장 기간 동안 MRS agar에서 검출된 유산균 생균 수의 변화는 Fig. 1과 같다. 초기 1 g 당 유산균 생균 수는 6.85–9.04 Log CFU/g,1개월 차 6.75–7.43 Log CFU/g, 2개월 차 6.70–7.91 Log CFU/g, 3개월 차 6.85–7.81 Log CFU/g, 4개월 차 7.00–7.91 Log CFU/g, 5개월 차 5.95–7.73 Log CFU/g, 6개월 차 5.20–7.89 Log CFU/g 및 7개월 차 5.78–7.20 Log CFU/g이 검출되었다. 7개월 동안 유산균 생균 수는 유의적으로 감소하는 경향을 나타냈다. BCP agar에서 검출된 유산균 생균 수의 변화는 Fig. 2와 같다. 초기 유산균 생균 수는 6.93–8.96 Log CFU/g으로 나타났으며, 7개월 차에서 6.04–7.63 Log CFU/g이 검출되었다. 7개월 동안 유의적으로 생균 수가 감소되는 것을 확인하였다. 유산균 생균 수의 차이를 관찰한 결과, MRS 및 BCP agar에서 저장 기간이 지남에 따라 감소하는 경향을 보였다. 시료별 유산균 생균 수 함량 차이는 시료의 생산 과정 중에 유산균 함량 차이로 볼 수 있으며, 저장 기간 중 일정한 유산균 생균 수를 유지하다 기간이 길어짐에 따라 감소하는 현상이 나타났다. 이는 시료가 저장되는 과정에서 온도와 같은 외부 조건으로 인해 유산균의 생존율에 영향을 미치기 때문인 것으로 판단된다(Lim et al., 2015).
본 연구는 식품의약품안전처에서 인증한 식품위생검사기관과 교차 검증하였다. 식품위생검사기관에서 기간별 시료(A, B, C, D, E, F)의 평균 유산균 생균 수는 6.58 Log CFU/g 이상 유지하였으며, 저장 기간이 길어짐에 따라 감소하는 경향을 나타냈다(Fig. 3). 본 연구의 기간별 시료(A, B, C, D, E, F)의 MRS agar에서 검출된 유산균 생균 수와 식품위생검사기관의 결과에 대한 유사도를 비교하여 최소 및 최댓값을 Table 1에 나타냈다. 유산균 생균 수의 교차 검증 결과, 7개월 동안 76.0%–100%로 일치하는 경향을 나타냈다.
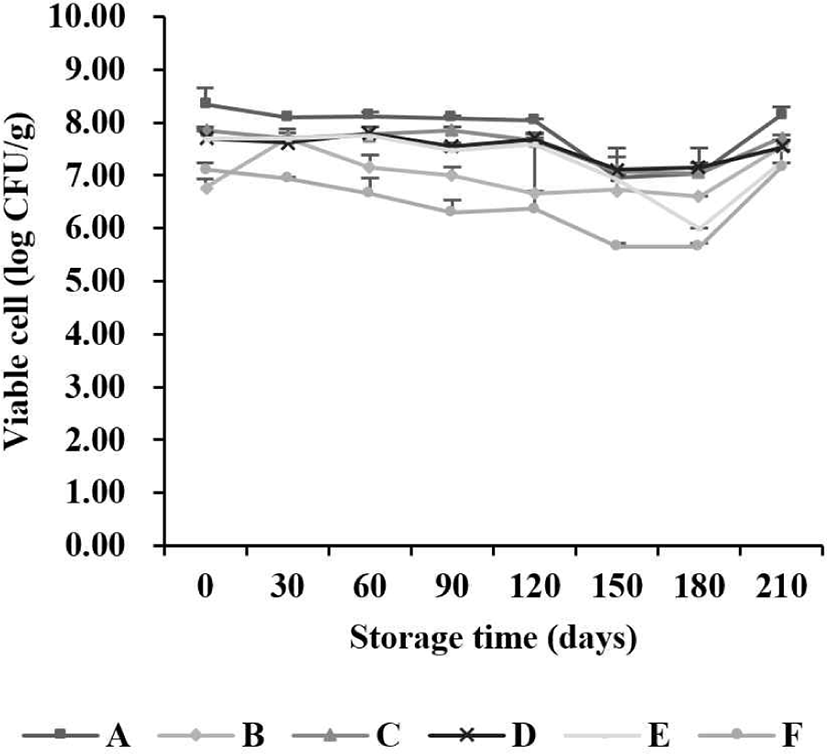
Table 2에서는 각 제품의 외포장지에 표시된 유산균 함량을 비교하였다. 7개월 동안 시료에서 검출된 유산균 생균 수와 표시된 함량을 비교한 결과 A(4×108 CFU/65 g), B(2×108 CFU/74 g), C(2×108 CFU/40 g), D(2×108 CFU/40 g), E(2×108 CFU/45 g) 및 F(2×108 CFU/74 g)는 외포장에 표시된 유산균 함량 이상을 유지할 수 있었다. 전체적으로 외포장지에 표시된 유산균 함량은 본 실험의 결과보다 적게 표시되었으며, 유통기한(6개월) 동안 유산균의 함량은 유지되었다. 식품을 통해 건강을 유지하려는 소비자의 욕구가 증대함으로써 본 연구의 표시 함량은 소비자의 요구에 부합된다. 원재료명 및 함량, 성분명 및 함량, 영양성분은 세부 표시 기준으로, 이러한 표시는 식품 선택, 식생활 개선, 식품의 안전성을 확보하기 위한 제도적 장치로 중요성이 강조되고 있다(Jung and Kim, 2016).
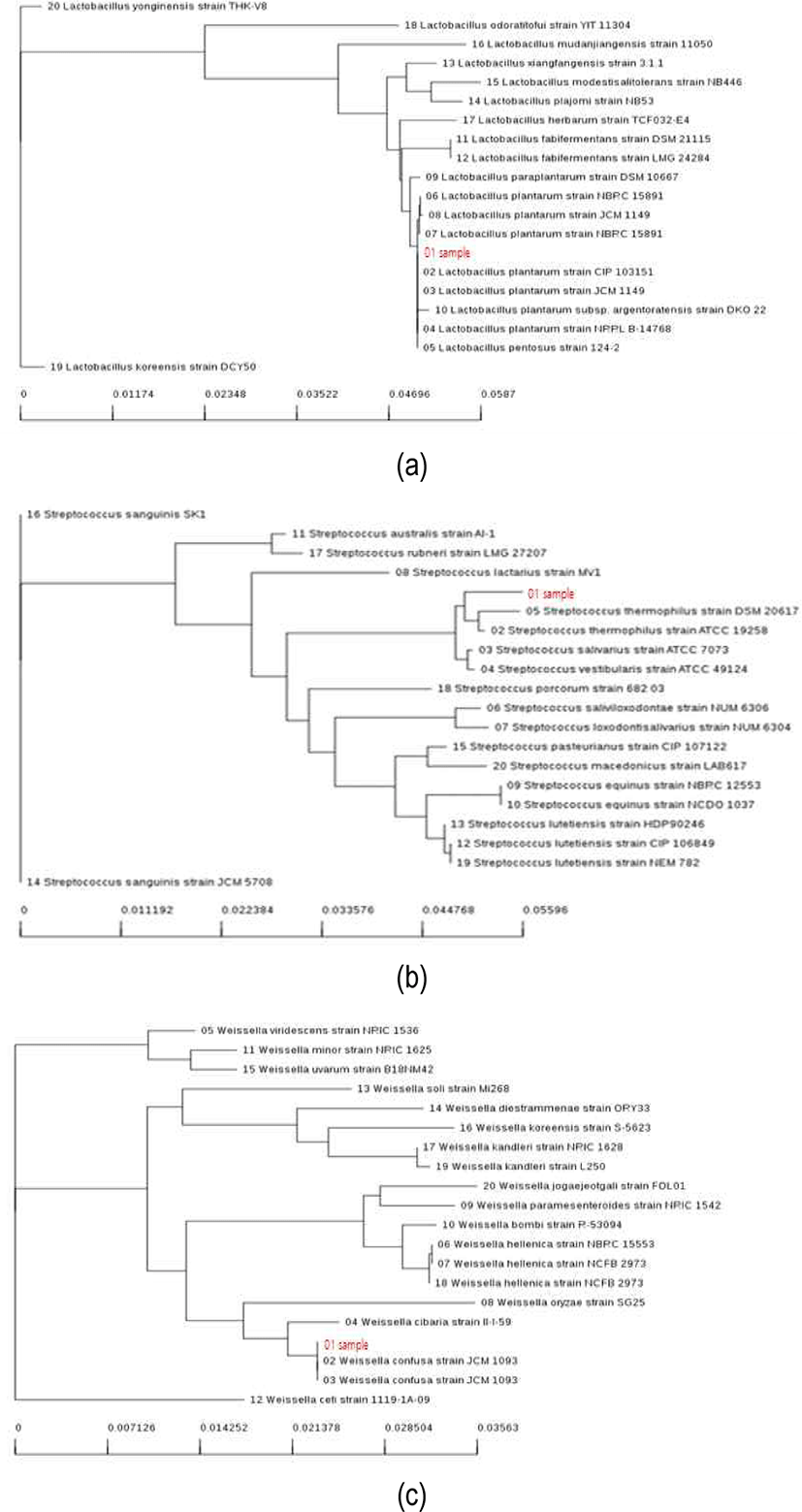
6가지 시료의 유산균을 분리 배양하여 모양과 크기가 다른 20개 colony를 선택하여 동정한 결과는 Table 3과 같다. 분리된 유산균의 종류는 시료에 따라 유의한 차이가 있었는데, 이는 시료의 제조와 발효 환경의 차이에 기인하는 것으로 판단된다(Lim, 2020). 유산균을 동정한 결과, 독립적인 집락을 얻을 수 있다. 시료에 포함된 유산균의 85%는 Lactiplantibacillus(96%–100%), 10%는 Streptococcus thermophilus(99%), 5%는 Weissella confusa(99%)로 확인되었으며, 그 결과에서 85% Lactiplantibacillus가 가장 많이 동정되어 우점종을 나타내고 있다. 시료에서 분리한 균주의 유전학적 안전성을 확인하고자 16S rRNA 유전자 염기서열을 이용하여 동정한 결과는 Fig. 4와 같다. 본 연구에서 동정한 Lactiplantibacillus, Streptococcus thermophilus 및 Weissellaconfusa는 식품의약품안전처 건강기능식품의 기준 및 규격에 등재되는 등 안전성이 확인된 균주로 식품의 원료로 사용이 가능할 것으로 판단된다(Kang et al., 2013). 이러한 균주들이 분비하는 박테리오신의 특성을 분석하는 등 유산균들의 항균 활성에 관한 연구가 많이 이루어지고 있다. 또한 전통장, 전통주 등 식품 산업에 있어서 박테리오신 생산 균을 분리하고, 이를 조사하는 연구(Beak et al., 2012; Jung et al., 2009)가 다양하게 진행되고 있다. 이처럼 박테리오신에 대한 연구가 지속적으로 진행되고 있는데, 이는 원재료로부터 Escherichia coli 등 대장균군의 유입이나 과도한 발효로 인한 산패균의 생육으로 품질이 저하되는 것을 막을 수 있을 것으로 평가되기 때문이다. 상품 스낵에 대한 수요가 증가하고, 품질 유지기한의 연장이 요구됨에 따라 스낵 제조 산업에서는 이러한 문제점을 해결하기 위한 일환으로 박테리오신을 생산하는 유산균 스타터의 개발이 필요하게 되었다. 본 연구에서 검출된 3가지 균 이외에도 안전성이 확인된 유산균의 첨가는 식품의 기능성을 향상시킬 수 있다.
요 약
본 연구는 시중에 유통 중인 유산균 첨가 시료 6개를 7개월 동안 저장하여, 유산균 생균 수의 변화와 우수 균종을 분리 및 분석하고자 하였다. 제품별 저장 기간에 따라 유산균 생균 수의 변화는 MRS agar에서 9.04 Log CFU/g에서 7.20 Log CFU/g, BCP agar에서 8.96 Log CFU/g에서 7.63 Log CFU/g으로 7개월이 경과한 후에 유의적으로 감소하였다. 식품위생검사기관에서 기간별 시료의 평균 유산균 생균 수는 6.58 Log CFU/g 이상 유지하여, 본 연구 결과와 76.0%–100% 일치하는 경향을 나타냈다. 제품의 유산균 표시 함량은 2.7×106–6.2×106 CFU/g으로 표시되었으며, 본 연구 결과에서 1.5×107–1.4×108 CFU/g 이상 검출되어 실제 외포장지의 표시 함량은 올바른 표시에 부합되었다. 검출된 유산균 중 우점종(85%)을 최종 선발하여 16S rRNA 유전자 염기서열 분석 결과, Lactiplantibacillus(identity 100%), Streptococcus thermophilus 10%(identity 99%) 및 Weissella confusa 5% (identity 99%)로 동정되었다. 이는 본 연구의 시료에서 검출된 우수 균주로, 위 균주 외에 또 다른 우수한 균주를 선발하여 식품에 접목하는 연구가 필요한 것으로 생각된다. 또한 6개 제품 모두 7개월 후 유산균 수 함량이 107–108 CFU/g으로 확인되었으며, 실험한 제품류(비스킷류, 샌드류 및 초콜릿류)의 외포장지에 표시된 유산균 함량은 본 실험의 결과보다 적게 표시되었으며, 유통기한(6개월) 동안 유산균의 함량은 유지되었다.
