서 론
최근 경제성장과 국민소득의 증대됨에 따라 건강에 대한 관심이 높아지는 반면, 식생활 패턴이 서구화되면서 당뇨병의 유병율이 증가되고 있다. 현재 당뇨병 치료에는 경구용 혈당강하제로 설포닐요소제(sulphonylurea), 비구아니드(biguanide)계 약물, α-glucosidase 저해제, 티아졸리딘(thiazolidine)계 약물 등과 인슐린 요법, 췌장이식 등을 사용하고 있다(Kim and Min 2005). 타 약효군의 약물과 비교하여 α-glucosidase 저해제의 부작용인 복부팽만 및 설사 등은 상대적으로 부작용이 경미하고, 당뇨 및 비만관리에 유의적 효과가 있는 것으로 보고되고 있다. 본 연구에서는 곡류발효를 이용한 유효성분의 증가, 흡수율의 증가 등의 효과를 통해 α-glucosidase 억제 소재에 관한 연구를 수행하고자 한다.
귀리(Avena sativa L.)는 벼과에 속하는 곡류로 독성 및 부작용이 없어 심장혈관계에 의한 사망률이 높은 선진국에서 많이 소비되고 있는 곡물이다. 귀리의 비전분 다당류(non-starch polysaccharide)인 (1→3), (1→4)-β-D-glucan은 곡류 알곡의 배유와 호분층 세포벽을 구성하고 있는 성분으로 다양한 생리효능이 알려져 있다(Clemens et al., 2014). 특히, 풍부한 식이섬유 함유로 혈당, 인슐린, 혈압을 낮추며 체지방 축적을 억제하여 비만과 관련된 증상을 완화시켜 성인병 예방에 효과가 있는 것으로 알려져 있다(Choi et al., 2000; Kim et al., 2002). 한편, 곡류의 외피 등에서 다양한 곡류 유래의 β-glucan이 생산되고 있으며(Yoo et al., 2009), 담즙산 분비 증가에 대한 보고 및 비만과 대사증후군 개선 효과, 박테리아와 기생충에 의한 감염에 대한 저항효과에 관한 연구들이 수행되었다(Lia et al., 1995; EI-Khoury et al., 2012; Yun et al., 2003). 그러나 상대적으로 항당뇨 및 혈당상승 억제에 관한 연구는 빈약한 설정이며, 이에 귀리의 곡류발효 추출물을 이용하여 혈당강하 효능을 조사하고자 한다.
고체발효법(solid-state fermentation, SSF)은 잉여수분이 최소화된 고체의 표면에서 부착 미생물을 배양하는 발효방법으로 발효식품 생산에 널리 사용되고 있다. 발효는 미생물을 이용하여 유기물을 분해시키는 과정으로 영양성분을 그대로 유지하면서 미생물이 분비하는 각종 가수분해효소와 세포 내 조직에 결합되어 있는 생리활성물질들이 유리화되면서 생체이용률을 향상시킨다(Robinson et al., 2001; Shin et al., 2014). Aspergillus 속 미생물은 amylase와 protease를 생산하는 대표적인 세균 중 하나로 다량의 효소를 분비하는 능력, 효소 대량생산에 적합한 발효 특성, 식품 및 사료 사용의 안전성 등의 이유로 생물산업분야에 활용되고 있다(Balakrishnan et al., 2021; Sandhya et al., 2005). 따라서 본 연구에서는 Aspergillus niger NIBRFGC000134713를 이용한 액체발효(liquid state fermentation, LSF)와 고체발효(SSF)의 발효조건 최적화 및 효소, β-glucan 생산과 곡류발효 추출물을 이용하여 rat 소장 유래의 α-glucosidase inhibition 시험을 통해 혈당강하 효능에 대한 연구를 수행하였다.
실험 재료 및 방법
본 실험에 사용된 귀리는 소화농장(Yecheon-gun, Korea)에서 구매하였으며, 시약들은 reagent grade로 Sigma Chemical Co. (St. Louis, MO, USA)로부터 구매하였다.
곡류발효용 미생물인 A. niger NIBRFGC000134713은 국립생물자원관(NIBR, Incheon, South Korea)에서 분양받았으며, 곡류발효에 대한 seed culture는 포자 1×108 spores/mL를 접종하여 shaking incubator에서 30°C에서 150 rpm으로 48 h 배양하였다. 액체발효배지(synthetic medium) 조성은 50 g/L 귀리 분말(whole oat flour), 20 g/L 미강 분말(rice bran), 20 g/L tryptone을 첨가하였으며, 추가 배지성분으로 3 g/L K2HPO4, 2 g/L MgSO4, 10 g/L NaCl, 2 g/L CaCl2, 7 g/L ascorbic acid (vitamin C)를 따로 멸균하여 접종 전에 액체발효 배지에 첨가하였다. 액체발효배지(synthetic medium)는 250 mL flask (working volume 100 mL)에서 121°C에서 15분간 멸균한 배지를 사용하였다.
A. niger NIBRFGC000134713를 이용한 액체발효는 250 mL Erlenmeyer flask에서 working volume 100 mL로 30°C, 150 rpm, 120 h 동안 발효를 진행하였다. One-factor-at-a-time 방법을 통해 주요 배지조성 분석을 진행하여 각각의 인자들이 미생물의 성장, 효소 생산 및 β-glucan 생산에 어떠한 영향을 미치는지 확인하였다. 배지조성은 액체발효배지(synthetic medium)를 사용하여 귀리분말(whole oat flour) 농도, 질소원(nitrogen) 종류 및 농도, 미강(rice bran) 농도를 변형시켜 주요 인자의 최적 농도를 결정하였다. 추가배지를 첨가한 뒤, seed culture의 종균을 5% (v/v)로 접종하고, shaking incubator(IS-10, DAIHAN Scientific Co. Ltd, Wonju, Korea)를 이용하여 액체발효를 수행하였다.
귀리 100 g과 150 mL의 증류수를 500 mL stainless steel rectangular tray (CY-1070; 260×170×50 mm, Chunyangsa Co., Ltd., Seoul, Korea)에 넣어 121°C에서 60분간 멸균한 후 상온에서 냉각하였다. 무균 조건 하에서 균을 넣지 않은 액체발효배지(synthetic medium) 5 mL를 첨가배지로 rectangular tray에 첨가한 뒤, seed culture로 발효한 액체발효배지 10 mL를 혼합하여 고체발효를 진행하였다. 고체발효는 항온항습기(DS-150 TM; Daewon Science, Bucheon-si, Korea)를 이용하여 온도 30°C, 습도 50-70 %에서 고체발효를 수행하였다.
일정 시간마다 액체와 고체발효시료를 채취하여 동결건조기(BFD85-F8; IlShinBioBase Co. Ltd., Dongducheon, Korea)에서 동결 건조하고 미분쇄하여 분석에 사용되었다. Amylase, protease, ergosterol, β-glucan 등의 활성 및 농도를 분석하여 fermentation profile을 확인하였다.
Amylase 활성은 1% 전분용액과 조효소액 1 mL를 37°C에서 15분간 반응시켰다. 이 때 생성된 환원당의 함량은 DNS(3,5-dinitrosalicylic acid)방법 (Miller, 1959)으로 측정하였으며, 2 mL의 DNS를 넣고 100°C의 항온수조에서 5분간 반응시켰다. 이후 실온으로 냉각하여 UV/Vis 분광광도계(EMC-18PC-UV, EMCLAB®, Germany)를 이용하여 540 nm에서 흡광도를 측정하였다. 조효소액 1 mL에 의해 분해되는 전분의 μmol 수를 효소활성단위 1 unit으로 정의하였다.
Protease 활성은 0.1M phosphoric acid (pH 7)에 녹인 0.6% casein 용액 1 mL에 조효소액 1 mL를 혼합하여 37°C에서 10분간 반응시켰다. 이후 2 mL의 0.4 M trichloroacetic acid 를 혼합하고 37°C에서 25분간 반응시킨 다음 원심분리기(Centrifuge FLETA-5, Hanil Science Co., Ltd, Korea)를 이용하여 원심분리(994 ×g, 5 min) 하였다. 여액 1 mL를 Casein-Folin법(Oda and Murao, 1974)을 사용하여 UV/Vis 분광광도계(EMC-18PC-UV, EMCLAB®, Germany) 660 nm에서 흡광도를 측정하였다. 조효소액 1 mL에서 1분간 1 μmol의 tyrosine을 유리할 때 1 unit로 하여 시료 1 mL당 환산하여 표시하였다.
고체상 배지 속에 있는 곰팡이의 균체량을 추정하기 위해 균사배양체에서 ergosterol 함량을 분석하였다. 시료 0.5 g을 취하여 0.07 M potassium hydroxide(in methanol) 10 mL에 첨가한 뒤, 0.1 M HCl 200 μL를 추가로 첨가하여 shaking incubator (30 °C, 150 rpm)에서 1 h 동안 추출하였다. 추출 상등액에 있는 ergosterol를 VisiprepTM SPE vaccum Manifold(Merck KGaA, Darmstadt, Germany)과 C-18 SPE colum(Discovery® DSC-18 SPE Tube, Sigma-Aldrich, Supelco, USA)을 이용하여 여과분리한 뒤, isobutanol 2 mL를 첨가하여 ergosterol을 용출하였다. Ergosterol 농도는 HPLC(Agilent 1200 Series; Agilent Technologies, Santa Clara, CA, USA)와 UV detection(282 nm)을 통해 분석을 진행하였다. 컬럼은 SUPERSIL ODS I-C18 column (250×4.6 mm), injection volume 10 μL, 컬럼온도 30°C, 이동상 100% methanol을 1 mL/min의 유량으로 설정하여 분석하였다.
귀리를 이용한 곡류발효 유래 β-glucan분석은 β-glucan kit (K-BGLU, Megazyme, Chicago, IL, USA)을 사용하여 시료 100 mg에 50% 에탄올 0.2 mL와 sodium phosphate buffer (20 mM, pH 6.5) 4.0 mL를 넣고 혼합하였다. 끓는 물에 1분에서 2분 동안 넣었다가 혼합한 후 리체네이스(lichanase, Megazyme, Bray, Ireland) 0.2 mL(10 U)를 넣고 잘 섞어준 후 50°C 교반식 항온수조에서 1시간 동안 처리하였다. 효소처리액에 sodium acetate buffer (200 mM, pH 4.0) 5.0 mL를 넣고 반응을 종결시킨 후 원심 분리(994 ×g, 5 min)하여 상층액을 취하였다. 상층액 0.1 mL를 3개의 시험관에 각각 넣은 후 하나의 시험관에는 sodium acetate buffer(50 mM, pH 6.0) 0.1 mL를 가하고, 나머지 시험관에는 β-glucosidase(Megazyme, Bray, Ireland) 0.1 mL(10 U)를 가하여 50°C에서 10분간 방치하였다. 효소가수분해액에 GOPOD(glucose oxidase/peroxidase, Megazyme) 3.0 mL를 각 시험관에 넣고 50°C에서 20분간 방치한 후 UV/Vis 분광광도계(EMC-18PC-UV, EMCLAB®, Germany)를 이용하여 510nm에서 흡광도를 측정하여 β-glucan의 함량을 계산하였다.
발효 추출에 대한α-glucosidase 저해활성은 Lee 등(2014) 방법에 따라 일부 변형하여 측정하였다. 시료 1 g에 증류수 20 mL를 넣고 진탕 교반하여 추출 후 상등액을 여과하여 사용하였다. α-Glucosidase 효소액은 rat intestine powder 30 mg을 potassium phosphate buffer(50 mM, pH 6.8) 4 mL에 녹인 다음 4,000 rpm에서 10분간 원심분리 후 상등액을 채취하여 사용하였다. 발효추출액 50 μL에 α-glucosidase 효소액 50 μL, 초순수 증류수 50 μL, 3 mM ρ-nitrophenyl-α-D-glucopyranose(ρNPG) 100 μL와 혼합하여 37°C에서 60분간 반응 후 0.1 M sodium carbonate 750 μL로 반응을 정지시켰다. Microplate reader(Multiskan FC, Thermo Fisher Scientific, Waltham, MA. USA)를 이용하여 405 nm에서 흡광도를 측정하고, 시료용액과 동량의 완충용액을 넣은 대조군을 기준으로 효소 저해 활성을 아래의 식으로 계산하였다.
실험결과 및 고찰
배양 시간에 따른 곡류 발효물의 fermentation profile이 fungal biomass, amylase, protease, 그리고 β-glucan 함량에 미치는 영향을 확인하기 위해 250 mL Erlenmeyer flask에서 working volume 100 mL로 30°C, 150 rpm, 120 h 동안 발효를 진행하였다. 액체발효배지(synthetic medium) 조성은 5% (w/v) 귀리 분말(whole oat flour), 2% (w/v) 미강 분말(rice bran), 2% (w/v) yeast extract를 첨가하였으며, 추가 배지성분으로 3 g/L K2HPO4, 2 g/L MgSO4, 10 g/L NaCl, 2 g/L CaCl2, 7 g/L ascorbic acid (vitamin C)를 따로 멸균하여 접종 전에 액체발효 배지에 첨가하였다. 그 결과, Fig. 1 (A)의 72 h배양에서 가장 높은 농도의 효소 및 β-glucan을 생산하였고 그 이후 점차 생산성이 감소하는 경향으로 나타났다. 이때 72 h의 곡류발효에서 fungal biomass, amylase, protease, 그리고 β-glucan 함량이 0.32 mg/g, 7,537.21 U/g, 1,721.88 U/g, 7.7% (w/w) 등으로 가장 높은 농도와 활성을 나타내었다. 따라서 one-factor-at-time 방법을 통해 최적 배지조성 농도를 72 h을 기준으로 진행하였으며, 각각의 배지조성 인자들이 미생물의 성장, 효소생산 및 β-glucan 생산에 미치는 영향을 확인하였다.
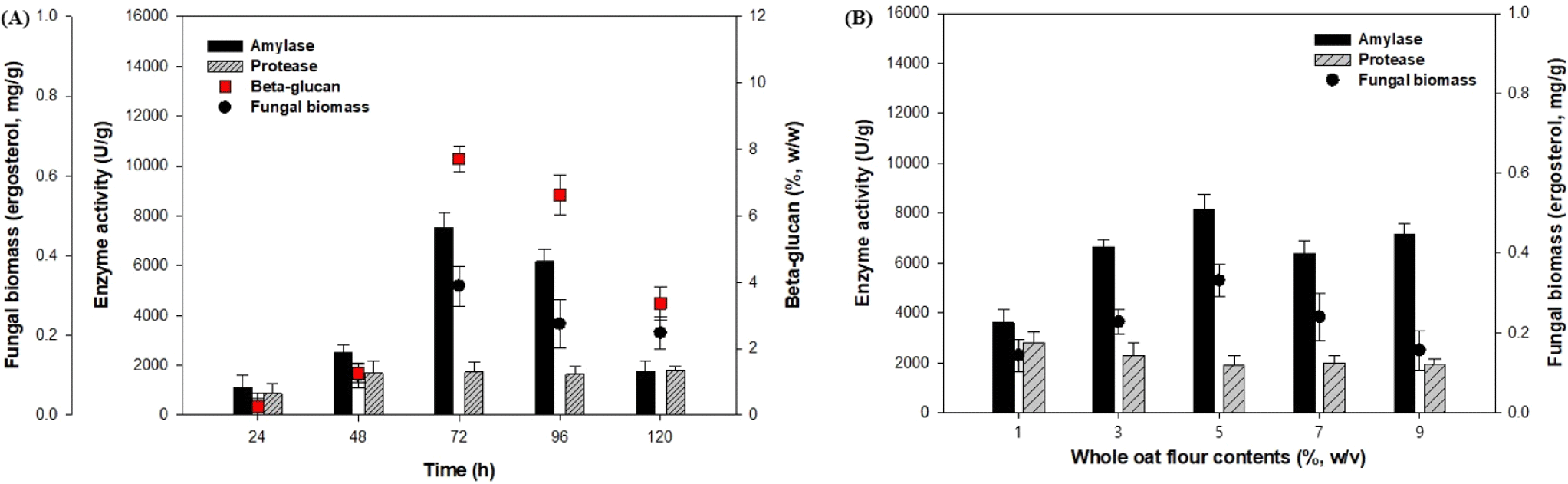
Fig. 1(B)는 액체발효배지(synthetic medium)에서 귀리 분말(whole oat flour)의 농도를 각각 1, 3, 5, 7, 9%(w/v)로 달리 진행하였으며, 그 결과 fungal biomass, amylase는 5%(w/v)에서 가장 높은 농도와 활성을 보였고 귀리 분말 농도가 증가함에 따라 생산성이 감소되었다. 반면, protease는 귀리 분말 농도가 증가함에 따라 감소하는 경향을 보였다. 귀리 분말 농도를 5%(w/v)로 배지조성으로 선택하였고, amylase, protease, fungal biomass 함량은 8,150.58 U/g, 1,896.95 U/g, 0.33 mg/g으로 확인하였다.
귀리를 이용한 곡류발효의 배양특성에서 질소원 종류와 농도, 그리고 미강 분말 농도가 미치는 영향을 조사하기 위해 액체발효를 72 h 동안 수행하였다(Fig. 2). Fig. 2(A)에서 액체발효배지(synthetic medium)에 beef extract, yeast extract, soytone, tryptone, NH4NO3, NH4Cl 를 2%(w/v) 농도로 각각 첨가하고 진행하였다. 그 결과, 질소원 중 tryptone에서 amylase, protease, ergosterol의 농도가 각각 10,240.86 U/g, 1,943.64 U/g, 0.50 mg/g 으로 높은 활성과 농도를 나타내었다. 따라서 tryptone을 질소원으로 선택하였으며, 이는 Kunamneni 등(2005)의 논문에서 다양한 질소원 중 peptone, tryptone, 그리고 meat extract가 고체배지 발효를 이용한 효소 (amylase) 생산에 적합하다는 연구결과와 일치하였다.
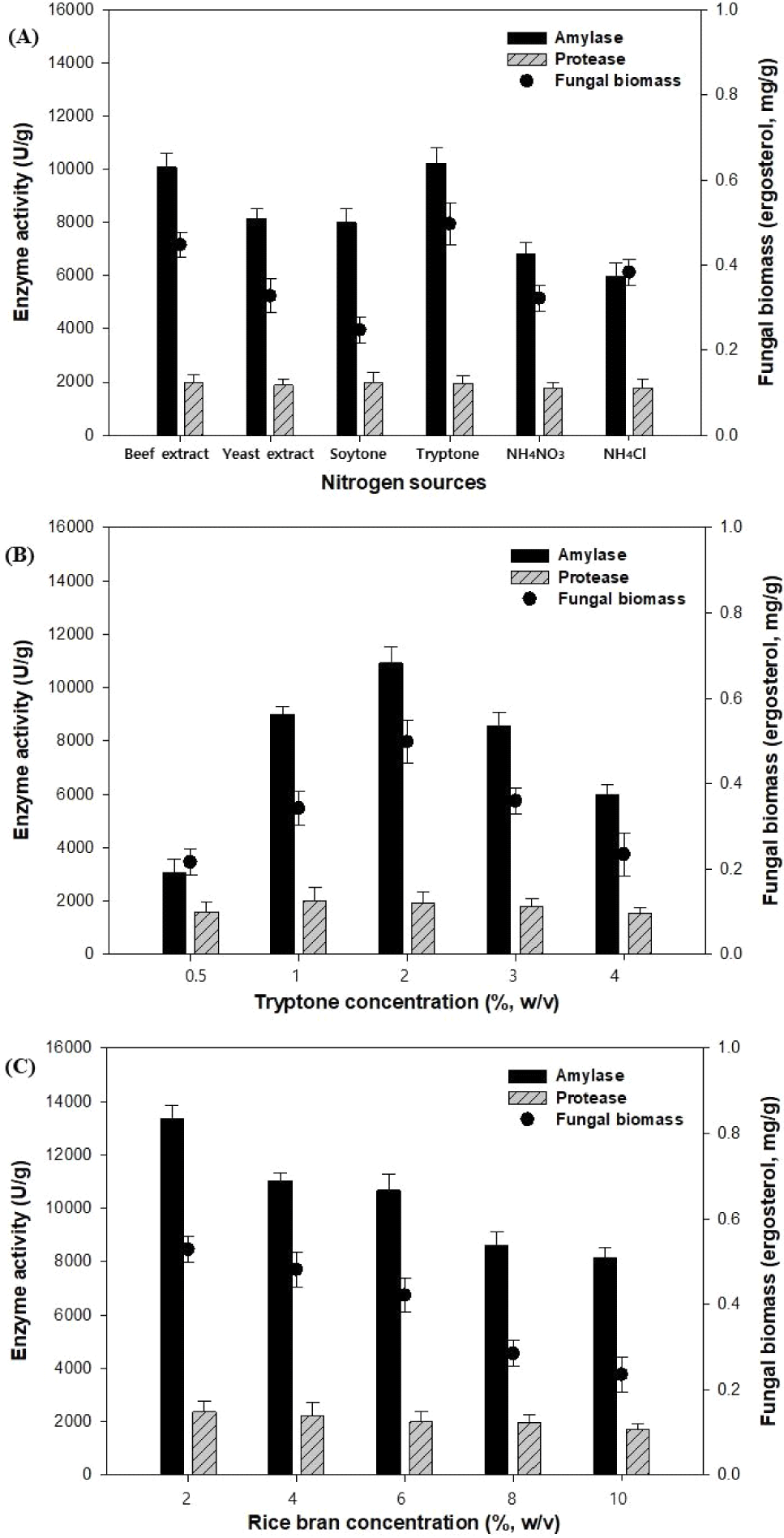
질소원인 tryptone을 다양한 농도로 첨가하여 액체발효를 진행하였으며, 질소원 농도에 따라 2%(w/v)에서 가장 높은 농도의 효소 및 fungal biomass을 생산하였고 그 이후 점차 생산성이 감소하는 경향으로 나타났다(Fig. 2(B)). 질소원 농도 2% (w/v)의 tryptone에서 amylase, protease, fungal biomass 함량은 각각 109,020.96 U/g, 1,932.85 U/g, 0.50 mg/g으로 측정되었다. 따라서 2% (w/v)의 tryptone를 액체발효배지(synthetic medium)에서 최종 농도로 선택하였다.
Fig. 2(C)는 미강 분말의 첨가 농도에 대한 효과로 첨가 농도가 증가할수록 효소활성(amylase, protease)과 균체 농도(ergosterol)는 감소하는 결과를 나타내었다. 미강 분말 농도 2%(w/v) 일 때 amylase, protease, fungal biomass 함량은 각각 13,356.51 U/g, 2,372.67 U/g, 0.53 mg/g 으로 활성과 농도가 높게 나타났으나, 미강 분말 농도가 증가할수록 효소 활성과 균체 농도가 감소하였다. Alauddina 등(2017)에 따르면 미강의 영양분 조성은 34–62%의 탄수화물(carbohydrate), 15–20%의 지방(lipid), 11–15%의 단백질(protein), 7–11%의 조섬유(crude fibre), 7–10%의 회분(ash) 등으로 구성되어 있으며, 또한 Sterna 등(2016)의 논문에서 귀리의 영양분 조성은 27.3–50%의 starch, 9.7–17.3%의 protein, 5.2–12.4%의 lipid, 13.6–30.2%의 total dietary fibre, 그리고 2.7–3.5%의 β-glucan 등으로 구성되어 있다. 따라서 귀리를 기질로 한 액체발효배지(synthetic medium)에서 추가적인 미강 분말의 첨가는 세포성장 및 효소생산을 저해하는 경향을 나타내었다. 따라서 액체발효를 위한 배지조성은 5%(w/v) 귀리 분말, 2%(w/v) tryptone, 2%(w/v) 미강 농도 등의 조성으로 추가배지를 첨가하여 곡류발효를 수행하였다.
고체발효는 500 mL rectangular tray에 귀리 100 g과 증류수를 150 mL를 첨가하였으며, 121°C에서 60분간 멸균 및 냉각 후 액체배지 종균으로부터 A. niger NIBRFGC000134713를 10 mL접종하였다. 항온항습기를 이용하여 습도 50%(Fig. 3(A)), 60%(Fig. 3(B)), 70% (Fig. 3(C)), 그리고 온도 30°C의 배양조건으로 고체발효를 수행하였다.
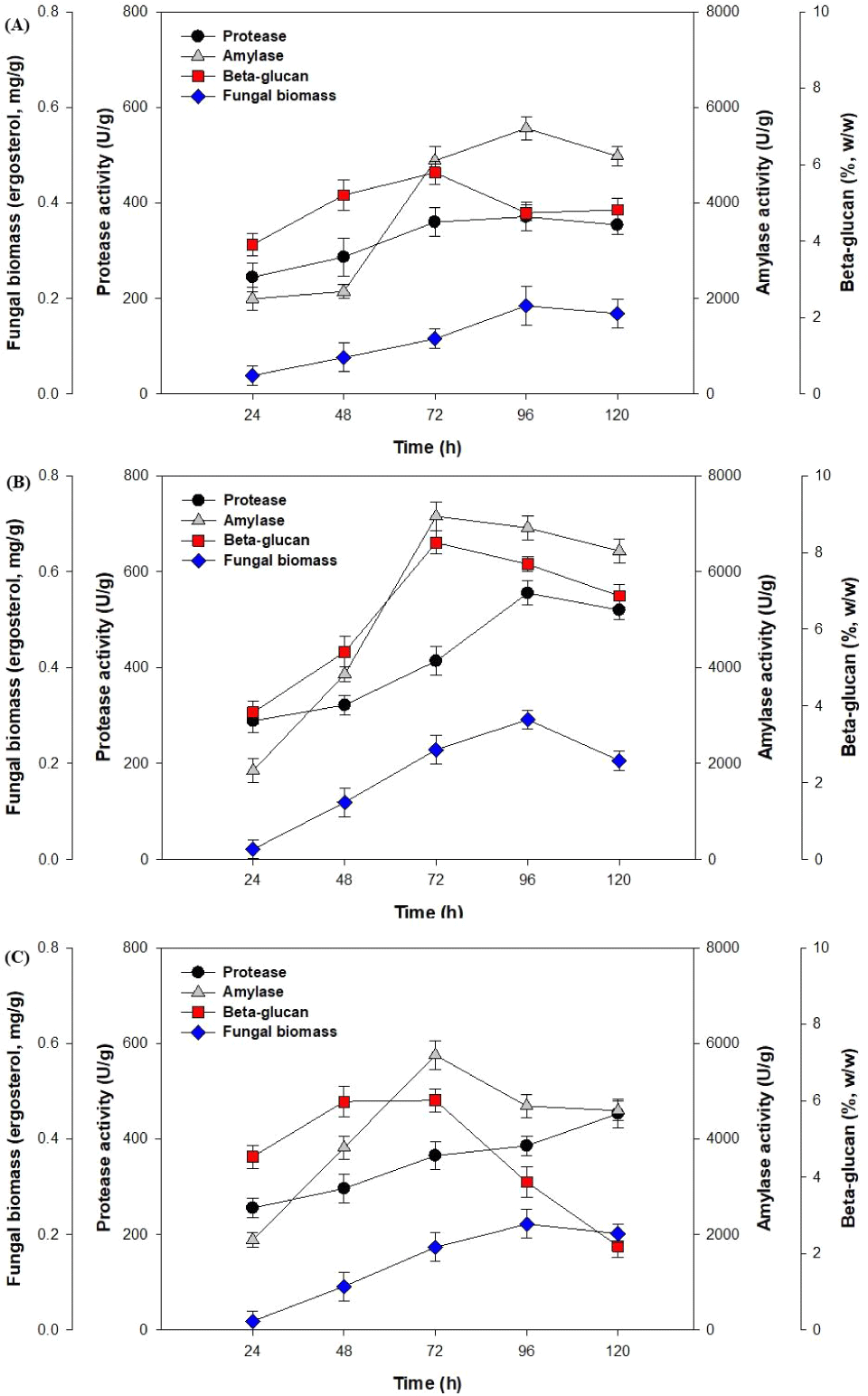
Fig. 3(A)에서 배양 습도를 50%로 진행하였을 때, fungal biomass는 96 h에 stationary phase로 진입하였다. 고체발효 동안amylase 생산은 96 h에 5,559.32 U/g으로 가장 높은 활성을 나타내었고 이후 감소하는 경향을 보였다. 반면, protease생산은 72 h에서 가장 높은 효소활성(1,662.04 U/g )을 나타내었으며, 발효 72 h에서 β-glucan 함량이 5.7%(w/w) 생산되었다. 이러한 고체발효 대사산물의 낮은 농도와 효소활성은 발효과정 동안 수분의 증발과 기질에 따른 공극의 차이, 그리고 대사량의 차이에 의한 것으로 생각된다(EI-Naggar et al., 2009).
Fig. 3(B)는 배양 습도를 60%로 진행하였을 때, 효소 amylase 및 β-glucan 함량은 72 h에서 가장 높은 활성과 농도를 나타내었고, fungal biomass와 protease 함량은 96 h에서 가장 높은 농도와 활성을 확인하였다. 이때 fungal biomass, amylase, protease, 그리고 β-glucan 함량은 0.23 mg/g, 7,157.38 U/g, 413.67 U/g, 8.26% (w/w) 등으로 분석되었다. 이후 전반적으로 고체발효 대사산물인 fungal biomass 농도, 효소활성, 그리고 β-glucan 함량은 감소하는 경향을 나타내었다. 고체발효에서 수분함량과 습도는 중요한 역할을 하는 것으로 알려져 있다(Sivaramakrishnan et al., 2007). 고체배양을 위한 기질의 수분 함량과 습도는 곰팡이 균주나 기질의 종류에 따라 다른데, 일반적으로 35-80% 범위로 알려져 있다(Raimbault, 1998). 따라서 본 연구에서는 귀리를 이용한 고체발효에서 대사산물 생산을 위한 배양 습도는 60%가 적합하다고 판단된다.
Fig. 3(C)는 배양 습도 70%의 고체발효를 수행한 결과이며, Fig. 3(B)와 비교하였을 때 대사산물인 fungal biomass 농도, 효소활성, 그리고 β-glucan 함량은 전반적으로 감소하였다. Fig. 3(C)에서 나타난 fungal biomass, amylase, protease, 그리고 β-glucan의 최적 농도와 효소활성은 0.22 mg/g, 5,753.02 U/g, 452.81 U/g, 6.0% (w/w) 등으로 분석되었다. 이는 높은 수분함량과 습도에서는 잉여수분이 발생하여 고체 배지의 공극 사이에 물이 채워지게 되며 공기의 유입이 어려워져 세포성장 및 효소생산이 저해된다고 알려져 있다(EI-Naggar et al., 2009).
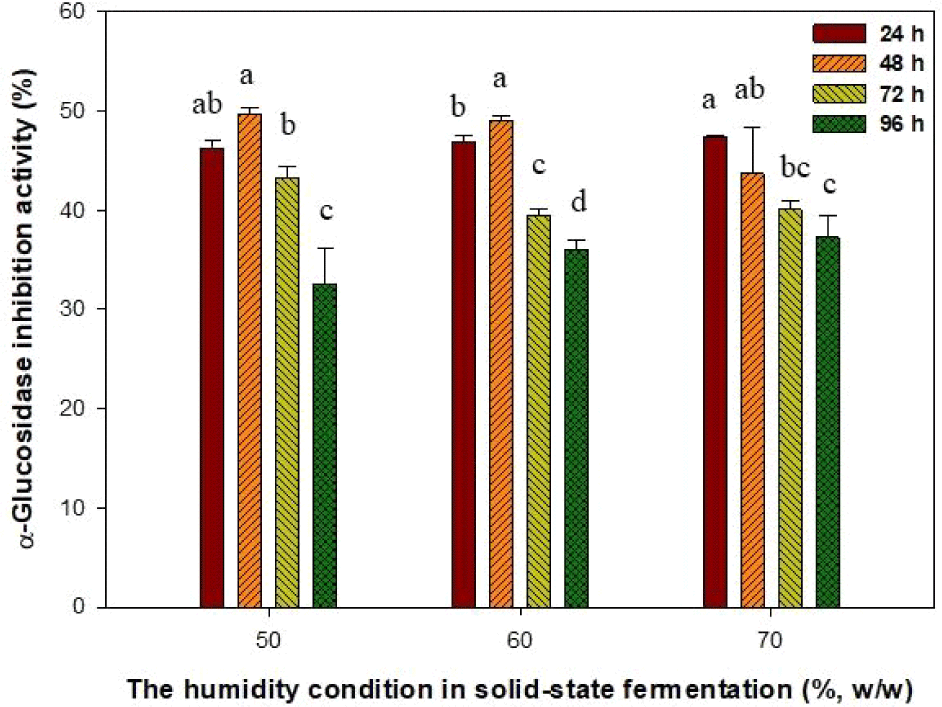
전분은 탄수화물의 주된 성분으로써 췌장에서 분비되는 amylase에의해 이당류로 분해된 후 소장 융모막에 존재하는 α-glucosidase 효소들에 의해 단당류로 분해 및 흡수되어 혈당을 상승시킨다. 따라서 본 연구에서는 Fig. 3에서 생산된 습도(50-70%)와 발효시간(24-96 h)에 따른 귀리발효물 샘플을 각각 추출하였고 α-glucosidase 저해활성에 적용하여 혈당억제기능에 관하여 조사하였다(Fig. 4). 그 결과, 고체발효의 습도가 50, 60, 70%로 24-48 h 동안 발효를 수행한 추출물에서 모두 높은 α-glucosidase 저해활성이 확인되었다. 그러나 발효시간이 48 h 이상 경과된 모든 발효추출물에서 α-glucosidase 저해활성이 점점 감소하였다. 한편, Kang 등(2017)의 논문에서 귀리 유래 β-glucan은 농도의존적으로 α-glucosidase 활성을 저해하였으며, 효소 특이적 저해활성으로 췌장 유래의 α-amylase는 저해하지 못하는 것을 알 수 있다. 즉, α-amylase에 대해 저해활성이 없거나 낮은 것은 오히려 혈당상승 억제제로서의 장점에 속한다. 이는 시판되는 혈당상승억제제의 주요 부작용인 설사와 복부팽만은 약물의 α-amylase 저해로 인해 발생되기 때문이다(Kim et al., 2011). 따라서 귀리와 A. niger NIBRFGC000134713을 이용하여 생산된 고체발효 대사물질인 효소 및 β-glucan은 혈당상승억제제의 부작용 경감을 위해 α-amylase에 대한 저해율은 낮고, α-glucosidase에 대한 저해율은 높은 소재로서 유효할 것이라 사료된다.
요 약
본 연구에서는 귀리를 기질로 사용하여 액체발효(LSF)와 고체발효(SSF) 최적화를 수행하였으며, 효소 및 β-glucan 생산에 대한 곡류발효를 수행하였다. 액체발효배지(synthetic medium)에서 귀리 분말(whole oat flour)의 농도, 질소원 종류와 농도, 그리고 미강 분말 농도가 미치는 영향을 수행하였다. 또한 항온항습배양기를 이용하여 다양한 습도 (50, 60, 70%)에서 고체발효를 수행하였으며, 효소 및 β-glucan이 포함된 귀리발효물의 샘플들을 각각 추출하여 α-glucosidase 저해활성을 측정하였다. 본 연구는 효소 및 β-glucan 생산에 있어 부산물 생산 최소화가 가능한 경제적인 발효공정의 기초자료로 사용될 수 있을 것이며, 또한 혈당상승억제제의 부작용 경감에 도움을 줄 수 있는 소재라고 판단된다.
