서 론
Streptococcus mutans는 구강 생물막(biofilm) 형성의 첫 단계에 관여하여 생물막을 발달시키는 역할을 하며, 당 대사를 통해 젖산을 생성하여 pH를 낮추고 칼슘을 유리시키는 방식으로 치아 우식을 일으키는 감염성 구강 질환의 대표 원인균으로 잘 알려져 있다(Hahn et al., 1991; Kim et al., 2020a). 특히 치아 범랑질에 생산된 생물막은 주로 S. mutans의 glucosyl- transferase(GTFs)에 의해 당을 glucosyl 단위로 중합하여 비수용성 글루칸을 생산하여 형성된 것으로 타액과 항생물질을 비롯한 외부 물질의 침입을 어렵게 만들고, 구강 세균 간의 유전적 돌연변이를 일으킬 가능성을 높이는 것으로 알려져 있다. 또한 S. mutans를 포함한 산을 생산하는 구강미생물에 의해 생산된 유기산이 생물막 내부에 머물게 하며, 내부로 침투한 외부 물질에 의해 산이 완충되는 작용을 할 수 없게 만드는 등 치아 우식을 촉진시키는 역할을 한다(Cho, 2021; Rukayadi and Hwang, 2006).
따라서 세균에 의한 치아우식증을 예방하기 위해서는 치아우식증의 주요 원인균인 S. mutans의 생육을 방해하는 것뿐 아니라, S. mutans의 생물막 형성을 억제하여 치아 우식이 가속화 되지 않도록 관리할 필요가 있다(Krzyściak et al., 2014; Lin et al., 2021).
이와 관련하여 기존의 치료 방식은 칫솔질 및 스케일링(scaling)을 통한 물리적인 치료방법과 클로르헥시딘(chlorhexidine) 및 플루오르화물(fluoride)을 함유한 구강청결제를 처방하는 화학적 치료 방식이 우세하였으나(Baker et al., 2017), 이러한 방법은 구강 미생물 생태계의 균형을 파괴시키고, 구강 조직을 손상시키는 등 지속적인 구강 건강 유지에 어려움이 있어 이를 대체할 새로운 연구의 필요성이 대두되었다(Kim et al., 2019). 이에 따라 최근 버섯추출물을 활용한 S. mutans에 대한 항균 및 항 GTFs 연구가 진행되는 등 천연물을 이용한 연구가 진행되고 있으며(Park et al., 2011), Lactiplantibacillus plantarum CCFM 8724 배양액이 Rat의 우식증을 억제하는 효과를 연구하는 등 유산균의 대사산물을 이용한 항 우식 연구도 꾸준히 진행되고 있다(Zhang et al., 2020).
이러한 노력에도 불구하고, 치아우식증은 2020년 기준 국내 질병 별 환자수 순위 4위를 차지하는 등 치아 우식을 개선하기 위한 제품 및 의약품 개발 수요가 지속적이므로, 꾸준한 연구와 제품개발로 이를 극복하려는 노력이 필수적일 것으로 판단된다(Kim et al., 2020b).
따라서 본 연구에서는 치아우식증을 유발하는 균 S. mutans에 대한 항균 효과 및 항생물막 효과가 우수한 유산균을 김치로부터 분리 및 동정하여, 치아우식증 예방을 위한 기능성 소재로서의 개발 가능성을 검토하고자 하였다.
재료 및 방법
연구에 사용된 Streptococcus mutans KACC 16833T, Bacillus cereus ATCC 14579T 및 Lactiplantibacillus plantarum ATCC 14917T 균주는 국립농업과학원 농업미생물은행(Korean Agricultural Culture Collection, KACC)과 American Type Culture Collection(ATCC)에서 분양 받아 사용하였다.
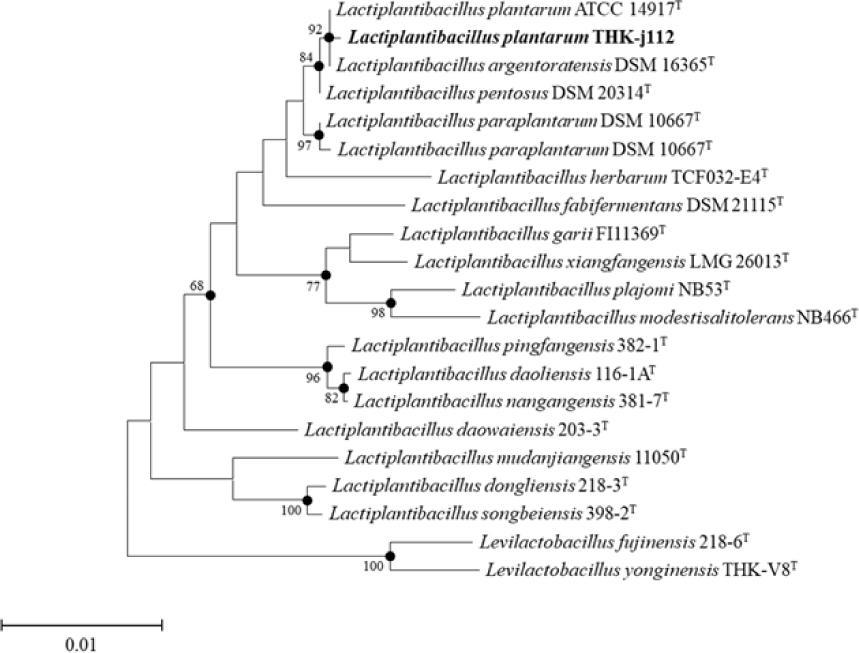
수집한 김치시료를 Lactobacilli MRS broth(Difco Co., Sparks, MD, USA) 5 mL에 1%(v/v)로 접종하여 30℃에서 24시간 종균 배양하였다. 이후 MRS broth 5 mL에 1%(v/v) 로 재 접종한 후 30℃에서 24시간 본 배양하여 유산균 감별 배지인 Bromo Cresol Purple(BCP) plate count agar(EIKEN chemical, Tokyo, Japan)에 획선 도말한 후 30℃에서 24시간 배양하였고, 산을 생성하여 colony 주위에 노란색 환을 형성한 것을 취해 순수 분리하였다. 분리한 균주의 생화학적 특성을 확인하기 위해 API 50 CHL kit(BioMérieux, Craponne, France)를 이용하여 탄수화물 발효 여부를 검토하였으며, 이후 16S rRNA 염기 서열을 분석하여 최종 동정하였다(BIOFACT Co., Daejeon, Korea). 염기서열 분석을 위해 사용한 pirmer는 27F(5'-AGAGTTTGATCMTGGCTCAG-3') 및 1492R(5'-TACGGTTACCTTGTTACGACTT-3')이며, 분석한 염기서열은 EZBioCloud website(www.ezbiocloud.net)의 16S database tool을 기반으로 표준 균주의 염기서열과 비교하여 분리 균주를 동정하였다. 계통수(phylogenetic tree)는 MEGA-X 프로그램의 neighbor-joining 및 maximum-likelihood 방법을 사용하여 작성하였다.
Wiegand 등(2008)의 broth dilution method를 이용하여 실험을 진행하였으며, MRS broth 5 mL에 1%(v/v) 접종하여 전배양한 유산균을 MRS broth 5 mL에 1%(v/v) 접종하여 30℃에서 24시간 본배양 하였다. 이후 4,000 rpm에서 10분간 원심분리하여 상등액을 취해 0.2 µm membrane filter(Hyundai micro Co.)로 여과한 후 농축한 것을 시료로 사용하였다. S. mutans KACC 16833T은 0.3% yeast extract를 첨가한 tryptic soy broth(TSB, Difco Co., Sparks, MD, USA)에 증균한 후 0.3% yeast extract를 첨가한 tryptic soy broth 5 mL에 1%(v/v) 접종하여 37℃에서 24시간 배양하였으며, S. mutans KACC 16833T의 세포 계수 결과를 바탕으로 0.85% NaCl을 사용하여 균수를 106cfu/mL로 조정하여 실험에 사용하였다.
96-well microplate(cell culture plate, SPL life sciences Co., Ltd, Korea)에 S. mutans KACC 16833T 배양액과 시료를 동량 분주하여 37℃에서 24시간 배양하였다. 이후 균주 배양액을 0.3% yeast extract를 첨가한 TSB agar plate에 획선 도말하여 37℃에서 24시간 배양하여 colony의 생성 여부를 확인하였다. 실험결과, colony 생성이 저해되는 농도를 최소저해농도(MIC)로 설정하였으며, colony의 생성이 확인되지 않는 농도를 최소살균농도(MBC)로 설정하였다.
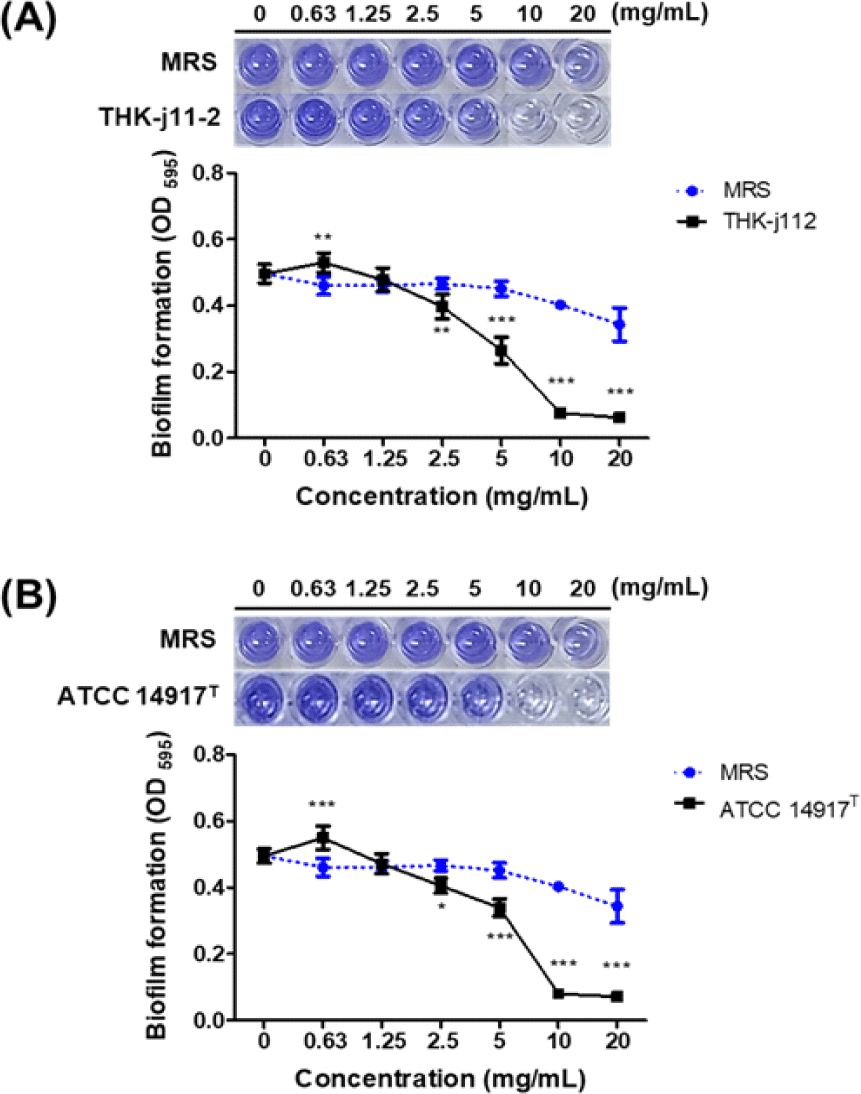
S. mutans가 생성하는 생물막 억제 효과를 확인하기 위해 Kouki et al. (2020)의 방법을 참고하여 수행하였다. S. mutans KACC 16833T을 0.3% yeast extract와 1% sucrose를 첨가한 TSB broth에 106 cfu/mL로 조정한 균액을 실험에 사용하였다. 96-well microplate에 멸균수 100 µL와 시료 100 µL를 각각 첨가하여 2-fold serial dilution한 후 균액을 100 µL분주하여 37℃에서 24시간 배양하였다. 배양 후, 배양액을 제거하고 각 well을 PBS로 2회 세척하여 건조하였으며, 0.01% crystal violet solution을 각 well에 첨가하여 15분간 염색하고 PBS로 2회 세척한 후 건조하였다. 건조된 well에 각각 33% acetic acid를 첨가하여 염색된 생물막을 용해시켜 ELISA Microplate Readers(Molecular Devices Filter Max F5; San Francisco, CA, USA)를 사용하여 595 nm에서 흡광도를 측정하였다.
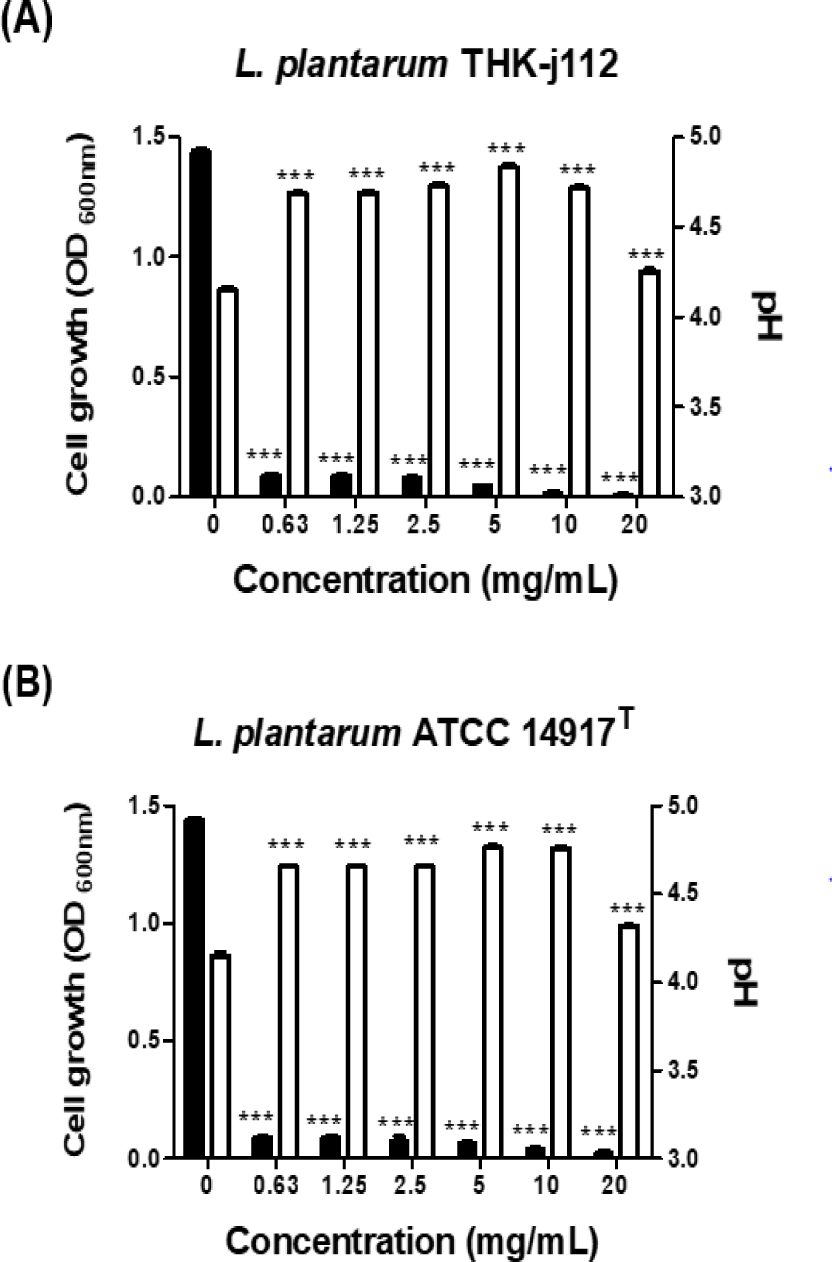
S. mutans가 생산하는 유기산은 치아에 직접적인 영향을 미쳐 치아우식을 가속화 시키는 것으로 알려져 있다. 따라서 THK-j112 균주가 S. mutans KACC 16833T의 산 생성을 억제할 수 있는지 확인하였다. 0.3% yeast extract와 1% sucrose를 첨가한 TSB broth 500 µL에 시료를 500 µL씩 첨가하여 2-fold serial dilution한 후 0.85% NaCl로 균수를 106 cfu/mL로 조정한 균액을 500 µL 분주하고 37℃에서 24시간 배양 후 pH meter(Seven Compact Duo S213; Switzerland)를 이용하여 pH를 측정하였고, UV-Vis Spectrophotometer(Mecasys Co., Seoul, Korea)를 이용하여 600 nm에서 흡광도를 측정하였다.
S. mutans의 세포 외 다당류를 생성하는 효소인 GTFs의 억제 정도를 확인하기 위해 GTFs의 억제 활성 평가를 실시하였으며, 실험 방법은 Mukasa et al. (1987)의 방법을 참고하였다. Sucrose를 기질로 사용하여 37℃에서 24시간 배양한 S. mutans KACC 16833T를 4,000 rpm에서 15분 동안 원심분리하고 상등액의 pH를 0.1M NaOH를 사용하여 7.0으로 보정하였다. 보정 후 0.02% sodium azide을 첨가하여 GTFs coenzyme solution을 준비하였다. 시료와 GTFs coenzyme solution 혼합액에 2.0% sucrose를 첨가하여 37℃에서 24시간 반응시킨 후 UV-Vis Spectrophotometer를 이용하여 600 nm에서 흡광도를 측정하였다.
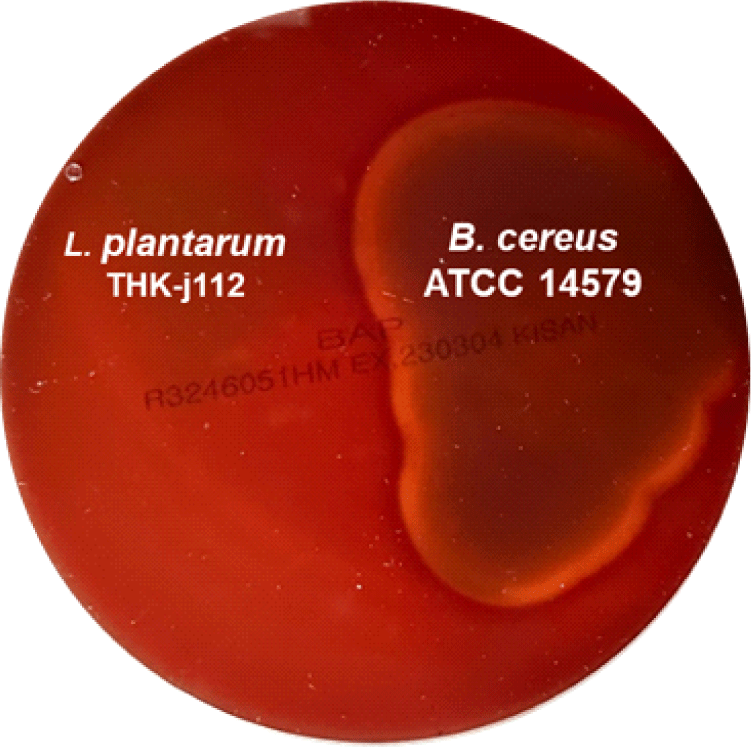
용혈성을 확인하기 위해 5% sheep blood(Kisan Bio Co., Seoul, Korea)가 함유된 blood agar plate(Kisan Bio Co., Seoul, Korea)에 분리 균주 THK-j112와 용혈성이 있는 것으로 알려진 B. cereus ATCC 14579T를 양성대조군으로 하여 획선 도말 후 37℃에서 48시간 배양하였다. 이후 colony 주위의 용혈반응을 양성대조군과 비교하여 용혈성 여부를 판단하였다.
균주의 항생제 내성 특성을 파악하기 위해 유럽식품안전청(FEEDAP, 2012)의 가이드라인에 따라, E-test strip(Kisan Bio Co., Seoul, Korea)을 사용하여 MIC 값을 판독하였다. 이후 측정된 MIC 값은 EFSA 가이드라인의 cut-off value와 비교하였다.
결과 및 고찰
본 실험에서 분리한 균주 THK-j112의 16S rRNA 유전자 염기서열 분석 결과, L. plantarum ATCC 14917T과 99.93%의 유사성을 나타내어 THK-j112 균주를 L. plantarum THK-j112로 명명하였다(Fig. 1). API 50 CHL kit를 이용한 L. plantarum THK-j112와 표준균주인 L. plantarum ATCC 14917T의 당 이용성 검정 결과(Table 1), 공통적인 당이용성 이외에 L. plantarum THK-j112는 L. plantarum ATCC 14917T이 이용하지 못한 D-xylose와 gentiobiose를 이용할 수 있었고, L. plantarum ATCC 14917T은 L. plantarum THK-j112가 이용하지 못한 mannitol, sorbitol, α-methyl-D-mannoside, melibiose, sucrose, melezitose, raffinose, D-turanose 및 D-arabitol을 이용할 수 있었다. 이러한 결과를 바탕으로, 본 실험에서 분리한 균주 THK-j112와 표준균주는 당 이용성에 대해 상당한 차이를 보이므로 생리학적, 생화학적으로 다른 특성을 가진 것으로 판단된다.
S. mutans KACC 16833T에 대하여 L. plantarum THK-j112와 L. plantarum ATCC 14917T의 최소저해농도(MIC)와 최소살균농도(MBC)를 측정하였다. 그 결과, L. plantarum THK-j112와 L. plantarum ATCC 14917T은 모두 S. mutans KACC 16833T에 대해 5 mg/mL의 MIC 및 10 mg/mL의 MBC 값을 나타내어 두 균주가 S. mutans KACC 16833T에 대해 유사한 정도의 항균활성을 보이는 것을 확인할 수 있었다.
S. mutans KACC 16833T에 대한 L. plantarum THK-j112 및 L. plantarum ATCC 14917T의 생물막 형성 억제 효과 결과는 Fig. 2에 나타내었다. 실험결과, 두 균주 모두 배양액의 농도가 높아짐에 따라 농도 의존적으로 S. mutans KACC 16833T의 생물막 형성이 저해되어 2.5 mg/mL 이상의 농도에서 대조군 대비 유의하게 생물막 형성이 억제되는 것으로 확인되었다. 특히 5 mg/mL, 10 mg/mL 및 20 mg/mL에서 L. plantarum THK-j112의 흡광도는 0.27±0.04, 0.08±0.01 및 0.06±0.01로 확인되었으며, L. plantarum ATCC 14917T의 흡광도는 0.34±0.03, 0.08±0.00 및 0.07±0.00으로 확인되어 5 mg/mL 이상의 고농도에서 L. plantarum THK-j112와 표준균주 모두 50% 이상의 우수한 항생물막 효과를 보이는 것으로 확인되었다.
S. mutans는 당 대사과정에서 유기산을 생산하여 치아 표면의 pH를 낮춰 칼슘을 용출시키는 등 치아 우식을 유발하는데 직접적인 영향을 미친다. 따라서 치아 우식을 예방하기 위해서는 S. mutans가 생산하는 유기산의 생성을 억제할 필요성이 있다. 따라서 L. plantarum THK-j112 균주가 S. mutans에 의한 산 생성을 억제하는지 여부를 pH meter와 UV-Vis Spectrophotometer를 사용하여 측정하였다. 그 결과, Fig. 3에 나타낸 바와 같이 L. plantarum THK-j112와 L. plantarum ATCC 14917T은 MBC 미만의 농도(0.63 - 5 mg/mL)에서는 농도의존적으로 산이 생성됨이 확인되었고, MBC 이상의 농도(10, 20 mg/mL)에서는 산 생성이 억제됨을 확인할 수 있었다.
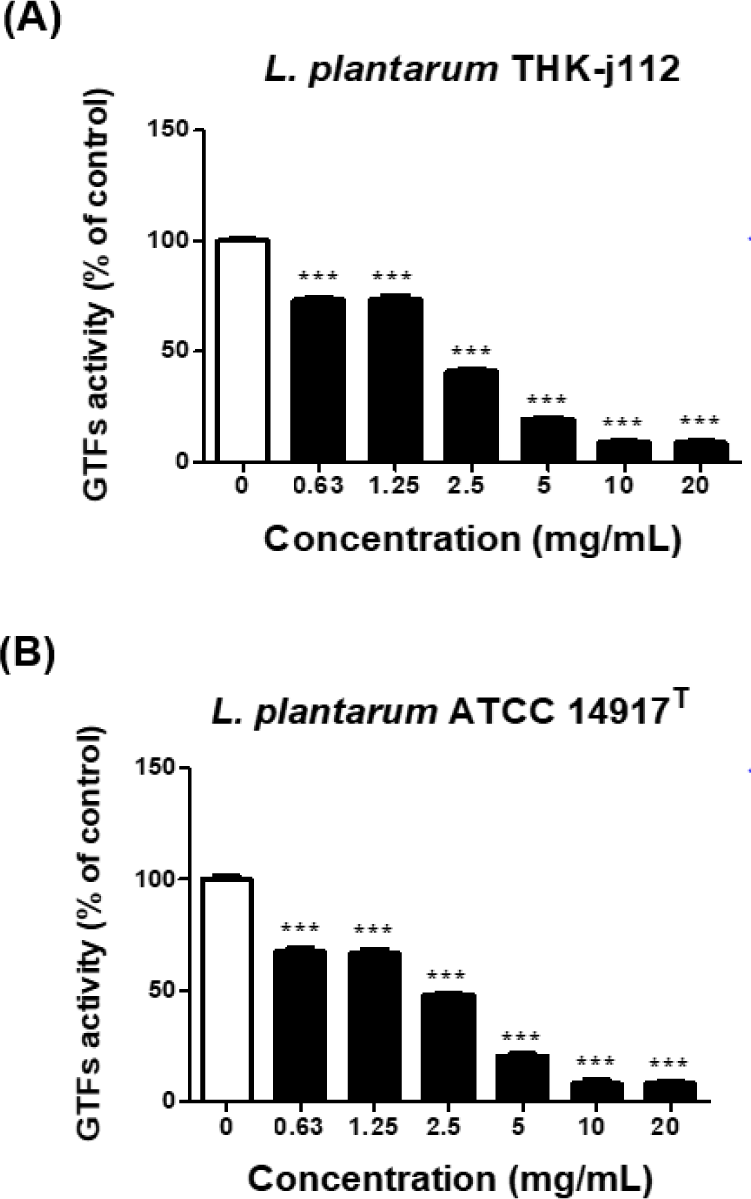
GTFs 억제 효과 실험결과, L. plantarum THK-j112는 0.63, 1.25, 2.5, 5, 10 및 20 mg/mL에서 각각22.42%, 26.72%, 58.95%, 80.65%, 91.24% 및 91.24%의 억제율을 보였으며, L. plantarum ATCC 14917T은 0.63, 1.25, 2.5, 5, 10 및 20 mg/mL에서 각각 33.36%, 32.42%, 52.09%, 79.28%, 91.76% 및 91.90%의 GTFs 억제를 보이는 것으로 확인되었다. 이에 따라 상기 L. plantarum THK-j112 및 L. plantarum ATCC 14917T 균주 배양액은 GTFs 생산을 억제함으로서 S. mutans의 생물막 형성을 억제할 것으로 생각되며, 특히 5 mg/mL 이상의 농도에서 L. plantarum THK-j112 및 L. plantarum ATCC 14917T 모두 90% 이상의 높은 억제율을 보여 효과적으로 S. mutans에 의한 생물막 형성 억제에 기여할 것으로 기대된다(Fig. 4).
유산균 및 대사산물을 식품산업에 활용하기 위해서는 용혈성 및 항생제 내성과 같은 안전성 평가가 필수적이다. 따라서 본 연구에서는 L. plantarum THK-j112의 용혈성 여부를 확인하였다. 용혈이란 적혈구가 파괴되어 헤모글로빈이 혈구 밖으로 용출되는 현상으로, 혈액 한천 배지 상에서 나타나는 용혈의 유형에 따라 α, β 및 γ-용혈로 구분할 수 있다. α-용혈은 적혈구의 부분적 용해를 말하며, 혈액배지 상에서 colony 주변이 녹색으로 변하는 특징이 있으며, β-용혈은 적혈구가 완전히 용해되는 것으로 혈액배지 상에서 colony 주변이 투명하게 변한다. γ-용혈는 용혈이 일어나지 않는 반응으로 colony 주변에 아무런 변화가 없는 것이 특징이다(Kim et al., 1995). 이러한 기준에 따라 용혈성을 확인한 결과, L. plantarum THK-j112는 용혈을 보이지 않은 반면, 양성대조군인 B. cereus ATCC 14579T는 β-용혈을 일으키는 것으로 확인되었다(Fig. 5). 따라서 L. plantarum THK-j112는 용혈을 일으키지 않는 균으로 해당 안전성 평가기준에 부합하는 것으로 확인되었다.
항생제 내성 평가 결과는 Table 2와 Fig. 6에 나타내었다. EFSA 가이드라인에서 제시한 식품 적용 가능 미생물의 항생제 내성 기준치(cut-off value)와 비교하였을 때, Ampicillin, Kanamycin, Erythromycin, Clindamycin, Tetracycline 및 Chloramphenicol은 EFSA 가이드라인 기준치보다 MIC 값이 낮거나 같은 것으로 확인되었다. 반면, Gentamicin은 MIC 값이 기준치인 16 mg/mL 보다 높은 32 mg/mL 로 확인되었다. 따라서 향후 기능성 식품 등으로 개발하기 위해서는 L. plantarum THK-j112의 항생제 내성 유전자를 분석하고 내성 유전자의 획득성(acquired resistance) 또는 내재성(intrinsic resistance) 여부를 확인해야 할 것으로 사료된다.
| Antibiotics1) | AMP | GEN | KAN | ERY | CLI | TET | CHL |
|---|---|---|---|---|---|---|---|
| MIC cut-off value(mg/mL) | 2 | 16 | 64 | 1 | 2 | 32 | 8 |
| Detection value(mg/mL) | 0.47 | 32 | 48 | 1 | 1 | 8 | 4 |

요약
본 연구에서는 김치에서 분리한 유산균 L. plantarum THK-j112의 치아우식증 유발균 S. mutans에 대한 항균효과, 생물막 형성 억제효과 및 안전성 평가를 수행하였다. 본 연구에서 분리한 균주 THK-j112는 치아우식균에 대해 우수한 항균력을 보였으며, S. mutans KACC 16833T에 대한 MIC는 5mg/mL, MBC는 10 mg/mL인 것으로 확인되었다. 생물막 형성 억제 실험 결과, THK-j112 배양액은 2.5 mg/mL 이상에서 대조군 대비 유의미한 억제효과를 확인할 수 있었으며, 생물막 형성을 촉진하는 역할을 하는 GTFs를 농도 의존적으로 억제하였으며, S. mutans가 생산하는 유기산을 대조군 대비 유의미하게 억제하는 것으로 확인되었다. 안전성 평가결과, THK-j112는 용혈성을 보이지 않았으나, 항생제 내성평가에서 일부 항생제에서 기준치 이상의 항생제 내성이 확인되었다. 따라서 본 연구에서 분리한 L. plantarum THK-j112는 치아우식증 유발균의 생육 및 생물막 형성을 효과적으로 억제하며, GTFs 및 유기산 생성을 억제하여 치아우식증 예방효과가 있는 기능성 제제로서 활용가능성이 있으나, 프로바이오틱스 등 식품산업에서 활용하기 위해서는 향후 내성 유전자 연구를 통해 항생제의 획득성 여부를 확인하는 추가 연구가 반드시 필요할 것으로 판단된다.