서 론
유산균은 식품의 발효와 기능성 물질의 생산에 활용되며, 프로바이오틱스로 인간에 유익하게 작용하는 등 다양한 산업적 응용에 중요한 미생물 그룹이다(Papadimitriou et al., 2016). 이들은 대사 과정 에서 젖산을 생성하여 주변 환경을 산성화시키는 특징이 있으며, 이로 인해 pH가 낮은 환경에서도 생존할 수 있는 적응 메커니즘을 발달시켜왔다. 또한, 프로바이오틱스로서 인체 위장관의 강한 산성환경에서도 살아남을 수 있어야 하기 때문에 유산균의 산성환경 적응은 아주 중요하다(Papadimitriou et al., 2016; Zhu et al., 2024). 유산균을 프로바이오틱스로 섭취하기 위해 위장관에서 살아남을 수 있도록 하는 방법은 오랜 기간 활용되고 연구해온 캡슐화가 있으며, 여전히 더 나은 방법을 찾기 위한 연구가 진행 중이다(Minami et al., 2022; Peredo et al., 2016; Ramos et al., 2018; Venema et al., 2020; Vidhyalakshmi et al., 2009). 또한, 태생적으로 산성환경에 노출될 수밖에 없는 유산균은 산성 적응 시스템을 갖추고 있으며 이것을 극대화하기 위한 산성 적응 진화 균주 개발 연구도 보고되고 있다. 생명공학에서는 적응 진화(adaptive laboratory evolution, ALE)를 유전적, 대사적 경로의 이해를 위한 도구로서 미생물들의 다양한 특징을 개선하기 위해 사용해왔고, 에탄올, 부탄올, 지질과 같은 고부가가치 물질 제조 분야에도 적용해왔다(Mavrommati et al., 2022). 유산균의 경우, sourdough 발효에 이용되는 산업 균주인 Levilactobacillus brevis의 산 내성 증가를 위한 적응 진화 실험을 실시한 사례를 통해 젖산 내성을 증가하여 성장율을 높임으로써 발효를 유용하게 하고 후속 공정 비용의 감소를 이끌었다(Han et al., 2024). 또한, Lactiplantibacillus plantarum의 산 적응 진화를 통해 얻은 균주는 표현형 및 유전형 분석을 통해 ATP 합성 효소, transporter, 스트레스 반응 단백질 등의 과발현을 확인하였고, 이러한 산 내성 진화는 유산균의 다양한 산성환경 적응 방법의 유전적 진화를 통해 이루어진다고 보고되었다(Zhu et al., 2024). 유산균의 산성환경 적응 방법에는 다음과 같은 메커니즘이 있다. 첫번째, F-ATPase 활성 증가 및 아미노산 탈탄산화 시스템을 통한 세포 내 pH 항상성 유지, 두번째, 세포막 구성 변화를 통한 양성자 투과성 감소, 세번째, 대사 경로 전환에 의한 중화 과정, 네번째, 스트레스 단백질 발현 증가를 통한 DNA와 단백질 손상 수리, 다섯번째, two-component system(TCS)을 통한 산 스트레스 감지 및 대응하는 방법이 있다(Cui et al., 2020).
유산균의 아미노산 대사과정 중의 γ-aminobutyric acid(GABA) 생산은 해당 균주의 산 저항성과 연관된 것으로 보고되어 있으며 GABA 생산과정에서 glutamate decarboxylase(GAD)가 양성자를 하나 사용하면서 산 저항성에 기여하는 것으로 알려져 있다(Cui et al., 2020; Gong et al., 2019; Lyu et al., 2018; Sezgin & Tekin, 2023; Watanabe et al., 2011). GABA는 억제성 신경전달물질로서 당뇨병, 고혈압, 우울증, 기억 상실, 불면증 개선 등 인체에서 다양한 생리활성기능을 가진다. 이러한 장점들로 인해 GABA를 생산하는 유산균을 분리하여 발효 식품에 적용하거나, 프로바이오틱스로 생산 또는 유산균으로부터 GABA를 대량 생산하는 등 GABA의 상업적 활용을 위한 연구가 활발하게 진행되고 있다(Cui et al., 2020; Icer et al., 2024; Kim et al., 2022; Kwon et al., 2016; Lee et al., 2020; Phuengjayaem et al., 2021; Xiao and Shah, 2021; Yogeswara et al., 2020). 기존의 GABA 생산 유산균에 대한 연구는 유산균이 만들어내는 GAD 단백질의 효소 활성 실험 위주의 연구들이 대부분이었으며, GABA 생산 유산균을 식품 발효에 이용한 연구는 많지 않았다(Lee et al., 2018; Lim et al., 2018; Lin et al., 2014; Park et al., 2014; Sa et al., 2015; Shin et al., 2014; Wu and Shah, 2018; Yang et al., 2008). GABA 생산 유산균을 발효 종균으로 활용하여 GABA를 함유한 기능성 발효 식품을 제조하고자 하였을 때, 특히 한국의 전통 발효 식품인 김치에 적용한다면 발효 특성상 불특정 다수의 유산균 및 그 외의 미생물들이 많이 존재하기 때문에 종균으로서 발효 조건에서 잘 살아남아야 하는 것은 물론, 발효 동안 GABA를 대량 생산할 수 있는 능력을 가지고 있어야 한다. 이를 위해 GABA가 가지는 산 저항성 특징을 활용할 수 있다. 이와 관련하여 외부 환경 변화를 감지하고 적절한 유전자 발현을 조절하는 신호전달 체계로 산 스트레스 대응에 핵심적인 역할을 하는 TCS가 GABA 생산을 자극하는 매개체가 될 수 있을 것으로 기대된다(Cui et al., 2012; Monedero et al., 2017; O’Connell-Motherway & van Sinderen, 2000; Wang et al., 2018a; Zhang & Wang, 2023).
합성 생물학 분야에서는 TCS를 광유전학 기술(optogenetics), 소재 과학(materials science), 장내 미생물 공학(gut microbiome engineering), 토양 영양분 생체 감지(soil nutrient biosensing) 등에서 다양하게 활용하기 시작하였다(Lazar and Tabor, 2021). 유산균의 경우, Lactococcus lactis가 생산하는 nisin 및 lacticin 481, Latilactobacillus sakei가 생산하는 lactocine S와 같은 Class I 박테리오신(lantibiotics)의 생합성이 quorum sensing 과정에서 TCS에 의해 일부 조절 가능하다고 보고되었다. 그 중에서도 유일하게 공식적인 식품 첨가물로 승인된 nisin은 생합성 과정에 관여하는 NisK/NisR이라는 TCS가 밝혀져 있고 이 시스템은 nisin의 생산에 크게 활용될 수 있을 것이다(Kareb and Aïder, 2020). Lacticaseibacillus casei는 L-malic acid 대사에 필수적인 malate transporter(maeP)/malic enzyme(maeE)과 TCS인 maeK/maeR이 각각 오페론을 형성하고, L-malic acid가 존재할 때 함께 발현, L-malic acid를 대사하여 성장하는 것을 확인하였다(Landete et al., 2010). 이와 같은 방법으로 유산균은 TCS를 통해 산성 환경을 인지하고, 반응 조절 인자가 상황에 맞는 산성 적응 메커니즘의 관련 유전자를 연쇄적으로 발현하여 변화하는 환경에 적응할 수 있도록 할 것이다(Yao et al., 2025). 따라서 발효 과정 동안 유산균이 산성환경에 노출되었을 때 GABA 생산 유전자인 gad의 발현을 가능하게 하는 신호전달 체계를 TCS와 연계하여 자세하고 명확하게 알 수 있다면, TCS의 조절을 통해 기능성 물질로 이용할 수 있는 유산균의 GABA 생산을 최적화하는 방법과 GABA 함유 기능성 발효 식품 생산 전략도 모색할 수 있을 것이다.
본 리뷰에서는 유산균의 산성환경 적응 메커니즘에 관한 주요 연구 결과를 종합적으로 분석하여 TCS와 GABA 생산과정의 연계 가능성을 확인하고자 하였다.
산성환경 적응을 위한 유산균의 반응 메커니즘
유산균은 보통 발효 과정과 산업의 적용 동안에 산, 추위, 열, 건조, 산화 스트레스 등의 다양한 환경적 스트레스에 직면한다. 이러한 환경에 반응하여 유산균은 대사 능력과 더불어 강한 생리학적 능력과 환경 적응력이 필요하다. 유산균들은 다음과 같은 다양한 산성환경 적응 전략을 보유하고 있다. F-ATPase 활성 증가를 통한 세포 내 pH 항상성 유지, 아미노산 탈탄산화 시스템을 통한 세포 내 pH 상승, 세포막 구성 변화를 통한 양성자 투과성 감소, 대사 경로 전환에 의한 중화 과정, 스트레스 단백질 발현 증가를 통한 DNA와 단백질 손상 수리, TCS의 산 스트레스 감지 및 대응을 통해 산성 환경에 적응하게 된다(Cui et al., 2020).
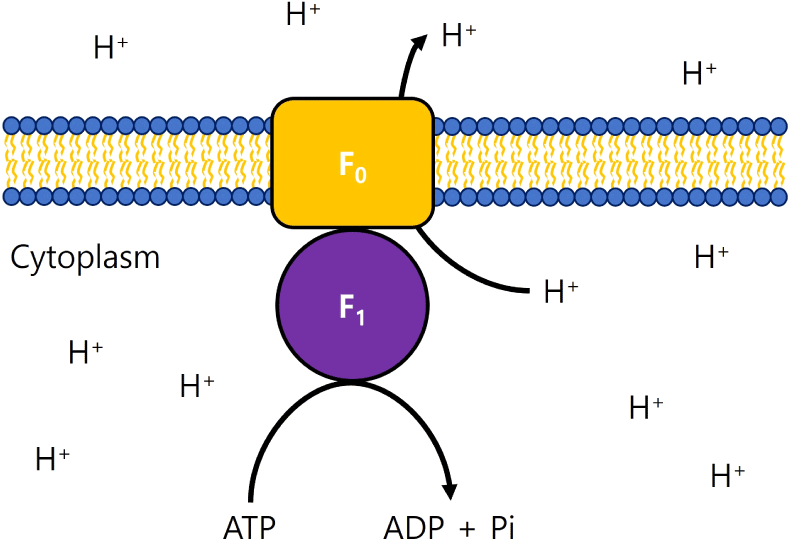
F-ATPase는 F1 단백질을 통해 세포 내 ATP를 가수분해 또는 합성할 수 있고, F0 복합체를 통해서 양성자를 수송하여 세포질 pH를 조절하는 보편적인 산 저항 경로에 이용된다(Fig. 1). F-ATPase는 산 내성의 중요한 구성 요소이며, 유산균에서 산 저항성이 높아질수록 활성이 증가한다. Lactococcus lactis, Lactobacillus helveticus, L. acidophilus, L. rhamnosus, Oenococcus oeni 등의 유산균 종에 F-ATPase가 잘 알려져 있다(Wang et al., 2018b). 낮은 pH 환경에서 L. acidophilus는 F-ATPase를 암호화하는 atp의 전사 수준이 높아졌으며, L. rhamnosus GG의 F-ATPase 유전자 발현을 유도하였다. 산 저항성 균주인 L. casei Lbz-2는 야생형 균주인 L. casei Zhang보다 H+-ATPase 활성이 더 높게 나타났다. 그와 동시에 낮은 pH에서 L. casei Zhang보다 더 높은 세포 내 pH를 보여주었다(Koponen et al., 2012; Kullen and Klaenhammer, 1999; Wu et al., 2012). 적응 진화 균주인 Leuconostoc mesenteroides LMS70은 장기간의 젖산 노출을 통해 산 내성 균주로 진화하였다. 전체 유전체 서열 분석을 통해 F-ATPase의 ε subunit을 암호화하는 atpC 유전자의 frameshift 돌연변이를 확인하였고, 이로 인해 산 조건에서 proton pump 활성이 향상되어 산 저항성이 증가한 것으로 보고되었다(Ju et al., 2016).
아미노산 탈탄산작용(amino acid decarboxylation)은 아미노산 antiporter와 결합하여 양성자의 생화학적 소비를 이끈다(Papadimitriou et al., 2016). 대표적인 예로 GABA는 세포질에서 glutamate의 탈탄산작용을 통해 만들어지며 이 과정에서 세포 내 양성자를 소비하게 된다. 따라서, glutamate decarboxylase(GAD) 시스템은 박테리아의 세포 내 pH 값을 유지할 수 있고 세포의 산 저항성에 중요한 역할을 수행하게 된다(Cui et al., 2020). L. brevis의 GABA 생산을 높이기 위해 GAD를 과발현시킨 F-ATPase 결핍 균주 L. brevis NRA6는 야생형 균주와 비교하여 GABA 전환율과 수율이 증가하였고, 동일한 조건에서 야생형 균주보다 1.22배 더 높았다(Lyu et al., 2017). 이 결과는 F-ATPase와 GAD 시스템이 산성 환경에서 밀접한 상관관계를 가지고 있으며, 가장 잠재력이 있는 산 저항성 시스템으로써 가능성을 보여주었다.
산 스트레스는 세포 표면의 분자적 변화를 야기할 수 있고, 박테리아는 외부 스트레스 반응으로 막 지질 구성을 변화할 수 있다. 세포질 막의 구성은 열에서부터 낮은 pH까지 다양한 스트레스에서 생존하기 위한 프로바이오틱스의 능력을 극대화할 수 있다(Papadimitriou et al., 2016). 산성 적응된 L. casei ATCC 334의 세포질 막 지방산 분석 결과, 대조군에 비해 포화 지방산과 사이클로프로판 지방산의 총 비율이 유의적으로 높게 나타났다(Broadbent et al., 2010). L. johnsonii NCC 533의 경우는 성장 배지에 불포화 지방산을 첨가하여 균주의 열과 산성 내성, 병원성균 저해와 같은 특성을 조사하였고, 막 조성과 형태가 크게 변화하는 것을 확인하였다. 특히, 막 지방산 구성이 포화 수준에서 열 또는 산의 충격 동안 세포 생존의 변화와 관련되어 있었다(Muller et al., 2011). 산 적응 진화를 통해 얻은 L. plantarum의 진화 균주는 전사체 분석과 지방산 측정을 통해 지방산 합성 경로 유전자 발현과 불포화 지방산 생산 증가가 관찰되었고, 이를 통한 세포막 구성의 변화는 수소이온의 유입을 막음으로써 세포 내 pH를 조절하고 산 내성에 기여할 것이라고 보고되었다(Zhu et al., 2024).
미생물의 바이오필름 형성과 물리화학적 변화는 환경 스트레스를 견뎌내는 중요한 생존 전략이 되어왔다. 낮은 pH 환경에 마주했을 때, 막 이동성과 불포화 지방산 비율 그리고 평균 사슬 길이의 증가는 바이오필름의 유동성, 지방산 분포, 세포의 온전함을 변화하여 유산균의 산 저항성을 증가하도록 만든다(Wang et al., 2018b). L. delbrueckii subsp. bulgaricus는 중심 대사 네트워크 유전자들이 피루브산 대사 변경을 통해 지방산 구성의 수정을 유도하여 바이오필름의 이동성에 영향을 주고 낮은 pH 조건을 극복하도록 도와준다고 보고되었다(Fernandez et al., 2008).
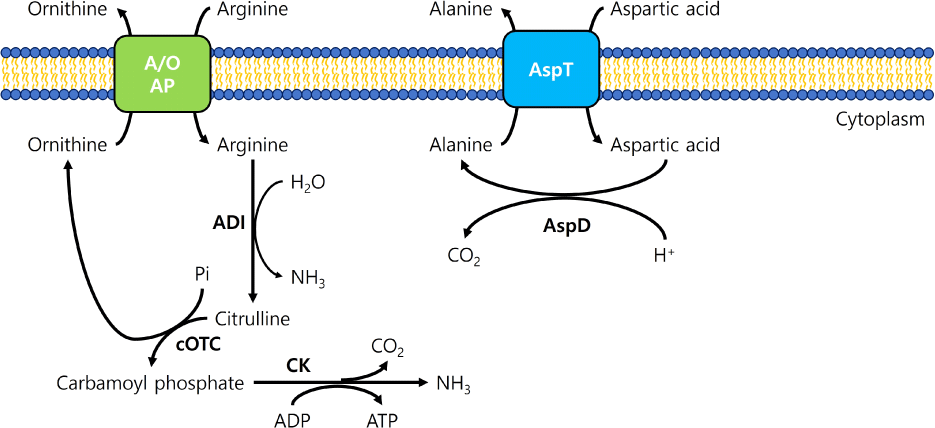
산 스트레스에 의한 대사 경로 전환은 중화 과정과 탈탄산작용을 포함한다. 미생물은 산을 중화하기 위해 요소, arginine, 암모니아와 같은 알칼리성 물질을 생산하거나, 대사 과정에서 탈탄산작용을 통해 CO2를 생산한다. 그 예로 Arginine deiminase system (ADI)과 Malolactic fermentation(MLF) 대사 경로가 있으며, 각자 알칼리성 물질인 암모니아와 탈탄산작용에 의한 CO2를 생산함으로써 세포 안의 pH 항상성을 유지하게 된다. 야생형 균주 L. casei Zhang과 비교하여, 산 저항성 돌연변이는 산성 환경에서 더 높은 세포 내 aspartate와 arginine 수준을 보여주었으며, arginine 또는 aspartate의 첨가에 의해 산 저항성이 증가하였다. Aspartate는 세포질에서 alanine으로 전환될 때, 탈탄산작용을 통해 양성자를 소비함으로써 산 저항성에 관여하는 것으로 보고되었다(Fig. 2). MLF는 O. oeni, Lactobacillus 속(현재 23개의 새로운 속으로 분류됨), Leuconostoc 속 등의 다양한 유산균에 의해 수행되며, L-lactic acid를 생산하기 위한 L-malate의 탈탄산반응으로 아미노산 탈탄산작용과 같이 양성자를 소비하여 산 스트레스에 대응한다. 그 예로 L. casei ATCC 334의 pH 2.5에서 생존 능력이 malate를 첨가함으로써 향상되었다는 연구 결과가 보고되었다(Wang et al., 2018b). Limosilactobacillus reuteri는 산 스트레스에 대응하기 위해 pH 3.5에서는 ADI 시스템을 사용하고, pH 2.5에서는 GAD 시스템을 활용함으로써 다른 조건의 산성환경에서 상호보완적으로 여러 산 저항 시스템을 사용한다고 보고되었다(Teixeira et al., 2014). Lc. lactis NCDO 2118은 GABA 생산 유산균으로 malate와 arginine 첨가를 통해 효율적인 산성환경의 완화를 통해 생존율이 향상되었다. Arginine과 glutamate를 같이 첨가한 경우에 GABA 생산량이 가장 높았고, arginine, malate, glutamate를 모두 첨가하면 pH 6.5에서 대수성장기에 GABA 생산이 가능하였다. 이와 같이 세 가지 기질의 상호 작용을 통해 ADI와 MLF가 GAD 시스템과 함께 산 저항성에 영향을 준다고 보고하였다(Laroute et al., 2016). 알칼리성 물질의 생산과 탈탄산작용 외에도 L. rhamnosus GG의 경우, 낮은 pH 환경에서 포도당과 같은 발효당의 존재 하에 생존율이 증가할 수 있다고 보고되었는데, 해당과정에서 F-ATPase에 ATP를 제공함으로써 양성자를 배출하고 보호 효과를 낼 수 있다고 추측하였다(Corcoran et al., 2005; Papadimitriou et al., 2016). 이와 같이, 산성 환경 대응을 위한 저항 시스템의 작동은 보편적인 대사 경로의 전환에 의해서도 가능하다.
낮은 pH 환경은 생존을 위한 유산균의 선택을 압박한다. 따라서 세포질 pH가 감소할 때, 유산균은 DNA와 단백질과 같은 주요한 생물학적 분자를 보호하기 위한 메커니즘을 작동한다(Wang et al., 2018b). 산성환경에 적응한 Lc. lactis 세포들이 더 낮은 pH 환경에서도 생존할 수 있는 것은 수소 이온의 세포질 농도와 거기에 의존하여 변화하는 몇몇의 대사물질이 산 스트레스에 대한 보호 단백질 합성을 자극하기 때문이라고 추측하였다. 실제로 환경 조건 변화에 박테리아의 적응은 주로 수많은 스트레스 단백질이 우선적으로 합성되는 유전자 발현의 리모델링을 통해 작동한다고 보고되어왔다(Kim et al., 2014; O’Sullivan and Condon, 1997; Rallu et al., 2000). 비록 유산균의 산 적응에서 그들의 정확한 역할은 완전히 이해되지 않았지만, 몇몇 일반적인 스트레스 단백질들이 산 스트레스를 받은 유산균에서 더 풍부하게 감지되었다. 대표적으로 chaperon 단백질은 기존의 필수 단백질을 산 손상으로부터 보호하는데 이용되며 단백질의 구조적 접힘이나 풀림을 돕는 단백질이다. 그 예로서 DnaK, GrpE, GroEL, GroES, ClpL 등과 열 충격 단백질인 Hsp1, Hsp3, Shsp 등이 있다(Budin-Verneuil et al., 2005; De Angelis and Gobbetti, 2004; Kim et al., 2014; Kwon et al., 2003). Streptococcus mutans는 산성 pH에서 DnaK와 ClpL 단백질의 증가가 보고되었고, Lc. lactis에서는 열과 저온 충격에 clpL 전사가 증가되는 것이 관찰되었다(Len et al., 2004; Martín-Galiano et al., 2005). L. johnsonii는 열 충격으로 증가된 GroESL chaperone이 동결 스트레스에 대한 유의적인 교차 보호를 제공하였다고 보고하였다(Walker et al., 1999). Escherichia coli의 dnaK를 Lc. lactis NZ9000에 도입한 결과, 스트레스 내성을 향상시키고 젖산에 대한 내성도 나타내는 것을 보여주었다(Abdullah-Al-Mahin et al., 2010). Streptococcus thermophilus의 shsp 이형 발현은 Lc. lactis ML23의 산 스트레스 생존율을 더 높이는 결과를 가져왔다(Tian et al., 2012). L. delbrueckii의 위장관 조건에서의 노출은 손상된 단백질의 재접힘과 분해를 촉진하는 chaperone인 clpP, clpE, clpL, clpX 유전자 발현의 증가를 가져왔다(Ferreira et al., 2013).
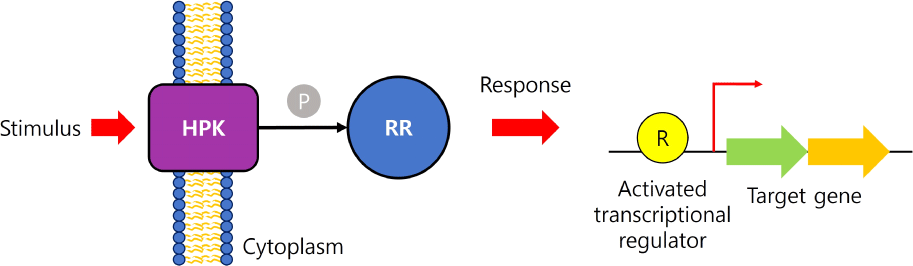
박테리아는 환경 변화에 생리학적 적응을 위해 TCS를 활용한다. 전형적으로 막 결합 감지기인 histidine protein kinase(HPK)와 효과기인 response regulator(RR)로 구성되는데 HPK는 세포질 막에 고정되어 있으며 환경의 변화를 모니터링하고, 그에 상응하는 세포질 RR은 환경 변화 신호에 반응하여 많은 경우 유전자 발현을 조절한다(O’Connell-Motherway & van Sinderen, 2000) (Fig. 3). 식품 유산균의 TCS에 관한 연구는 quorum sensing 메커니즘 조절, 박테리오신 생산으로 시작하였지만, 이후의 연구들은 TCS가 스트레스 반응, 질소 대사 조절, malate 대사 조절, 그리고 항미생물 펩타이드에 대한 저항성과 같은 다른 생리학적 과정에 참여한다는 것을 보여주었다. 이제까지 유산균의 TCS 연구는 상업적 유산균의 유용한 활용보다 병원성 유산균의 억제를 위한 목적으로 더 연구가 되어왔다(Monedero et al., 2017).
최근 진보된 분자적 기술 발달로 전체 유전체 서열 분석을 통해 다양한 유산균에서 추정되는 TCS가 많이 확인되었고, 관련 유전자들의 삭제 효과 실험은 서로 다른 스트레스에 TCS가 관여한다는 사실을 밝혀냈다. 하지만, 대부분 기존에 밝혀진 다른 박테리아의 TCS를 암호화하는 서열과 새롭게 확인된 유산균 유전체 서열을 비교한 결과물로, 특히 잘 알려진 대장균과 같은 다른 종의 미생물과 유산균 사이의 생물학적 차이점을 고려하면 유산균에는 아직 밝혀지지 않은 TCS가 더 많이 존재할 가능성이 있다(El-Sharoud, 2005). TCS complement는 유산균에서 아주 다양하다. 유전체 크기 또는 생활 방식과 TCS의 양 사이에 명확한 상관관계는 성립될 수 없지만, 일반적으로 가장 큰 유전체를 가지는 종들이 가장 많은 양의 TCS를 암호화한다(Papadimitriou et al., 2016). 유산균의 스트레스 반응에 TCS의 관여는 주로 TCS 결함 돌연변이의 표현형 분석에 근거해왔다. Homologous TCS의 불활성은 종종 서로 다른 표현형을 나타내는데 유전자 서열은 비슷하지만 유산균 종과 균주에 따라 생리학적 역할이 다르게 나타나는 것을 의미한다(Monedero et al., 2017; Papadimitriou et al., 2016). 그럼에도 OmpR/ⅢA 계열로 구성된 TCS가 유산균의 TCS로 암호화된 유전자 중에 71.45%로 가장 풍부하며 모든 균주에 오직 하나만 존재하고, 계통 특이적 유전자 손실에 의해 진화 및 수직 상속되어 유산균의 TCS를 연구하는데 가장 중요한 그룹으로 알려져 있다(Monedero et al., 2017; Zúñiga et al., 2011).
산 저항성과 관련한 TCS는 LisR/LisK, VicK/VicR, PhoR/PhoP 등이 가장 많이 알려져 있으며, 산 스트레스에 반응하여 다양한 변화를 통해 산성환경에 대응한다. LisR/LisK는 Listeria monocytogenes에서 확인된 산 내성에 관여하는 TCS로서 HPK의 삭제는 산성 내성의 성장기 변화를 나타내고, 에탄올에서 성장 능력 향상, 병원성 감소 등의 결과를 나타낸다고 보고하였다(Cotter et al., 1999). S. mutans는 산성 환경의 치아 플라크에서 살아가기 위해 glycosyltransferases (GTFs)를 이용해 바이오필름을 형성하는데 이 효소가 Leu. mesenteroides ATCC 8293의 GTFs와 48%의 유사성을 가지고 있다는 것이 확인되었다. 여기에서 VicK/VicR이 온도 스트레스에 반응하여 GTFs가 존재하는 오페론의 전사를 조절하는데 이용되는 것으로 알려져 Leuconostoc 속의 균주들도 다양한 스트레스에 대한 보호 장벽을 만들기 위한 다당류 생산에 이 조절 경로를 활용할 가능성에 대해서 보고하였다(Vallejo-García et al., 2023). PhoR/PhoP 시스템은 Bacillus subtilis에서 확인되는 인산 제한 반응 조절자로 세포벽 teichoic acid 합성, 세포벽의 구성 변화 및 인 저장 등을 조절한다고 보고하였다(Devine, 2018; Hulett, 1996). 이와 같이 TCS들은 다양한 박테리아에서 여러 스트레스 반응 조절에 이용되기 때문에 유산균의 산성환경 적응 과정에도 유사하게 적용될 가능성을 기대할 수 있고 그 활용에 대해 연구해볼 필요성이 있다.
유산균의 산성환경 적응 관련 연구
유산균은 발효 동안에 산성환경에 무조건적으로 노출되는 대사 특성에 따라 산성환경에 대한 적응 메커니즘을 발달해 왔고, 이러한 메커니즘을 이해하기 위한 다양한 연구들이 보고되어 왔다. 유산균 중에서도 종균과 프로바이오틱스로 활용하기 위해 가장 많이 연구되고 있는 Leuconostoc 속, Lactobacillus 속, Lactococcus 속 등의 산성환경 적응에 관한 연구결과를 살펴보고자 한다.
Leuconostoc 속 유산균은 다양한 발효 식품의 종균으로 사용되는 상업적으로 중요한 유산균이다. 특히 전통 발효 식품인 김치에서는 초기 발효 과정에서 김치의 맛을 좌우하는데 결정적으로 작용한다(Jung et al., 2012). 그러나, 산 스트레스에 대한 감수성 때문에 고밀도 세포 배양이 어려워 상업적인 활용도를 높이기 위해서는 Leuconostoc의 산 내성 메커니즘에 대한 이해가 필요하다(Kim et al., 2014). 최근에 적응 진화가 산 스트레스와 같은 특이적 성장 조건 아래 박테리아의 변화 적응을 유도하고 적합성 향상을 위한 하나의 전략으로 사용되고 있다. Ju 등(2016)은 Leu. mesenteroides ATCC 8293을 1년 동안 젖산에 장기간 노출하여 산 내성을 증가시키는 실험을 통해 산 내성 증가와 돌연변이 형성을 확인하였다. 그 중에 세포 내 pH 조절에 관여한다고 알려진 ATPase ε subunit의 돌연변이가 관찰되었고, 산 내성의 증가에 영향을 주는 것으로 보고되었다. D'Angelo 등(2017)은 Leuconostoc 속에 속하는 29개 균주에 대해 산업적 또는 보존 과정에 존재하는 열, 산, 알칼리, 삼투, 산화 등의 다양한 스트레스 요인의 저항성을 평가하였다. Leu. lactis, Leu. mesenteroides 균주들이 가장 높은 저항성을, Leu. pseudomesenteroides, Leu. citreum 균주들이 가장 낮은 저항성을 나타내었다. 열 적응은 세포 생존을 향상하였고, 산 요인에 대한 교차 저항성을 보여주었다. Leu. carnosum은 스트레스 반응과 관련한 추정 TCS로 6개의 HPK, 7개의 RR이 중심 유전체에 위치해 있었고, 4개의 완전한 TCS는 PhoR/PhoP, VicK/VicR, AgrC/AgrA, CiaH/CiaR과 같은 알려진 조절자들과 유사성을 보여주었다(Candeliere et al., 2021).
L. bulgaricus는 현재 가장 가치 있는 유산균 중에 하나이며 세계적으로 유제품 산업에 널리 사용되고 있다. Quantitative PCR을 활용하여 이들이 산에 적응하는 동안 발현되는 TCS를 확인하였을 때, 2개의 TCS와 2개의 HPK가 유도되었고, 각 TCS의 HPK와 RR을 삭제한 돌연변이 균주가 야생형 균주보다 산 적응이 감소되었다. 이 시스템의 RR 불활성은 비록 상응하는 HPK가 불활성되지 않더라도 산 민감성이 증가하는 결과를 나타내었다(Cui et al., 2012). Wang 등(2018)의 연구에서 L. bulgaricus의 산 적응에 관련되어 있다고 보고한 TCS JN675228(HPK1)/JN675229 (RR1)는 전사 데이터와 단백질 분석을 통해 proton pump 관련 단백질, 스트레스 단백질, 탄수화물 대사, 뉴클레오타이드 생합성, DNA 수리, 전사 및 번역, peptide 수송 및 분해, 그리고 세포벽 생합성 등을 포함하는 많은 경로와 관련되어 있다는 것이 확인되었다. Morel-Deville 등(1998)은 L. sakei의 5개 RR을 불활성하였고 이 중 4개의 돌연변이가 서로 다른 스트레스 조건에서 변화된 반응을 보여주었다. L. acidophilus의 연구는 TCS의 불활성화가 우유에서 산 내성을 감소시켰고 산화를 느리게 했으며, 또 다른 TCS는 담즙 내성과 관련이 있다는 것을 확인하였다(Azcarate-Peril et al., 2005). L. casei BL23의 모든 RR의 조직적인 불활성 실험은 17개 RR 중 3개의 불활성이 서로 다른 스트레스 조건에서 주요한 성장 저해를 나타내는 것을 보여주었다(Alcántara et al., 2011). L. reuteri를 pH 6.8에서 pH 4.0, pH 3.0까지 여러 산성조건에 일시적으로 노출하여 단백질 분석을 실시하였을 때, 운반 및 결합 단백질, 전사/번역, DNA 복제/수리, 뉴클레오타이드 대사 및 아미노산 생합성, 탄소 에너지 대사, pH 항상성, 스트레스 등과 관련한 단백질들의 발현이 유의적으로 변화한다는 것이 관찰되었다(Lee et al., 2008; Lee and Pi, 2010). L. casei Zhang은 pH 2.5에 노출 후에 대조군(pH 6.4)과 단백질체 비교 분석을 통해 탄수화물 이화작용에 관여하는 단백질의 발현이 변화한 것으로 밝혀졌다(Wu et al., 2011). L. plantarum 423은 pH 2.5에 노출된 후에 일반적인 스트레스 반응 단백질, 탄수화물 대사, 피루브산 대사 변화와 라이신 생합성 증가, 산화 스트레스 반응 등이 관찰되었고, 세포벽 및 인지질 생합성, 전사, 번역, 세포 분열에 관여하는 단백질의 현저한 감소가 확인되었다(Heunis et al., 2014). 최근에는 스트레스 내성을 가지고 있어 상업용 와인발효에 많이 이용되고 있는 O. oeni의 TCS를 L. plantarum WCFS1에 삽입하여 산성 스트레스 조건에서 야생형 균주와 비교한 연구가 보고되었다. 유전자 발현의 차이를 비교한 결과, 47개의 유전자가 하향 조절되었는데 열충격 단백질, DNA 손상 복구 관련 유전자가 포함되어 있어 TCS 재조합 균주가 산성 스트레스에서 야생형 균주보다 스트레스에 덜 민감하고 DNA 손상이 적었음을 보여주었다(Zheng et al., 2024).
Lc. lactis MG1363의 산성 내성 돌연변이 연구 결과는 산성환경 적응 과정에서 균주의 일반적인 산성 내성 메커니즘으로 확장될 수 있다고 보고하였다. 어떤 돌연변이 균주들은 pH 항상성을 유지하는 능력에 변화를 겪어 산성 스트레스에 특정하게 영향을 받는다면, 다른 경우에는 돌연변이 균주들이 주로 세포 구성 성분의 보호를 위해 일반적인 스트레스 반응을 나타낸다고 보고하였다. 전자는 glutamate 또는 인산 수송에 영향을 받는 돌연변이로 구성되어 스트레스 반응을 유발하는 대사물의 세포 내 수치 감소와 양성자 흡수 감소의 결과로 산성 내성이 증가하는 것으로 보고되었다. 인산 수송체에 결함이 있는 돌연변이의 높은 산성 내성은 스트레스 반응 유전자를 포함하는 조절 유전자의 유도에 기인할 가능성이 있으며, 낮은 pH가 인산 수송체의 활동을 감소시키는 관찰과 일치하였다(Rallu et al., 2000). Lc. lactis MG1363은 6개의 추정되는 TCS가 확인되었고, 그 중 4개가 pH, 삼투 또는 산화적 조건에 영향을 주는 것으로 보고되었다. TCS 파괴 돌연변이의 특성은 산 민감성/저항성, phosphatase 활성의 변화, 염과 과산화수소 민감성 증가로 야생형 Lc. lactis MG1363과 표현형에 차이점을 가지는 것으로 보고되었다(O’Connell-Motherway & van Sinderen, 2000). Lc. lactis의 gadB 돌연변이 균주와 gadCB 돌연변이 균주는 glutamate가 존재할 때 야생형 균주에 비해 낮은 pH에 더 민감하게 반응하였다. 또한, 배양 pH가 낮아지면 glutamate 존재 하에 gadCB 발현이 증가하는 결과를 통해 Lc. lactis가 생존을 위해 glutamate 의존적 산성 내성 메커니즘을 활용한다고 보고하였다(Sanders et al., 1998).
유산균의 GABA 생산과 산 저항 메커니즘
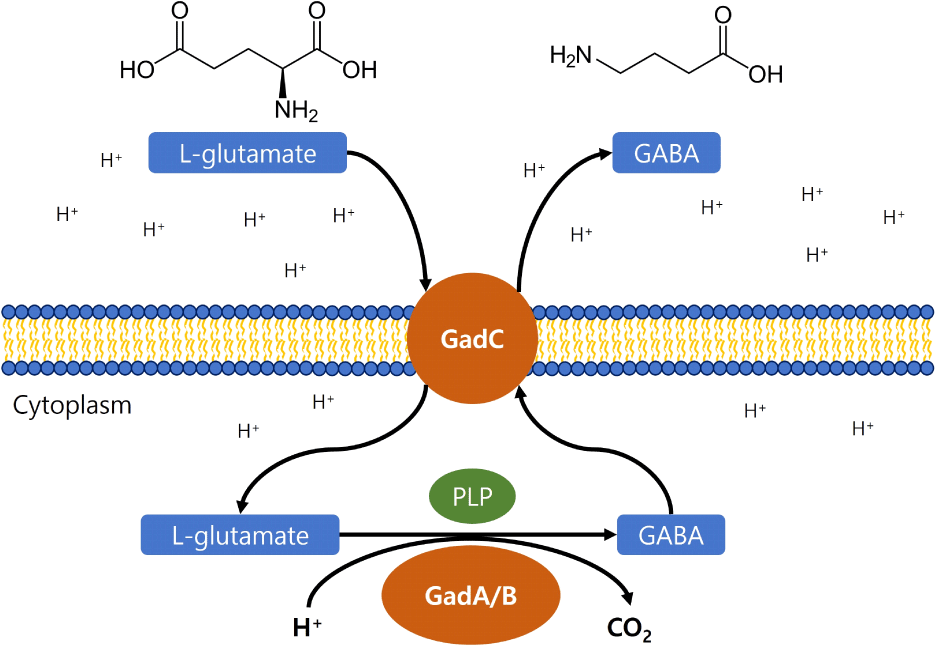
GABA는 중추신경계의 주요한 억제성 신경전달물질로 자연에 넓게 분포되어 있으며, 당뇨병, 고혈압, 우울증, 기억 상실, 불면증 개선과 같은 다양하고 중요한 생리학적 기능을 가지는 잠재적인 생리활성물질이다. 이로 인해 GABA의 상업적 생산에 대한 흥미가 꾸준하게 증가하고 있으며, 많은 약물과 기능성 식품의 생산에 응용되고 있다(Cui et al., 2020; Icer et al., 2024; Kim et al., 2022; Yang et al., 2008). GABA 생산 유산균은 최근 몇 년 동안 연구가 집중되어 왔고, 유산균 발효 식품에 응용하여 새로운 기능성 식품의 가능성을 제공하고자 하였다. GABA를 생산하는 유산균 중에는 Lactobacillus 속 균주들이 가장 많이 차지하며, L. brevis, L. bulgaricus, L. plantarum, L. helveticus, L. paracasei, Lentilactobacillus buchneri, L. futsaii 등이 있다. 여러 유산균 균주로부터 서로 다른 glutamate decarboxylase 효소와 유전자가 최근 분리되고 특징지어졌다. Glutamate decarboxylase (L-glutamate-1-carboxylase, GAD)는 pyridoxal-5’-phosphate (PLP) 의존 효소로 L-glutamate의 비가역적 탈탄산화(α-decarboxylation)를 촉매하여 GABA와 CO2를 생산한다(Yogeswara et al., 2020) (Fig. 4). GAD 시스템은 보통 glutamate/GABA antiporter를 암호화하는 gadC와 glutamate decarboxylase를 암호화하는 gadA, gadB로 구성되는 오페론 구조를 가진다. 또한, GAD 시스템은 유산균에서 필수적인 산 저항 메커니즘 중에 하나로 보고되고 있다. Lc. lactis와 L. brevis ATCC367에서 GAD 시스템의 잠재적인 전사 조절 유전자인 gadR의 파괴가 gadC와 gadB의 발현 감소의 결과를 가져왔다고 보고되었다. GadR의 불활성은 완전히 GABA 생산을 억제하였고 glutamate 의존 산 저항성을 감소하였다. 이러한 결과는 GadR이 양의 전사 조절자로서 GABA 생산과 산 저항성에 관여한다는 것을 의미한다(Gong et al., 2019; Sanders et al., 1998).
GAD 시스템은 미생물이 낮은 pH 환경에서 생존할 수 있도록 하는 주요 산 저항 메커니즘으로 유산균에서 여러 번의 독립적인 오페론 구조의 획득 또는 상실을 통해 진화하였다. 그러나, 종의 분화와 GAD 및 transporter 유전자의 기원은 불일치하여 종의 진화가 곧 GAD의 진화를 의미하지는 않는다. Sezgin 등(2023)의 연구를 통해 오페론 구조 내의 GAD 유전자는 느린 분자 진화와 높은 보존성을 보여준다는 사실을 확인하였고, 검토된 유산균 종에서 모든 GAD 및 transporter 유전자는 산 저항 유전자들이 발현하는데 사용하는 코돈을 가지는 경향을 보여주었다. 이 결과는 GAD 시스템이 산 저항 메커니즘의 하나로 활용되고 유산균이 산성 환경에서 생존하는데 역할을 하는 것을 의미한다(Sezgin and Tekin, 2023). S. thermophilus IFO13957과 L. bulgaricus IAM1120의 혼합배양(co-culture)은 단독으로 배양할 때보다 GABA 생산이 증가하였다. 이 결과는 GABA 생산능이 높은 S. thermophilus가 GABA 생산을 통해 배양에 의해 형성된 산성환경을 완화하여 산 저항성이 낮은 L. bulgaricus의 성장을 증가함으로써 전체 GABA 생산량을 높이는 것으로 확인되었고, 산업적 응용 가치가 있을 것으로 보고되었다(Watanabe et al., 2011). L. brevis의 경우, GAD 유전자를 삭제하여 정지기에 도달한 돌연변이 균주를 pH 2.5의 환경에 노출시켰을 때, 5시간만에 생존율이 야생형 균주에 비하여 약 100배 떨어지는 것을 확인하였으며, 다시 GAD 유전자를 삽입하면 야생형 균주만큼 생존하는 것으로 보고되었다(Lyu et al., 2018). GABA 생산 능력을 가진 L. brevis Lbr-6108과 GABA를 생산하지 않는 L. brevis Lbr-35를 pH 3.0의 성장배지와 pH 3.0의 0.5% saline에서 배양하였을 때, GABA 생산 균주의 생존율이 유의하게 높았고, 특히 성장배지에서 생존율이 100%였다는 결과를 통해 산 저항성에 GABA 생산과 더불어 성장 요소들도 필요하다는 것이 확인되었다(Banerjee et al., 2021). 이것은 GABA 생산의 자극제이자 기질이 되는 glutamate에 의해 GAD 시스템의 발현이 시작된다는 기존의 연구 결과와 일치하였고, GABA의 생산이 유산균의 산 저항 메커니즘 중에 하나로 중요하다는 것을 의미한다.
병원성균과 유산균에서 TCS와 GABA 생산 연계성 비교
박테리아의 glutamate decarboxylase acid-resistance system 또는 glutamate-dependent acid-resistance system은 Escherichia, Salmonella, Listeria, Helicobacter, Brucella와 같은 병원성균들이 산성환경에서 살아남기 위한 방법으로 잘 알려져 있다. 이러한 산 저항 시스템에서 gadC와 gadA, gadB의 전사 조절은 박테리아에서 가장 복잡한 경로 중에 하나이다. 부분적인 연결 회로에 사용되는 20개 이상의 조절 요소와 암호화되지 않은 여러 작은 RNAs는 그들의 발현을 조절하는데 관여한다(Schwarz et al., 2022). 식품 병원균이 낮은 pH 식품에서 생존하는데 있어서 단일 대사 시스템의 기여는 GAD 시스템이 처음으로 밝혀졌으며, 풍미를 증가하기 위해 의도적으로 glutamate를 첨가한 낮은 pH 식품에서 GAD 시스템은 리스테리아의 생존에 지배적인 역할을 하여 병원성균 오염에 막대한 영향을 줄 수 있다고 보고하였다(Cotter et al., 2001). 병원성균은 산성환경에서 살아남기 위해 이를 감지하고 반응하는데 global regulator와 TCS를 사용한다. 이러한 조절 인자들은 산과 같은 환경 스트레스에 반응하여 다른 환경 저항 시스템과 더불어 GAD operon의 발현까지 유발하여 산 저항성에 역할을 하게 된다. 병원성균의 경우 sigma S(RpoS)라는 global regulator가 GABA 생산에 중요한 역할을 수행하고 있으나, 유산균에서는 sigma S를 찾을 수 없으며, 대신 스트레스 반응에 관여하는 몇몇 스트레스 단백질(DnaK, GroEL, Clp)과 그 조절 인자(HrcA 및 CtsR)가 보존되어 있어 이것을 이용한 one-component system 조절과 TCS에 의해 산 저항성에 대응하는 것으로 추측하고 있다(Franz and Holzapfel, 2011).
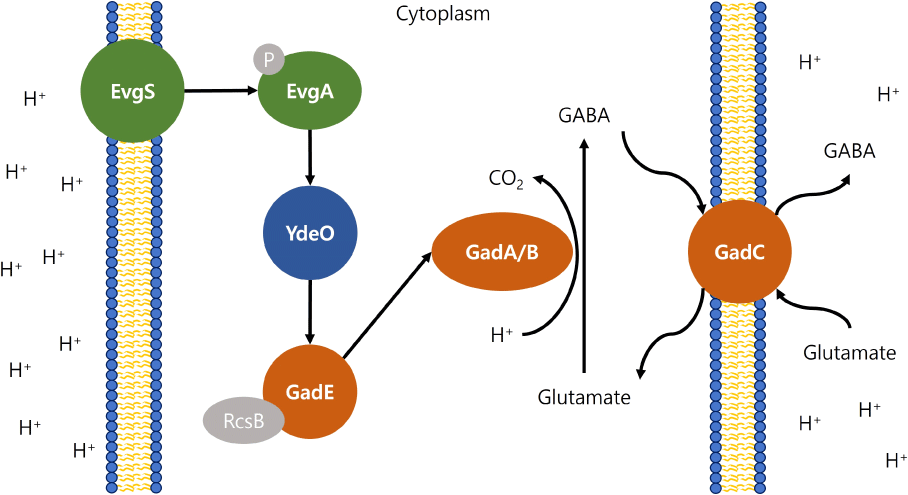
대장균은 TCS와 GAD 시스템의 관계를 가장 활발하게 연구한 미생물로서 산성 스트레스 상황에서 GABA 생산을 포함한 여러가지 산 저항 경로를 예측해 볼 수 있다(Schwarz et al., 2022). EvgS/EvgA는 대장균의 다섯가지 특이한 TCS 중에 하나이며, 산성 pH, 다중약물, 그리고 열과 같은 환경 변화에 적응하기 위해 박테리아의 행동을 조절하는데 필수적인 역할을 수행한다. EvgS/EvgA는 대장균의 glutamate-dependent acid-resistance system에서 gadE 전사에 관여한다. gadE는 대장균의 GAD 시스템의 중심이 되는 전사 조절자이며, EvgS의 외부 산성환경 감지로부터 시작되어 인산기의 전달을 통해 활성화된 EvgA와 YdeO가 차례로 신호전달을 하여 gadE의 전사를 조절하게 된다. 이후에 gadA/B와 gadC 오페론의 발현을 조절함으로써 GABA 생산을 통해 산 저항성을 높이는 것으로 보고하였다(Schwarz et al., 2022; Zhang and Wang, 2023) (Fig. 5).
유산균의 경우도 다른 박테리아와 같이 스트레스 요인에 대한 정교한 방어 메커니즘을 발달시켰으며, 그 중에 TCS가 가장 보편적이다. TCS를 통해 산성환경에 반응할 때, 앞서 언급한 바와 같이 proton pump 활성, 단백질 및 탄수화물 대사, 세포벽 합성, 바이오필름 형성 및 스트레스 반응 단백질 생성 등 여러 산 저항 관련 유전자 발현이 조절될 수 있으므로 산 저항성과 유의적 관계가 밝혀진 GAD 시스템과의 연계성이 시사된다. GAD 시스템은 glutamate 또는 산 자극에 의해 발현되기 때문에 산 자극을 인지한 TCS가 유산균 GAD 시스템의 양성 조절자인 gadR의 발현을 유발하여 궁극적으로 GABA 생산의 변화를 가져올 것으로 예측된다. 상기 언급된 산 저항성과 관련한 몇몇 TCS 시스템은 이미 밝혀진 것처럼 유산균에서도 유사하게 존재한다는 사실이 확인되었으며, 산 저항성에 관여하는 GAD 시스템 조절과도 관계될 수 있다. 향후 산성환경에서 GAD 시스템의 조절이 어떻게 시작되고 전개되는지 GABA 생산 유산균의 TCS에 대한 추가 연구가 필요하다.
결 론
유산균은 발효 과정에서 젖산을 생성함으로써 주변 환경을 산성화시키는 특성을 지니며, 프로바이오틱스로서 인체 위장관의 강한 산성 환경에서도 생존해야 하기 때문에 이들의 산성 적응 시스템은 매우 중요하다. 본 리뷰에서는 유산균의 산성환경 적응 메커니즘 분석을 통해 TCS가 환경 변화를 감지하고 이에 대응하는 유전자 발현을 조절하는 것을 확인하였고, 산 스트레스 반응의 일환으로 생산되는 GABA가 산성환경 적응에 기여하는 메커니즘을 검토하였다. 유산균의 산성환경 적응 메커니즘에 관한 주요 연구 결과를 종합적으로 분석한 결과, TCS 신호전달 체계와 GABA 생산과정 사이에 잠재적 연결고리가 존재할 가능성을 제시하였고, 이는 유산균의 GABA 생산 향상을 위한 새로운 전략 개발에 중요한 기초 자료가 될 것으로 기대된다.







