서 론
고려인삼은 오가과(Araliaceae), 인삼속(Panax)에 속하는 식물로 한국과 중국을 비롯한 동양에서 오랫동안 뿌리를 약용으로 이용하고 있다. 인삼은 1843년 C. A. Mayer에 의해 만병을 치료한다는 의미로 Panax ginseng C. A. Meyer라고 명명되었으며, 주요 성분으로 인삼사포닌, 페놀, 알칼로이드, 정유, 유리당, 아미노산, 유기산, 탄수화물, 비타민 등 다양한 영양물질과 생리활성 성분들이 함유되어 있다. 인삼의 기능성으로는 면역증강, 항염 작용, 항산화 작용, 피로회복, 혈행 개선, 신경전달 조절, 기억력 개선 등이 있으며, 그 외 단백질 및 핵산 생합성 촉진 작용, 조혈 작용, 동맥경화 예방, 혈당강하 작용, 항피로 및 항스트레스 작용 등의 약리작용도 보고되어 있다(Park et al., 2018; Park et al., 2012; Yang et al., 2015). 인삼의 주요한 생리활성물질로 인삼사포닌, 페놀성 물질, 폴리아세틸렌, 알칼로이드, 산성다당체 등이 알려져 있으며(Kim et al., 1987; Park, 1996; Santa et al., 1974), 그 중에서도 인삼사포닌으로 불리는 ginsenoside(GS)는 동물실험과 임상연구를 통하여 인삼의 가장 중요한 약리활성 성분으로 인정받고 있다. Shibata 등(1963)이 백삼으로부터 TLC를 이용하여 13종의 GS를 분리한 이후, 많은 연구자들에 의해 인삼으로부터 50여종 이상의 GS가 분리되어 그 화학구조가 밝혀졌다.
일반적으로 GS는 구성 성분에 따라 생리활성, 생체이용율 및 약리효과가 다르게 나타나며, 인삼 섭취 시 고분자 GS는 장관 내에 존재하는 특정 장내미생물의 효소작용에 의해 저분자 배당체 또는 무배당체로 분해되어야만 체내로 흡수될 수 있다(Kim, 2018; Lee et al., 2009). 인삼 사포닌의 90% 이상을 차지하는 고분자 GS는 체내 흡수율이 매우 낮으며, 장관에서 미생물에 의해 대사되더라도 개인의 체질과 식습관 및 장내미생물의 분포에 따라 GS의 흡수율과 약리 효과가 다르게 나타나므로, 고분자 GS를 흡수가 용이한 저분자 GS로 전환시킬 수 있는 화학적, 물리적, 생물학적 방법이 개발되었다. 하지만 산 처리에 의해 C-20 위치에 결합된 당 부위가 비선택적으로 분해되며, epimerization, hydration, hydroxylation 등의 부가적인 반응과 더불어 환경오염 물질이 생성될 수 있고, 열처리 방법은 고온을 유지하기 위한 에너지와 비용이 많이 소모되는 단점이 있다(Han et al., 1982; Quan et al., 2015). 물리적, 화학적 방법과 비교하여 미생물 발효 또는 미생물 유래 효소를 이용한 생물전환은 배당체의 당 부위를 선택적으로 분해할 수 있고, 반응 조건이 온화하며, 환경 친화적인 장점이 있기 때문에, GS의 흡수율을 높이고 약리적 효능을 극대화시키기 위한 방안으로 효소 또는 미생물을 활용한 생물전환 연구가 수행되고 있다.
유산균은 전통적으로 오랜 기간 동안 김치, 발효유, 젖갈, 장류, 치즈 등 다양한 발효식품의 제조에 이용되어 왔기 때문에 일반적으로 안전하다고 인식되는 미생물(GRAS, generally recognized as safe)로 간주되고 있다. 최근 학계와 산업체에서는 β-glucosidase 활성이 높고 GS의 전환능이 우수한 다양한 종류의 유산균들을 이용하여 고분자 GS를 생리활성이 뛰어나고 생체 흡수율이 높은 compound K(CK)로 전환시키는 연구가 활발히 진행되고 있다. 현재 국내 식품업체에서 유산균 발효에 의해 CK 함량이 보강된 발효홍삼 제품이 개발되고 판매되면서 고기능성 발효홍삼제품에 대한 소비자의 관심이 고조되고 있다. 따라서 본 논문을 통하여 장내미생물에 의한 GS 대사와 유산균을 활용한 생물전환의 최신 연구동향에 대하여 알아보고자 한다.
Ginsenoside의 구조적 특성
다른 식물체의 사포닌과 구분하기 위해서 인삼의 사포닌은 일반적으로 ginsenoside(GS)라고 불리는데, 이는 인삼(ginseng)에서 분리된 배당체(glycoside)란 의미로 붙여진 이름이다. GS는 당(glycone)과 비당(aglycone)으로 구성된 배당체(glycoside)로, 고려인삼은 대부분 triterpenoid dammarane 비당부 골격에 한 개 또는 그 이상의 당 분자가 결합되어 있다. GS는 종류에 따라 ginsenoside Rx라고 명명하며, “R”은 Radix 또는 뿌리(Root)를 의미하고, X는 TLC 상에 나타나는 spot의 이동거리(Rf치)에 따라 아래부터 위쪽으로 a, b, c의 알파벳 순서로 이름이 명명되었다(Shibata et al., 1966). GS는 비당부에 부착된 수산기(-OH)의 수에 따라 크게 protopanaxadiol(PPD)계 GS와 protopanaxatriol (PPT)계 GS로 분류되며, PPD계는 2개의 수산기(C-3번과 C-20번), PPT계는 3개의 수산기(C-3번, C-6번, C-20번)를 갖고 있는 점에서 차이가 있다(Park et al., 1996). 또한 PPD계 사포닌은 C-3번과 C-20번의 수산기에, PPT계 사포닌은 C-6번과 C-20번의 수산기에 glucose, arabinose, xylose, rhamnose 등과 같은 당류가 에스테르(ester) 결합하여 배당체 구조를 이루고 있다. PPD계 주요 GS는 Rb1, Rb2, Rc, Rd, Rg3, F2, Rh2, CK 등이 있고, PPT계 주요 GS는 Re, Rf, Rg1, Rg2, Rh1, F1 등이 있다(Fig. 1).
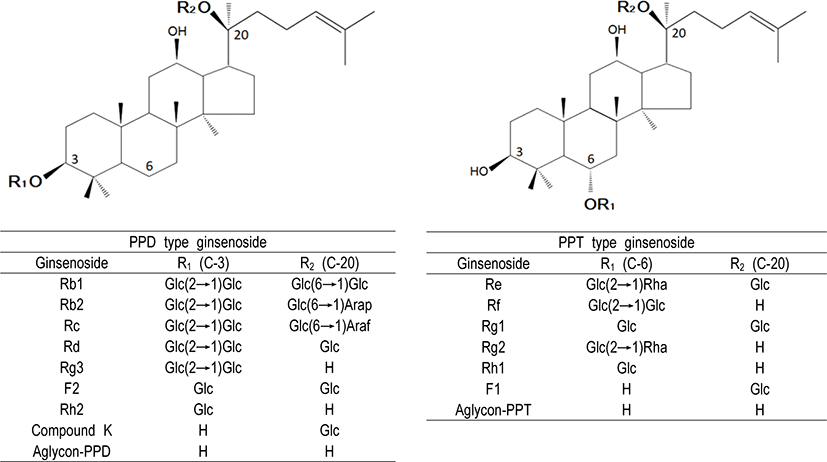
GS는 인삼에 함유되어 있는 양에 따라 major GS와 minor GS로 구분되기도 하는데, 특별한 가공처리를 거치지 않은 인삼에는 Rb1, Rb2, Rc, Re, Rf, Rg1 등의 major GS가 90% 이상 함유되어 있다(Christensen, 2009). 반면에, major GS의 배당체에서 당이 유리된 구조를 갖는 minor GS(Rg2, Rg3, Rh1, Rh2, F1, F2, CK)는 인삼에 소량으로 함유되어 있는 GS를 의미하지만, F2와 CK는 인삼에서 검출되지 않고 섭취 이후 장내대사 과정에서 생성된다(Kim, 2018; Santangelo et al., 2019). Lee 등(2015)은 수삼(fresh ginseng)에는 PPD 계열의 GS 함량이 Rb1(2.02 mg/g), Rc(0.66 mg/g), Rb2(0.63 mg/g), Rd(0.15 mg/g) 순으로, PPT 계열은 Rg1(2.01 mg/g), Re(1.75 mg/g), Rf(0.54 mg/g), Rg2(S) (0.13 mg/g) 순으로 함유되어 있어, Rb1, Rb2, Rc, Re, Rf, Rg1 등의 major GS가 인삼 전체 GS 성분의 대부분을 차지하는 것을 확인하였다.
인삼에 고농도로 함유되어 있는 major GS는 당이 다수결합된 친수성의 배당체 구조를 갖고 있으므로 그 자체로는 장관 투과성 및 생체 이용률이 극히 낮은 반면, 당이 하나만 결합된 CK와 같은 소수성 GS는 체내 흡수율이 높고 약효 면에서도 major GS와 비교하여 우수하다(Santangelo et al., 2019; Yang et al., 2015). 최근의 연구에 의하면 인삼을 섭취한 이후 CK가 주된 성분으로 혈액에서 검출되며(Kim et al., 2013; Lee et al., 2009; Tawab et al., 2003; Wan et al., 2017), Rb1과 비교하여 항암 및 항염 활성이 매우 높은 것으로 보고되었다(Yao et al., 2018; Wang et al., 2012). CK의 주요 약리작용으로는 항암작용, 항염작용, 인지개선 및 신경보호작용, 신경전달조절 작용, 항노화작용, 간 기능강화 작용 등이 입증되었다(Bai et al., 2018; Kim and Kim, 2018; Oh and Kim, 2016; Yang et al., 2015; Yao et al., 2018).
인삼 가공처리에 의한 ginsenoside 전환
인삼은 크게 수삼, 백삼 및 홍삼의 세 종류로 분류된다. 수삼은 인삼을 경작지에서 수확한 후 가공 처리하지 않은 생인삼(fresh ginseng)이며, 일반적으로 가공법에 따라 백삼(white ginseng)과 홍삼(red ginseng)으로 구분하고 있다. 백삼은 표피를 살짝 벗겨낸 수삼을 일광 건조하거나 열풍 건조하여 가공한 인삼이고, 홍삼은 표피를 벗기지 않은 수삼을 90~98°C에서 1~3시간 증숙한 후 건조하여 가공한 인삼을 말한다. 홍삼은 열처리 과정에서 수삼이나 백삼에 존재하지 않는 홍삼특유성분인 Rg3, Rh1, Rh2, Rs4 등이 생성되고, 미량으로 존재하는 minor GS의 함량이 증가되기 때문에 항암작용(Keum et al., 2000; Kim et al., 1999), 혈압강하 작용(Yue et al., 2006), 뇌신경세포 보호작용(Bao et al., 2005), 항혈전작용(Jung et al., 1998), 항산화작용(Keum et al., 2000) 등 약리적 효능이 수삼과 백삼에 비해 우수하다는 것이 입증되었다. Kim 등(2013)은 국내 시판되는 18종 홍삼농축액의 총 GS 함량은 11.9~57.9 mg/g으로 평균적으로 28.6 mg/g을 함유하고 있으며, 그 중에서 Rb1, Rg1, Rg3는 각각 4.7, 0.8, 2.0 mg/g이 함유되어 있다고 보고하였다. Rg3는 수삼이나 백삼에는 존재하지 않고 홍삼에만 특이하게 존재하는 GS로 열처리 과정 중 Rb1, Rb2, Rc, Rd의 당 부위가 분해되어 Rg3로 전환되며, 홍삼제품의 지표성분으로 활용되고 있다(Lee et al., 2015). 식품의약품안전처의 건강기능식품 기준 및 규격에 따르면 홍삼 건강기능제품류의 기능성분(또는 지표성분)의 일일섭취량을 Rb1, Rg1 및 Rg3의 합으로서 2.4~80 mg으로 설정하고 있다. 한편, Rf는 미국삼, 중국삼 및 일본삼에서는 검출되지 않는다고 보고되고 있어 인삼에서 Rf의 존재 여부는 국내산 인삼의 판단 여부를 확인할 수 있는 지표성분으로 이용된다(Kim et al., 2013).
홍삼 제조 시 열처리에 의해 GS 성분이 화학적으로 변화되어 백삼에 존재하지 않는 새로운 GS 성분이 생성되고, 백삼에 미량으로만 존재하는 일부 minor GS의 함량이 증가한다. 홍삼은 증숙과정에서 C-20 위치의 glycosyl 잔기가 분해되고 수산화기가 이성화되어 홍삼 특유의 Rg3, Rh1, Rh2, Rs4 등이 생성되며, malonyl-Rb1, -Rb2, -Rc, -Rd로부터 malonyl 잔기가 분해되어 PPD계 GS인 Rb1, Rb2, Rc, Rd의 함량이 증가된다(Kim et al., 2013; Kitagawa et al., 1989; Kong et al., 2009). 홍삼은 수삼을 한번 찐데 비하여, 흑삼은 수삼을 찌고 건조하는 과정을 3회 이상 반복한 것으로 담흑갈색 또는 흑다갈색을 띠고 있으며, 반복적인 증숙과 건조 처리에 의해 GS의 성분을 비롯하여 물리화학적 특성이 홍삼에 비해 더욱 변화된다(Han et al., 2005; Nam et al., 2012). Jo 등(2011)은 GS 배당체가 열에 의해 분해되어 생성된 prosapogenin(Rg2, Rg3, Rg5, Rg6, Rh1, Rh4, Rk1, Rk3, F1, F4) 성분을 비교한 결과, 구중구포법(증숙•건조를 9회 반복)에 의해 제조된 흑삼이 홍삼에 비해 약 2.6배의 높은 prosapogenin 성분을 함유하고 있다고 보고하였다.
홍삼의 제조과정 중 열처리에 의해 유리되어 생성되는 malonic acid와 acetic acid 등의 유기산에 의해 GS의 분해가 촉진되고, citric acid 등 유기산 첨가에 의해서 GS 전환율이 향상되는 것으로 나타났다. Kong 등(2009)은 수삼을 1 M의 citric acid 또는 ascorbic acid에 침지한 후 감압하여 제조한 홍삼에서 Rb1, Rc, Re, Rf, Rg1 등 major GS의 함량이 감소되고, Rg3, Rh2, Rd로의 전환이 증가되었으며, citric acid가 ascorbic acid 보다 더 높은 GS 전환율을 나타냈다고 보고하였다. Liu 등(2016)은 인삼을 120°C에서 증숙하는 동안 demalonylation, decarboxylation, deacetylation 반응이 일어나 산성의 malonyl-GS로부터 malonic acid와 acetic acid가 유리되었으며, 이들 유기산에 의해 Rb1 등 major GS의 분해가 촉진된다고 보고하였다. Jang 등(2018)은 증숙과정 중 citric acid, malic acid, succinic acid 등 유기산 첨가에 의해 Rb1의 Rg3, Rk1, Rg5로의 전환이 증가되었으며, 비교적 산성이 높은 citric acid(pKa=3.14)가 malic acid(pKa=3.40)와 succinic acid(pKa=4.20)에 비해 높은 전환율을 나타내어 유기산에 의한 산 가수분해 효과를 확인하였다.
Ginsenoside의 대사에서 장내미생물의 역할
인체에는 소화기관뿐만 아니라, 피부, 구강, 호흡기, 생식기 등 수많은 조직에 수조 ~ 수십조개의 다양한 공생미생물이 서식하고 있다. 전체 미생물의 90% 이상이 대장을 포함한 소화기관에 분포하며, 위장관 내에는 50가지 이상의 문(phylum), 약 1,000 종 이상의 다양한 세균이 존재하고 있다(Eckburg et al., 2005). 그 중에서도 Firmicutes, Bacteroidetes, Actinobacteria, Proteobacteria, Verrucomicrobia의 5개 문이 주종을 이루고 있으며, 특히 Bacteroidetes와 Firmicutes의 2개 문이 장내 미생물의 80% 이상을 차지하는 것으로 알려졌다(Eckburg et al., 2005; Lozupone et al., 2012). 개인의 장내미생물 분포는 출산방법, 식생활, 생활방식, 위생상태, 건강상태, 약물복용 등 환경적 요인들에 의해 영향을 받기 때문에 개인간에 장내미생물의 조성 차이가 크다고 알려졌다(Arumugam et al., 2011; Lozupone et al., 2012). 특히 식습관과 항생제 복용은 장내미생물 분포 변화에 기여하는 대표적인 환경요인으로 알려져 있으며, 장내미생물 분포의 변화는 비만, 당뇨, 심혈관계 질환, 위장관 질환, 신경계 질환, 암 등 다양한 질병 등의 병인과 관련이 있는 것으로 밝혀지고 있다(Cho and Blaser, 2012; Lynch and Pedersen, 2016).
장내미생물이 생산하는 효소들이 약물, 생약, 천연물의 대사과정에 관여하므로, 장내미생물 분포의 차이에 의해 약리적 효능에서 개인차가 나타날 수 있다(Pan et al., 2019; Xu et al., 2017). 약물과 마찬가지로 친수성 GS는 장내미생물에 의해 CK와 같은 소수성 GS로 전환되어야 장관에서 혈액으로 용이하게 흡수되어 약리작용을 발휘할 수 있다. 하지만 인삼을 섭취하는 사람의 체질과 식습관에 따라 당이 다수 결합된 친수성 GS를 소수성 GS로 전환할 수 있는 장내미생물의 존재 유무와 분포가 다르기 때문에 약리작용을 갖는 유효성분의 생체이용율 및 효능에서 개인차를 나타내게 된다(Kim et al., 2013; Lee et al., 2009; Wang etal., 2011). 인삼에 다량 함유된 major GS 배당체인 Rb1, Rb2, Rc, Re, Rg1 등은 인삼 섭취 후 장관에 존재하는 특정 장내세균의 효소작용(주로 deglycosylation, oxygenation, hydrolysis)에 의해 배당체에 결합된 당이 유리되어 CK, protopanaxatriol 등과 같은 소수성의 저분자 GS로 전환되어야 체내로 용이하게 흡수될 수 있다(Hasegawa et al., 1996; Lee et al., 2009; Wang et al., 2011; Kim, 2018). 장내세균 중에서 Bacteroides와 Lactobacillus 속은 deglycosylation 작용에 관여하고, Bacteroides, Bifidobacterium, Clostridium, Eubacterium, Fusobacterium, Lactobacillus, Peptostreptococcus, Prevotella 속은 oxygenation과 hydrolysis 작용에 관여한다고 알려졌다(El Kaoutari et al., 2013; Santangelo et al., 2019). PPD계 Rb1, Rb2, Rc는 Bacteroides, Bifidobacterium, Eubacterium, Fusobacterium, Provotella oris 등의 장내세균이 생산하는 β-glucosidase, β-xylosidase, α-arabinofuranosidase, α-arabinopyranosidase의 작용에 의해 당이 분해되어 CK로 전환 되고(Bae et al., 2000; Bae et al., 2002a; Bae et al., 2002b; Hasegawa et al., 2000; Kim, 2009), PPT계는 Bacteroides, Eubacterium, Fusobacterium 등이 생산하는 α-rhamnosidase와 β-glucosidase에 의해 Rh1 또는 protopanaxatriol로 전환된다고 보고되었다(Bae et al., 2000; Bae et al., 2005).
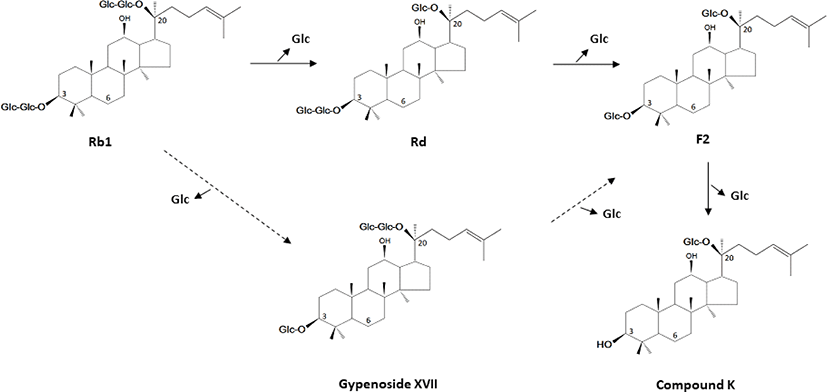
PPD계 GS는 위에서 분해되지 않고 장내세균에 의해 CK로 대사되어 체내로 흡수된다. PPD계 주요 GS인 Rb1은 장내세균에 의해 주로 Rb1 → Rd → F2 → CK 순으로 대사되지만, gypenoside 경로(Rb1 → G-XVII → G-LXXV → CK)에 의해 대사되 기도 한다(Shen et al., 2013). Rg1, Rg2, Re 등 대부분의 PPT계 major GS는 장내세균에 의해 Rh1과 protopanaxatriol로 대사되지만, Rg1과 Re는 위산에 의해 분해되어 Rh1과 Rg2로 전환되고, 그 중 Rh1은 위와 소장에서 흡수되어 혈액에서 검출된다고 보고되었다(Kim et al., 2018). 최근의 동물실험 및 임상연구에 의하면 인삼을 섭취한 이후 CK가 주된 성분으로 혈액에서 검출되는 것으로 밝혀졌다. Akao 등(1998)은 Rb1을 경구투여한 쥐의 혈장에서 고농도의 CK가 검출되었지만 Rb1은 소량으로만 검출되었으며, Hasegawa 등(2000)은 Rb1의 체내 흡수율은 4.35%에 불과하고, Rb1, Rb2, Rc, Rd, Re, Rg1 등은 위장관에서 거의 흡수되지 않는다고 보고하였다. Tawab 등 (2003)은 인삼추출물을 섭취한 사람의 혈장과 소변에서 주된 성분으로 CK가 검출되는 것을 확인하였으며, Lee 등(2009)은 인삼 섭취 이후 4시간 만에 CK가 혈액으로 흡수되기 시작하여 9-14시간에 최고치로 흡수되는 것을 확인하였다. Kim(2013)은 홍삼추출물 9 g/day을 섭취한 이후 성인 남성의 최대혈장농도의 평균값은 각각 8.35±3.19 ng/mL, 3.94±1.97 ng/mL로, CK의 농도가 Rb1에 비해 약 2.1배 높았다고 보고하였다.
Kim 등(2013)은 인삼의 주요 성분인 Rb1을 CK로 대사할 수 있는 능력이 있는 사람의 분변에서 대사활성과 장내세균을 분석한 결과, 대사능력이 없는 사람과 비교하여 높은 β-glucosidase 활성을 나타냈으며, Bacteroides와 Bifidobacterium 분포 비율이 높았다고 보고하였다. Kim 등(2015)은 프리바이오틱 식이섬유를 인삼과 함께 섭취한 쥐에서 장내세균의 glycosidase 활성이 증가되고, CK의 흡수율이 식이섬유 섭취량에 따라 유의차 있게 증가하는 것을 확인하였다. 한편, Wan 등(2017)은 성인 남성 여섯 명을 서구형 식사 그룹과 아시아형 식사 그룹으로 분류하고, 미국인삼(Panax quinquefolius L.) 파우더를 7일 동안 2g/day을 경구 투여하고, 혈장에서 GS 대사체를 분석하였다. 여섯 명 모두 혈장에서 고농도의 CK와 소량의 Rb1이 검출되었지만, 서구형 식사 그룹의 CK와 Rb1 농도는 각각 65.7 ng/mL, 5.1 ng/mL로 아시아형 식사 그룹의 CK(47.4 ng/mL)와 Rb1(11.3 ng/mL)과 비교하여 CK는 37.7% 높았고 Rb1은 2.2배 낮은 것으로 나타났다. 이는 인삼 사포닌의 대사에서 주요 작용을 하는 Bacteroides가 동물성 단백질 섭취량이 많은 서구형 식사 그룹에 더 많이 분포하기 때문인 것으로 추정하고 있다.
최근에는 CK가 고농도로 함유된 발효홍삼 섭취에 의해 CK의 흡수율 크게 향상되었다는 연구결과가 보고되었다. Cho 등 (2016)은 성인남성을 대상으로 CK가 농축된 발효홍삼추출물 (Rg1 4.12 mg/g, CK 3.65 mg/g) 또는 홍삼추출물(Rb1 6.88 mg/g, Rg1 1.33 mg/g)을 하루 3g씩 경구투여하고 혈장에서 CK의 농도를 비교한 결과, 발효홍삼을 섭취한 그룹의 최대혈장 농도 평균치가 254.45 ng/mL로 홍삼섭취 그룹(3.18 ng/mL)과 비교하여 약 80배 높았으며, 최대치로 흡수되는 시간도 3.6배 빨랐다고 보고하였다.
유산균 발효 및 효소를 활용한 ginsenoside의 생물전환
GS의 흡수율을 높이고 약리적 효능을 극대화시키기 위한 방안으로 효소처리 또는 미생물 발효를 이용한 생물전환 기술이 활용되고 있다. 인삼사포닌과 같은 천연물의 배당체는 비당부위에 glucose, arabinose, galactose, rhamnose, xylose 등의 당이 β-glucoside 결합으로 존재하므로, 당 결합을 분해할 수 있는 β-glucosidase, β-glycosidase, β-galactosidase, arabanase, lactase, pectinase, hemicellulase, cellulase 등의 효소나 그 효소를 생산하는 미생물을 이용하여 배당체 화합물을 활성 형태의 배당체 또는 무배당체로 전환시켜 약리적 유효성분을 증가시킬 수 있는 연구가 수행되었다. 하지만 생물전환 활성을 갖는다고 보고된 많은 토양균, 곰팡이, 장내세균 등은 식품에 적용 가능한 GRAS 균주가 아니며, glycosidase 활성을 갖는 Aspergillus 속의 곰팡이와 Bifidobacterium 등 혐기성 장내세균은 균의 분리 및 배양조건이 까다롭기 때문에 산업적인 적용이 쉽지 않은 단점이 있다. 따라서 학계와 산업체에서는 식품에 적용 가능한 GRAS 미생물인 유산균과 그 유래 효소를 이용하여 고분자 GS를 저분자 GS로 전환시키기 위한 연구가 활발히 진행되고 있다. 유산균이 생산하는 효소들 중 β-glucosidase는 GS 배당체의 당 부위를 선택적으로 가수분해하는 효소로, 유산균 유래 β-glucosidase로 효소처리 하거나, β-glucosidase 활성이 높은 유산균을 이용하여 고분자 GS를 저분자 GS로 전환시키는 방법이 연구되었다(Table 1, Fig. 2).
| Strains | Transformation pathways | Optimum conditions | References |
|---|---|---|---|
| Lactobacillus brevis LH8 | Rd → F2 → CK | Cell-free enzyme: pH 6.0, 30°C, 72h | Quan et al. (2008) |
| Leuconostoc citreum LH1 | Rb1 → Rd, gypenoside XVII → F2 → CK | Cell-free enzyme: pH 6.0, 30°C, 72h | Quan et al. (2011) |
| Lactobacillus plantarum G1 | Rb1 → Rd | Cell-free enzyme: pH 6.0, 40°C, 120m | Kim et al. (2014) |
| Lactobacillus paralimentarius LH4 | Rb1 → Rd, gypenoside XVII → F2 → CK | Cell-free enzyme: pH 6.0, 30°C, 72h | Quan et al. (2013) |
| Lactobacillus pentosus 6105 | Rb1 → Rd, gypenoside XVII → F2 → CK | Cell-free enzyme: pH 6.0, 37°C, 72h | Kim et al. (2012) |
| Lactobacillus brevis TDK-D57 | Rb1 → Rd → F2 → CK | Fermentation: 30°C, 9~20d | Yi et al. (2012) |
| Lactobacillus helveticus & Pediococcus pentosaceus | Rb1 → Rd → Rg3 → Rh2; Re → Rg1 → Rh1 | Fermentation: 37°C, 7d | Palaniyandi et al. (2018) |
| Leuconostoc mesenteroides YLB8 | Rb1, Rb2 → Rg3; Re → Rg1 | Fermentation: 30°C, 3d | Shim et al. (2014) |
| Lactobacillus plantarum KCCM 11613P | Rb2, Rb3 → Rd | Fermentation: 37°C, 24h | Jung et al. (2019) |
| Leuconostoc mesenteroides WiKim19, Pediococcus pentosaceus WiKim20 | Rb1 → Rg3, Rg5 | Fermentation: 30°C, 7d | Park et al. (2017) |
| Lactobacillus brevis FR-B | Rb1 → Rd, gypenoside XVII → F2 → CK | Fermentation: 30°C, 5d | Yoo et al. (2018) |
| Lactobacillus rhamnosus GG | Rb1 → Rd | Whole-cell biocatalysis: 2% cellobiose, pH 6.0, 40°C, 4d | Ku et al. (2016) |
| Leuconostoc paramesenteroides KFRI 690 | Rb1 → CK | Whole-cell biocatalysis | Park et al. (2012) |
유산균 유래 효소를 이용한 GS의 생물전환은 대부분 β-glucosidase 활성이 높은 Lactobacillus 속과 Leuconostoc 속 균주의 배양액으로부터 균체를 제거하고 얻어진 무세포 효소 (cell-free enzyme)를 이용하였다. Quan 등(2008)은 김치 에서 β-glucosidase 활성이 높은 Lac. brevis LH8을 분리하고, 균주 배양액으로부터 얻어진 조효소(crude enzyme) 처리에 의해 Rd의 전환이 Rd → F2 → CK 순으로 진행되었으며, 효소 처리 72 시간 이후에는 Rd가 대부분 CK로 전환되었다고 보고하였다. Quan 등(2011, 2013)과 Kim 등(2012)은 β-glucosidase 활성이 높은 Leu. citreum, Lac. paralimentarius, Lac. pentosus 유래의 무세포 효소에 의해 Rb1 → gypenoside XVII, Rd → F2 → CK 순으로 GS가 전환되는 것을 확인하였다. 한편, Kim 등(2014)은 Lac. plantarum G1의 배양액으로부터 분리, 정제된 β-glucosidase가 Rb1의 C-20번에 위치한 glucose 1분자만을 선택적으로 가수분해하여 Rb1을 Rd로 100% 전환시켰으나, F2, Rg3, Rh2, CK의 생성은 관찰되지 않았다고 보고하였다. Lactobacillus 속과 Leuconostoc 속 유산균 유래 효소를 이용한 생물전환 연구는 대부분 정제되지 않은 조효소액을 사용하여 수행되었기 때문에 β-glucosidase 이외에 다양한 glycoside 분해효소가 생물전환에 관여하였을 것으로 추정되고 있지만, 이에 대한 연구는 미비한 실정으로, 유산균 유래 glycoside 분해효소에 대한 광범위하고 심도 있는 연구는 인삼 사포닌의 생물전환에 있어 중요한 역할을 할 것으로 판단된다.
유산균 발효를 이용한 생물전환은 유효성분이 증가되고 흡수율이 개선된 고효율의 GS와 더불어 유산균이 생산하는 다양한 생리활성물질을 공급하고, 제품의 관능을 개선할 수 있는 효과가 있으며, 유산균을 whole-cell 촉매제로 활용하는 방법은 효소처리법에 비하여 세포로부터 효소를 얻는데 드는 노동력을 감소시키고, 생산비용 면에서 경제적인 장점이 있어, 학계와 산업체에서 유산균 발효와 whole cell을 활용한 연구가 활발히 수행되고 있다. Park 등(2012)은 Leu. mesenteroides, Leu. paramesenteroides, Lac. delbrueckii 균주의 whole cell을 이용한 생물전환에 의해 Rb1이 CK로 전환되는 것을 확인하였으며, 탄소원으로 2% sucrose가 함유된 배지에서 배양하였을 때 Leu. mesenteroides 균주의 GS 전환율이 98% 향상되었다고 보고하였다. Yi 등(2012)은 Lac. brevis THK-D57 균주를 Rb1, Rc, Rd가 혼합된 MRS 배지에 배양하는 동안 Rb1이 Rd → F2 → CK 순으로 전환되는 것을 확인하였으며, Yoo 등(2018)은 Lac. brevis FB-R 균주를 이용한 인삼 발효에 의해 고함량의 CK가 생성되었다고 보고하였다. Jung 등(2019)은 Lac. plantarum KCCM 11613P 균주로 홍삼추출물을 24시간 발효하였을 때 ginsenoside Rd가 Rb2와 Rb3로 전환되었으며 발효에 의해 홍삼의 항산화 활성이 증가되는 것을 확인하였다.
Park 등(2017)은 김치에서 분리된 유산균을 대상으로 β-glucosidase 활성과 GS의 전환율(Rb1 → Rg3, Rg5)을 측정한 결과, β-glucosidase 활성이 가장 높은 Leu. mesenteroides 균주가 가장 우수한 GS 전환율을 나타내었지만, 산 생성능이 가장 높은 Pediococcus pentosaceus 균주는 β-glucosidase 활성이 결핍되었음에도 비교적 우수한 GS 전환율을 나타내어 β-glucosidase 활성뿐만 아니라, 유기산에 의한 산 가수분해에 의해서도 GS의 전환이 촉진된다고 보고하였다. 포도당의 catabolite repression에 의해 β-glucosidase의 발현이 억제되므로, 포도당이 제한된 배지에 단일 탄소원으로 올리고당 또는 이당류를 첨가하여 β-glucosidase의 활성을 높일 수 있다는 연구 결과가 보고되었다. Ku 등(2016)은 탄소원으로 glucose 대신 2% cellobiose가 함유된 modified MRS 배지에서 Lac. rhamnosus GG 균주의 β-glucosidase 활성이 25배 증가되고, 최적 조건에서 배양된 whole cell을 이용하여 Rb1이 대부분 Rd로 전환되는 것을 확인하였다. 또한 Ku 등(2015)은 2% ascorbic acid가 보충된 MRS 배지에서 Bifidobacterium longum RD47의 α-l-arabinofuranosidase와 α-l-arabinopyranosidase 활성이 증가되고, 동일 조건에서 배양된 whole cell에 의해 Rb와 Rc가 Rd로 전환되었다고 보고하였다.
현재까지 β-glucosidase 활성이 높은 유산균을 활용하여 고분자 GS를 CK 등 저분자 GS로 전환할 수 있다는 것이 여러 연구를 통해 입증이 되었으나, 유산균을 이용한 생물전환만으로는 고농도의 CK를 효율적으로 얻기 어려운 점이 있기 때문에 효모와 혼합배양 하거나 효소처리와 병행하여 CK 함량이 높은 인삼발효제품이 개발되고 있다. 따라서 유산균의 GS 전환능을 높이기 위해서는 생물전환 조건을 최적화 하고 glycoside 분해효소의 활성을 높이는 연구가 필요하다고 판단된다.
결 론
인삼에 다량 함유된 고분자 GS 배당체는 인삼 섭취 후 장관에 존재하는 장내미생물의 효소작용에 의해 배당체에 결합된 당이 유리되어 CK와 같은 소수성의 저분자 GS로 전환되어야 체내로 용이하게 흡수될 수 있다. 인체의 장내미생물은 개인별로 차이가 있기 때문에 동일한 인삼을 섭취하더라도 GS의 흡수율과 약리효과가 다르게 나타날 수 있으므로, GRAS 미생물인 유산균과 그 유래 효소를 이용하여 고분자 GS를 생체 흡수율이 높은 저분자 GS로 전환시키는 연구가 활발히 수행되었다. 유산균을 활용한 GS의 생물전환은 주로 Lactobacillus 속과 Leuconostoc 속 유산균 및 유산균 유래 효소를 이용하여 수행되었으며, β-glucosidase 활성이 높은 균주들이 고분자 GS를 흡수율이 용이한 저분자 GS로 전환시킬 수 있다는 것이 확인되었다. 하지만 GS 배당체의 저분자화 효율을 높이기 위해서는 발효조건을 최적화 하고 glycoside 분해효소의 활성을 높이는 연구를 통해 저분자 배당체의 생산 조건을 확립하는 것이 바람직하다고 판단된다. 현재 β-glucosidase 이외에 유산균 유래 다양한 glycoside 분해효소의 분리, 정제, 작용 기작에 대한 연구는 미흡한 실정으로, 이에 대한 연구는 인삼 사포닌의 생물전환에 있어 중요한 역할을 할 것으로 판단된다. 최근의 보고에 의하면 유산균 대사산물과 사균체도 다양한 생리활성을 발휘하는 것으로 입증되어 프로바이오틱스의 개념이 사균체와 대사산물의 영역까지 확대되고 있으므로, 발효인삼의 제조에 생물전환능이 우수한 유산균을 활용함으로써 안전한 스타터로서의 이용뿐만 아니라, GS 유효성분의 함량 증가 및 흡수율 개선, 유산균의 건강기능성 효과, 관능성 개선 등의 상승효과를 기대할 수 있을 것이다.