서 론
유산균은 주로 젖산과 같은 유기산, bacteriocin, 그 외에도 diacetyl, acetaldehyde, 과산화수소 등의 다양한 항균성 물질을 대사 산물로 합성하여 병원성 균의 증식을 효과적으로 억제할 수 있다(Vandenbergh et al., 1993). 프로바이오틱 유산균은 적정량 섭취 시 숙주에게 장내 미생물 균형, 면역 조절, 항균 및 항암 등의 효과를 주는 살아있는 미생물을 의미한다(Ann et al., 2011; Fuller et al., 1989). 프로바이오틱스는 일반식품, 건강기능식품뿐만 아니라 의약품에도 사용되고 있으며, 소비자들의 관심이 높아지면서 시장의 규모 및 관련 연구가 증가하고 있다(Lim et al., 2015). 또한, 최근에는 이러한 프로바이오틱스뿐 아니라, 대사산물의 항균 활성 기전 및 활용에 관한 연구들이 활발히 이루어지고 있다(Seo et al., 2019).
최근 미생물을 이용한 바이오컨버전 공법을 통해 화학적 구조를 변형시켜 얻은 미생물의 대사산물이 식품, 의약, 농업 등의 다양한 분야에서 활발히 연구되고 있다(Asha and Vidyavathi, 2009; Smitha et al., 2017). 한약재인 감초, 구기자나 오디를 바이오컨버전하여 얻은 추출물을 이용해 항균 및 항염증의 효과를 확인한 논문이 발표되는 등 다양한 연구가 진행되고 있다(Kim et al., 2019; Ryu et al., 2011). 유청(whey)은 치즈 제조과정에서 카제인을 제거한 후에 남은 부산물로, 유가공품의 소비증가로 생산량이 점점 증가하고 있다(He et al., 2016). 따라서 유청의 유당, 단백질 등을 활용한 다양한 식품, 의약품 등의 개발이 이루어지고 있다(Nam et al., 2013). 하지만 유청을 이용한 바이오컨버전에 관한 연구는 미비한 실정이다(Nam et al., 2013).
사람의 장내 서식하는 대표적인 병원성균으로 알려진 Escherichia coli O157:H7와 Listeria monocytogenes는 self-produced polymeric matrix의 군집체인 생물막을 만들어 숙주에게 복통, 설사와 같은 염증성 대장증후군, 장내면역질환 그리고 대장암 등과 같은 다양한 질병을 일으키는 것으로 잘 알려져 있다(Padhye et al., 1992; Pérez-Conesa D et al., 2006). 따라서 본 연구는 4가지 프로바이오틱 유산균을 이용해 유청 바이오컨버전 시료를 제조하고, 병원성 세균에 항균 및 생물막 억제 효과를 확인하고자 한다.
재료 및 방법
본 실험에서는 유산균으로 양배추 피클에서 분리한 Lactobacillus plantarum KCTC 10887BP, 사람의 대변에서 분리한 L. rhamnosus GG, 동치미에서 분리한 L. brevis DF01, 가자미 식해에서 분리한 Enterococcus faecium DB01을 이용하였다. 사용한 유산균은 de Man, Rogosa and Sharpe(MRS, Neogen, USA)에 37℃, 24시간 배양하여 사용하였다. 실험에 사용한 병원균 E. coli O157:H7은 Luria-Bertani(LB, LPS solution, Korea), L. monocytogenes KCTC 3569은 Brain Heart Infusion(BHI, Becton, Dickinson and Company, USA)에 37℃에서 24시간 동안 배양하였다.
유청 배지를 제조하기 위해 유청 분말 20 g을 멸균처리한 3차 증류수 200 mL에 10%(w/v) 농도로 넣은 후 균질화 한다. 이후 80℃에서 3분 살균하고, 유산균 배양액을 각각 1%(v/v)로 접종한 후, 37℃에서 24시간 배양하였다. 바이오컨버전된 유청을 7,600 ×g로 20℃에서 10분동안 원심분리 후, 상등액의 pH를 1N NaOH를 사용하여 6.5로 조정하였다. 마지막으로 0.45 μm, 0.20 μm syringe filter(Samchun Chemical Co., Korea)로 차례대로 여과 후 –80℃에 보관하여 사용했다. 이후 각 시료의 단백질 농도를 일정하게 맞추기 위해 PierceTM BCA protein assay kit(Thermo scientific, USA)를 사용하여 BCA assay를 수행하였다. 이와 같은 방법으로 유산균에 의해 제조된 유청 바이오컨버전 산물 시료를 L. plantarum(LP-W), L. rhamnosus GG(LR-W), L. brevis DF01(LB-W) 그리고 E. faecium DB01(EF-W)로 표기하였다.
E. coli O157:H7와 L. monocytogenes를 1×107 CFU/mL로 맞춘 배양액 100 μL와 시료(0, 0.5, 1, 2 mg/mL) 100 μL를 96-well plate에 동시처리한 뒤 37℃에서 24시간 배양하였다. 또한, 동일한 배양액을 다른 96-well plate에 37℃에서 24시간 배양한 후 형성된 생물막에 시료(0, 0.5, 1, 2 mg/mL) 100 μL를 처리하고, 37℃에서 24시간 배양하였다. 이후 phosphate buffer saline(PBS) 200 μL로 세척하고, 0.1% crystal violet 용액 200 μL를 넣어 암실조건에서 30분간 염색한 후 PBS 세척과정을 거쳐 염색된 생물막을 얻어냈다. 이를 용해용액(ethanol 95%, 멸균처리한 3차 증류수 4.9%, acetic acid 0.1%)으로 용해시킨 후 이를 microtiter plate reader(AMR-100, Allsheng, China)로 595 nm에서 흡광도를 측정하였다.
결 과
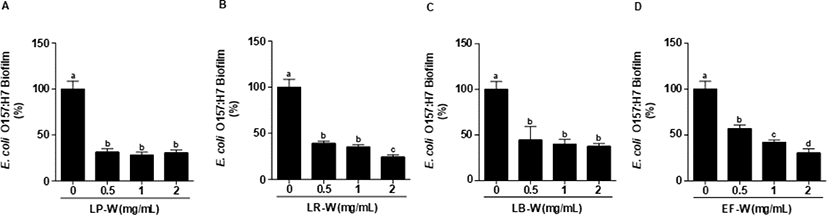
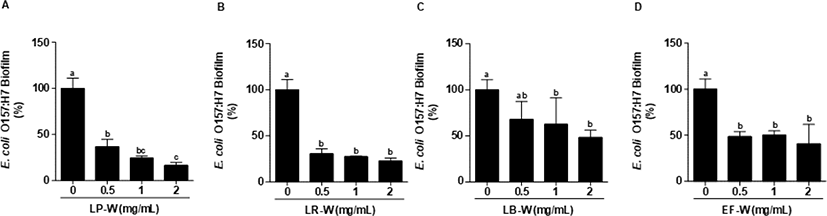
Fig. 1은 E. coli O157:H7에 4종의 유산균에 의해 바이오컨버전 된 유청을 농도별로 동시에 처리하여 24시간 배양한 뒤 염색하여 595 nm에서 흡광도를 측정한 결과이다. E. coli O157:H7에 0.5, 1, 2 mg/mL의 유청 바이오컨버전 시료를 처리한 결과, LP-W (Fig. 1A), LR-W(Fig. 1B), LB-W(Fig. 1C), EF-W(Fig. 1D) 처리 모두 유의적으로 강한 E. coli O157:H7 생물막 억제 효과를 확인하였다(p<0.05). 특히, LP-W(2 mg/mL)는 69%, LR-W(2 mg/mL)는 76%, LB-W(2 mg/mL)는 62% 그리고 EF-W(2 mg/mL)는 69%의 억제능을 확인하였다. Fig. 2는 E. coli O157:H7을 24시간 배양하여 형성된 생물막에 유청 바이오컨버전 산물(0.5, 1, 2 mg/mL)을 처리한 후, 추가적으로 24시간 배양한 뒤 염색하여 595 nm에서 흡광도를 측정한 결과이다. 처리된 모든 농도(0.5, 1, 2 mg/mL)의 LP-W(Fig. 2A), LR-W(Fig. 2B), LB-W(Fig. 2C), EF-W(Fig. 2D)에서 E. coli O157:H7의 생물막이 유의적인 수준에서 제거됨을 확인하였다. 특히, E. coli O157:H7의 생물막에 2 mg/mL 시료를 처리한 결과, LP-W에서 83%, LR-W에서 77%, LB-W에서 52%, EF-W에서 59%의 이미 형성된 생물막에 대한 강한 제거 효과가 있음을 확인하였다.
L. monocytogenes에 유산균을 이용한 유청 바이오컨버전 산물(0.5, 1, 2 mg/mL)을 처리하여 L. monocytogenes의 생물막 형성 억제를 측정하였다. 처리된 모든 농도에서 유청 바이오컨버전 산물은 유의적으로 L. monocytogenes의 생물막을 강하게 억제하였으며(p<0.05), 특히 2 mg/mL의 LP-W에서 88%, LR-W에서 89%, LB-W에서 86%, EF-W에서 88%의 생물막 형성 억제 효과를 확인하였다(Fig. 3). L. monocytogenes를 24시간 배양한 다음, 생물막을 형성한 다음에 LP-W, LR-W, LB-W, EF-W를 농도 별(0.5, 1, 2 mg/mL)로 24시간 처리한 다음 생물막의 제거를 확인하였다(Fig. 4). LP-W(1, 2 mg/mL)에서는 유의적으로 L. monocytogenes 생물막이 제거되었지만, 0.5 mg/mL에서는 제거되지 못하였다(Fig. 4A). LR-W(0.5 mg/mL)에서는 유의적으로 생물막이 제거되었지만 E. coli O157:H7처럼 강하게 억제되지 못하였으나, LR-W 1 mg/mL와 2 mg/mL에서는 강하게 제거되었다(Fig. 4B). LB-W 또한 1 mg/mL와 2 mg/mL에서 유의적으로 L. monocytogenes 생물막이 제거되었지만(Fig. 4C), EF-W 2 mg/mL를 처리에서는 유의적인 제거 효과가 있었지만, E. coli O157:H7과 달리 약하게 억제됨을 확인하였다(Fig. 4D).
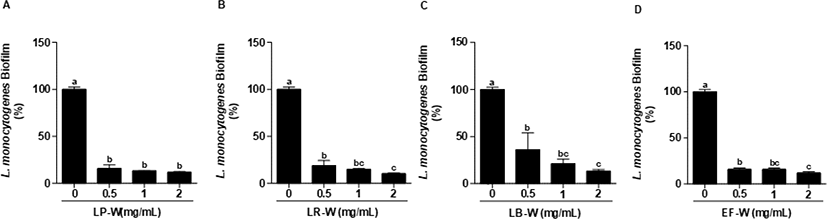
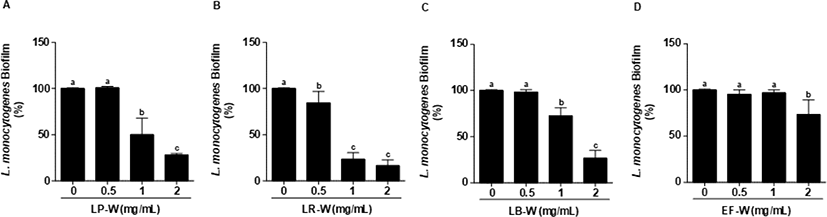
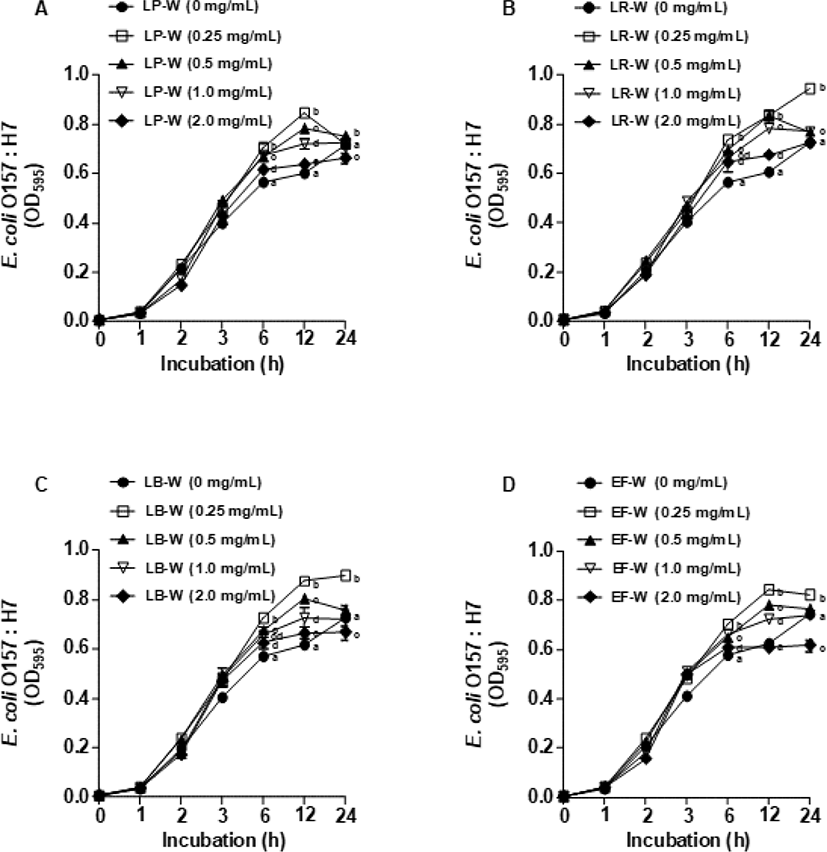
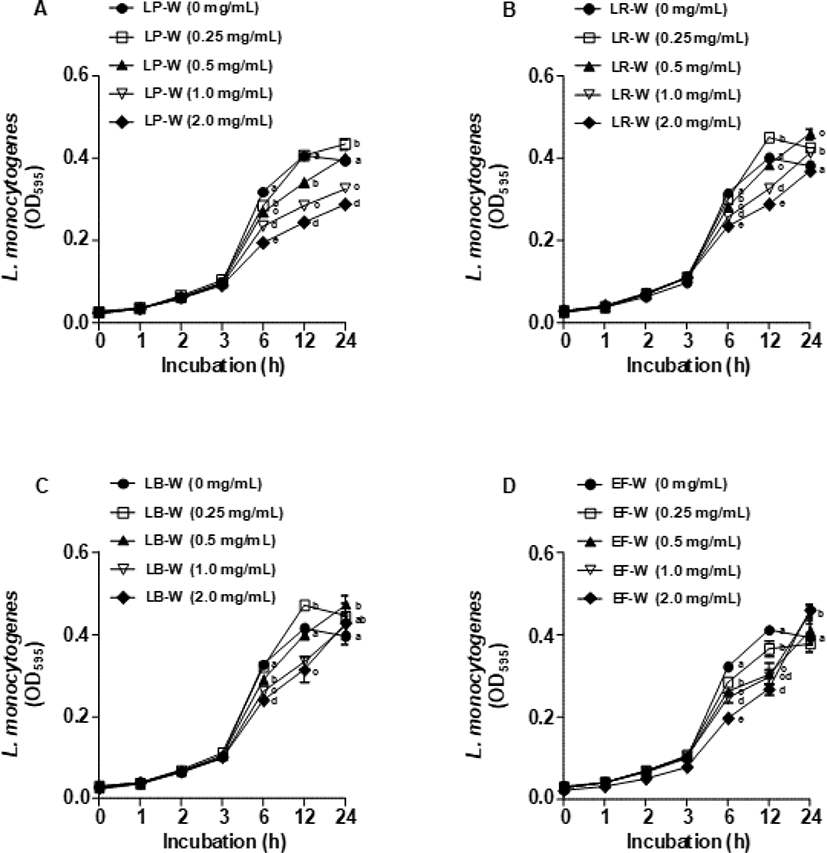
Fig. 5는 유청 바이오컨버전 산물을 E. coli O157:H7에 처리한 뒤 1, 2, 3, 6, 12, 24시간 동안 배양 후 595 nm에서 흡광도를 측정하여 E. coli O157:H7의 생장 억제 효과를 확인한 결과이다. LP-W(Fig. 5A), LR-W(Fig. 5B), LB-W(Fig. 5C), EF-W(Fig. 5D)를 농도별(0.25, 0.5, 1, 2 mg/mL)로 처리하여 E. coli O157:H7의 생장 억제를 분석한 결과, 모든 유청 바이오컨버전 산물에서 E. coli O157:H7의 생장 억제가 대조군과 비교하였을 때 유의적으로 감소되지 않았다. 이와 유사하게 유청 바이오컨버전 산물을 L. monocytogenes에 처리한 뒤 동일한 시간대에 595 nm에서 흡광도를 측정한 결과(Fig. 6), E. coli O157:H7과 비슷하게 LP-W(Fig. 6A), LR-W(Fig. 6B), LB-W(Fig. 6C), EF-W(Fig. 6D)의 농도별 처리에 의해 L. monocytogenes의 생장 억제가 관찰되지 않았다.
고 찰
L. plantarum, L. rhamnosus GG, L. brevis DF01, E. faecium DB01 4종의 유산균을 이용하여 바이오컨버전한 유청을 E. coli O157:H7, L. monocytogenes와 동시에 처리하여 배양한 결과(Fig. 1, Fig. 2), 모든 시료에서 생물막 형성이 억제되었다. 생물막의 억제는 크게 두 가지 요인에 의해 나타나는데, 세균의 생장을 억제하면서 생물막의 형성을 저해하거나, 세균의 생물막 구조물 형성을 억제하는 것이다(Herald et al., 1988; Marsh et al., 2003; Roy et al., 2018). 본 연구의 생장 억제 곡선 결과에서(Fig. 5, Fig. 6) 균 생장 억제 효과는 나타나지 않았다. 위 결과들을 통해 바이오컨버전 된 유청의 생물막 억제는 균 생장 억제가 아닌 생물막의 구조물 형성을 억제한 결과라고 생각된다. 추가적으로, E. faecium DB01을 제외한 나머지 유산균이 유청을 이용하여 성숙한 생물막의 구조를 깨뜨리는 유효물질을 생성한 것으로 판단된다(Fig. 3, Fig. 4). 세균 군집과 extracellular polymeric matrix 등으로 구성된 생물막의 구조를 이루기 위해서는 정족수 감지, 세포 간의 연결 등이 필요한데, 이러한 과정이 바이오컨버전 시료에 의해 억제되었을 것이라 판단된다(Irie et al., 2005; Kang, 2009; Valle et al., 2006).
현재 유산균의 생물막 억제 능력 및 바이오컨버전을 이용한 여러 유효 물질에 대한 연구는 활발히 진행되고 있다. 한약재인 연교 추출물을 Lactobacillus 속의 유산균을 이용하여 바이오컨버전한 결과, 항산화 활성 및 항염증 기능이 증가하였으며, 오디 추출물의 바이오컨버전 산물은 Salmonella에 대해 뚜렷한 항균 및 항생물막 효과를 나타내었다(Yang and Choe, 2011). 또한 oleuropein을 L. pentosus,L. brevis, Pediococcus pentosaceus를 이용하여 바이오컨버전한 결과, 항균 작용이 개선되었다(Lee and Paik, 2017). 최근 치즈의 부산물인 유청에 대한 이용 관심이 증가하고 있으며, 이에 따라 유청을 이용한 다양한 제품이 개발되고 있다. 또한 유청에 존재하는 기능성 펩타이드의 항균 효과에 대한 여러 연구가 진행되고 있으며, 상추에 유산균을 통해 바이오컨버전한 유청 시료를 처리하여 우수한 항균효과를 관찰한 연구결과가 있다(Atanasova and Ivanova, 2010; Osman et al., 2016; Santos et al., 2015). 그러나 유청의 바이오컨버전 유효산물을 이용한 병원균 생물막 억제에 관한 연구는 아직 미흡한 것이 실정이다. 본 연구는 치즈의 부산물인 유청의 활용성을 확보하는 동시에, 유산균의 대사산물을 이용한 기능성 식품 및 의약품 연구에 초석이 될 것이라 사료된다.







