서 론
양돈 산업에서 항생제는 질병예방과 생산성 증진을 위하여 배합사료 내에 첨가되어 많이 사용되었다. 이러한 항생제의 사용은 항생제 내성 병원성 균의 발생이나 최종 생산품에서의 항생제 잔류 등과 같은 문제점으로 인하여 전 세계적으로 가축 생산에서의 항생제의 사용을 규제하기 시작하였다 (Hazards et al., 2017). 한국에서도 1997년 항생제 사용 규제를 시작하여, 현재 모든 사료에 항생제 사용이 전면 금지되었다 (Do et al., 2020). 이러한 변화는 사료효율 감소와 폐사율이 증가 및 동물용 의약품의 사용이 증가함에 따라 경제적 손실의 우려되고 있다(Hayes et al., 2002). 이러한 문제점을 해결하고, 양돈 산업의 경쟁력을 확보하기 위하여 항생제를 대체할 수 있는 천연 대체재들이 연구되고 있다.
항생제 천연 대체재 중 생균제(probiotics)는 살아있는 미생물로 급여 시 가축에게 긍정적인 영향을 미치는 보조 사료 또는 사료첨가제를 말한다(AFRC 1989). 일반적으로 상업적으로 이용되는 생균제는 Bacillus, 효모 그리고 젖산을 생산하는 Lactobacillus, Bifidobacterium, Enterococcus 등이다(Heo et al., 2013). 양돈 산업에서의 생균제를 사용하는 것은 건강한 장내 미생물 균총을 형성하여 동물의 건강과 생산성을 개선하는 것을 목표로 한다 (Kenny et al., 2011). 특히, 현재 일반적인 사육 방식인 집약적 돼지 사육 방식은 돼지에게 심리적, 생리적 스트레스를 유발하여 장내 미생물 균총의 불균형을 야기하고, 장 장벽의 기능 장애를 유발하여 생산성을 저하시킬 수 있다(Moeser et al., 2007). 생균제의 급여는 돼지의 장내 미생물 균총을 변화시킴으로써 성장률 및 사료 효율 등 증가시키고 (Min and Kim, 2002), 이유자돈에서는 장 발달을 촉진하여 장 건강에 이로운 영향을 주어 가축 생산성을 증대시켜준다(Shin et al., 2019). 뿐만 아니라, 생균제의 급여로 인하여 돼지고기의 품질을 개선할 수 있다(Chang et al., 2018). 최근에는 환경오염 양돈 산업에서 발생하는 악취와 유해가스를 생균제를 이용하여 저감화하는 연구도 진행되고 있다(Lan et al., 2016).
하지만 생균제의 인기가 점점 증가하면서 생균제에 대한 정확한 과학적 연구와 올바른 적용 방법에 대한 확립없이 상업적인 이득을 위해서 무분별하게 사용되고 있다. 그 이후로, 생균제의 균주 선택과 사용은 지식 기반의 사용보다는 경험에 기반해 사용되어 왔는데, 이러한 생균제의 사용은 균주에 대한 특성화가 부족할 뿐만 아니라, 농장에서 사용될 때 일관성 없는 결과를 불러올 수 있다(Bosi and Trevisi, 2010). 따라서 오늘날의 돼지 생산에 생균제의 적용은 명확한 과학적 근거에 기반한 연구가 필요한 시점이다. 따라서 본 연구는 multi-strain 생균제(MSP)에 대한 각 균주의 특성을 확인하고, 자가배양시스템(self-cultivation system)을 통한 MSP 배양의 경제성과 효율성을 확인하였으며, MSP의 적용으로 인한 돼지 장내 미생물 균총의 변화를 조사하고자 하였다.
재료 및 방법
본 연구에서 multi-strain probiotics에 사용된 Lactobacillus 4 종(Lactobacillus acidophilus LA14, Lactobacillussalivarious 167, Lactobacillusplantarum LP11, Lactobacillus fermentum 216)은 모두 이유 자돈의 분변에서 분리되었다. 먼저 10 g의 분변을 0.85% NaCl solution과 1:9(w/v, v/v)의 비율로 섞어준 뒤, homogenizer(JumboMix, Interscience, Saint Nom, France)를 사용하여 2분 동안 균질화 하였다. 혼합액 일부를 취하여 생리식염수(0.85% NaCl)를 사용하여 연속 희석한 뒤, de Man, Rogosa and Sarpe(MRS; Sigma-Adlrich, MO, St Louis, USA) agar에 0.005% bromocresol purple(Sigma-Aldrich)와 0.05% L-cysteine(MRS-BCP; Sigma-Aldrich)를 첨가한 MRS-BCP agar plate에 희석액을 100 μL씩 분주하여 도포한 뒤 37℃에 48시간동안 배양하였다. 배양 후 주변에 노란색 환을 보이는 colony들을 무작위로 선별하여, 다시 한번 MRS agar plate에 streaking하여 단일 colony임을 확인하였다. 분리한 균주들은 10% skim milk(KisanBio, Seoul, Korea) 를 이용하여 –80℃에서 보관하였으며, 16S rRNA sequencing을 통해 균주를 동정하였다.
내산성과 내담즙성에 대한 유산균의 저항성은 Jacobsen et al. (1999)의 방법에서 약간 수정하여 진행되었다. 내산성을 실험하기 위해 산성화된 MRS broth(pH 2.5)에 pepsin(Sigma-Aldrich)를 1,000 unit/mL가 되도록 첨가하여 인공 위액을 조성하였다. 내담즙성 실험을 진행하기 위해 MRS broth에 0.5% oxgall(Sigma-Aldrich)를 첨가하여 체내에서 분비되는 담즙산과 유사한 환경을 제조하였다. 산성과 담즙산에 대한 저항성을 확인하기 위해 내산성은 접종 후 37℃에서 3시간 배양한 후 생존율을 측정하였으며, 내담즙성을 확인하기 위해 접종 후 37℃에서 24시간 배양한 후 SpectraMax ABS plus(Molecular Device, San Jose, CA, USA)을 이용해 OD600에서 값을 측정하였다.
병원성 균에 대한 유산균의 저항성을 over-lay 방법을 통해 측정하였다(Balouiri et al., 2016). 먼저 돼지에게 가장 대표적인 병원성 균(Listeria monocytogenes EDG-e, Staphylococcus aureus Newman, Salmonella typhimurium SL1344, Escherichia coli EDL933)을 이용하여 실험을 진행하였다. S. aureus Newman, S. typhimurium SL1344, E. coli EDL933은 BDä Tryptic Soy Broth(TSB; Fisher scientific, Hampton, NH, USA)에 37℃에서 24시간 동안 배양하였고, L. monocytogenes EDG-e는 Bacto™ Brain Heart Infusion broth(BHI; Fisher scientific)를 이용하여 30℃에서 24시간 동안 배양하였다. Overnight 배양된 유산균 배양액 10 μL를 MRS agar plate에 떨어트린 후 37℃에서 24시간 동안 배양하였다. 배양한 유산균 위에 각각의 0.8% agar와 24시간 동안 배양한 indicator 병원성 균 배양액이 함유된 TSB agar와 BHI agar를 도포해준 후 이전의 병원성 균의 배양 온도와 시간에 맞게 배양하였다. 최종적으로 항균 활성 능력은 주변에 생기는 투명한 환의 지름을 측정하여 평가하였다.
항생제 내성에 대한 측정은 disc method법으로 평가하였다. 먼저 37℃에서 24시간 동안 배양한 유산균 배양액을 MRS agar plate에 100 μL를 분주한 후 도포하였다. 도포 후 BD BBL™ Sensi-Disc™ antimicrobial susceptibility test discs(ampicillin, chloramphenicol, penicillin, tetramycin 등 총 4종; Fisher scientific)을 plate에 올려준 후 37℃에서 24시간 동안 배양하였다. 항생제에 대한 내성은 disc 주변에 생기는 투명한 환의 지름을 측정하여 평가하였다.
C. elegans 를 이용한 유산균의 부착능 실험에는 CF512 fer-15 (b26)II;fem-1(hc17)IV가 사용되었다. C. elegans는 E. coli OP50이 접종된 nematode growth medium(NGM) agar plate에서 주기적으로 배양되고 유지하였으며, 모든 C. elegans는 25℃에서 배양하였다(Brenner, 1974). 또한, C. elegans 의 장에서의 bacterial colonization을 확인하기 위해, 이전에 기술된 방법에 약간의 수정을 가하여 C. elegans 장의bacteria 수를 측정하였다(Aballay et al., 2000). 먼저, overnight 배양한 유산균를 원심 분리를 이용해 농축한 뒤 M9 buffer(1 L of dH2O; 3 g of KH2PO4, 6 g of Na2HPO4, 5 g of NaCl; autoclave 후 1 mL of 1 M MgSO4 첨가)를 이용하여 배양액을 5회 세척해준 뒤 NGM agar plate(nystatin 5 μg/mL) 중앙에 200 μL 분주하여 건조시켰다. 유산균이 분주된 NGM agar plate에 C. elegans를 처리한 후 5일 동안 배양시킨 후 10마리의 C. elegans를 무작위로 선별한 뒤 M9 buffer로 2회 세척하였다. 세척이 완료된 C. elegans를 kanamycin(100 μg/mL)과 streptomycin(100 μg/mL)이 포함된 BHI agar plate에 옮겨준 뒤 gentamicin solution(25 μg/ mL)에 5분간 노출시켜 주었으며, 본 실험에서의 결과 비교를 위한 positive control 균으로 Lactobacillus rhamnosus GG가 사용되었다. C. elegans는 M9 buffer에 5회 세척된 후 M9 buffer(1% Triton X-100)가 담겨있는 1.5 mL Eppendorf tube로 옮겨진 후 pestle(Kontes, Vineland, NJ, USA)을 사용하여 기계적인 힘으로 분쇄되었다. 분쇄된 C. elegans solution은 연속 희석한 뒤 pH 5.0으로 조정된 MRS agar에 도포하여 37℃에 48시간 동안 배양한 뒤 colony counting을 실시하였다.
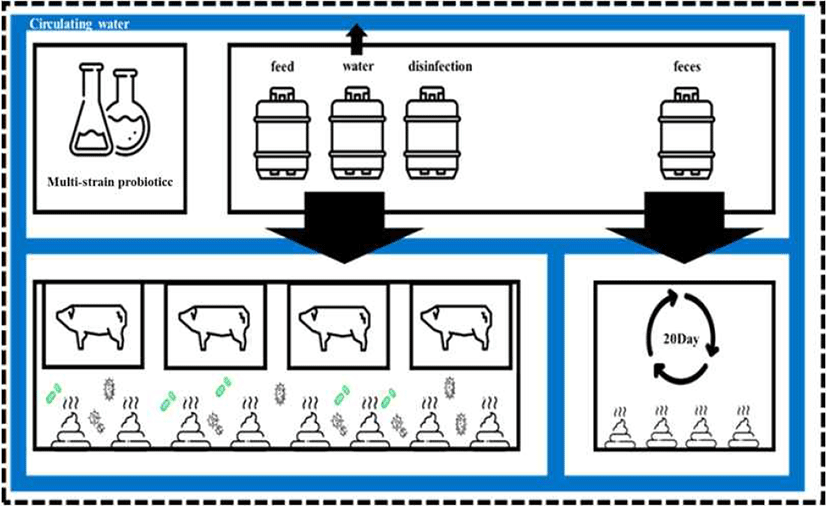
실험실에서 1차적으로 선발되어 혼합 배양된 4종의 Lactobacillus는 이후 농장에서 자가 배양 시스템을 통해 농장 자체적으로 2차 배양된 후 자돈사료에 0.5% 첨가되어 각 유형별(고형, 음수형, 건조 사료)로 돼지에게 공급되었으며, 건조형 사료는 50℃에서 교반하며 수분량 12% 이하로 제조되었다(Fig. 1). MSP의 적절하고 효과적인 공급을 지속적으로 확인하고 관리하기 위해 농장에 급여되고 있는 여러 사료는 각 유형별(고형, 음수형, 건조 사료)로 채취되어 실험실 내에서 주기적으로 모니터링하였다. 각각의 사료는 50 mL conical tube에 채취되었고, 채취 당일 분석을 진행하였으며, sample당 3반복으로 분석은 진행되었다. 발효 사료(고형, 건조형)는 생리식염수에 1:9(W/V, V/V) 비율로 섞어준 뒤 homogenizer를 사용하여 2분 동안 고르게 균질화시켜 주었다. 균질화된 solution은 연속 희석을 한 후 MRS agar plate에 100 μL 분주하여 도포한 후 37℃에 48시간 동안 배양하였다.
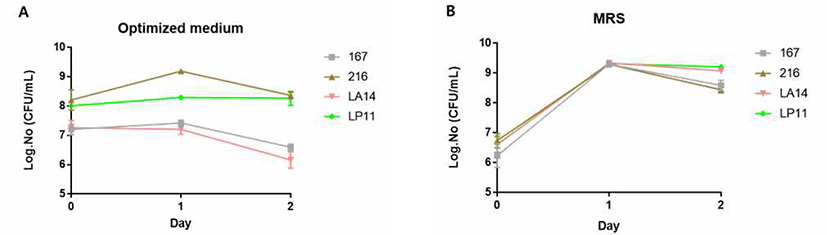
농장 자체 배양을 위한 경제 배지의 경제성 및 효율성 측정을 위해 실험실에서 Lactobacillus 종의 배양을 위해 일반적으로 사용되는 MRS배지와 비교분석을 하였다. 경제 배지는 molasses 1%, glucose 1%, yeast extract 0.2%, salt 0.2%로 조성되었으며, 48시간동안 배양된 4종의 Lactobacillus를 MRS 배지와 경제 배지에 각각 1%씩 접종한 후 37℃에서 48시간 동안 배양하며, 24시간 단위로 균 수를 측정했다. 균 수 분석은 각각의 solution을 연속 희석한 뒤 MRS agar plate에 100 μL 분주하여 도포한 뒤 37℃에서 48시간동안 배양하여 분석하였다.
MSP급여 농장과 일반 농장의 돼지 장내 microbiota의 microbial population을 비교 분석하기 위해 모돈과 자돈의 분변을 채취하여 분석하였다. 각각의 분변은 직장 자극을 통해 나오는 분변을 sample bag(19×30 cm, 3M, St, Paul, MN, USA)을 이용하여 채취하였으며, 채취된 샘플은 채취 당일 분석하였다. 채취된 분변 25 g과 225 mL의 생리식염수를 섞어준 뒤 homogenizer를 사용하여 2분간 강력하게 균질화한 뒤, 연속 희석하였다. Aerobic bacteria는 AC petrifilm(Aerobic count plate, 3M, St, Paul, MN, USA)에 1mL 분주한 뒤 37℃에서 48시간 배양하여 colony counting해 주었다. Yeast는 YM petrifilm(Yeast & Mold count plate, 3M, St, Paul, MN, USA)에 1 mL 분주한 뒤 25℃에서 72시간동안 배양한 뒤 colony counting하였다. Lactobacillus는 Acid-MRS(pH 4.5) agar plate에 도말하여 37℃에서 48시간 동안 배양한 뒤 counting 하여 CFU를 측정하였으며 Bifidobacterium은 Bifidobacterium Selective(BS; KisanBio) agar plate에 도말하여 37℃에 72시간 동안 배양하여 colony counting하였다. 또한 Coliform 분석은 BD Difco™ Dehydrated Culture Media: Violet Red Bile Agar(Fisher scientific, Hampton, NH, USA)을 이용하여 35℃에서 48시간동안 배양한 뒤 colony counting하였다.
결 과
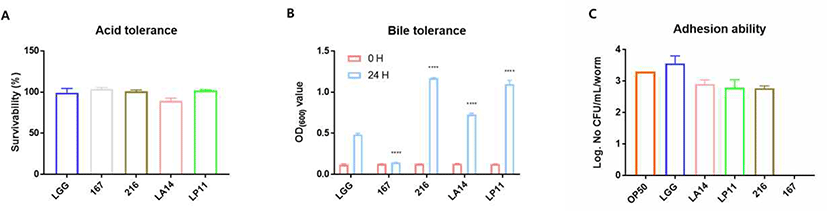
생균제가 체내에서 그 기능을 원활히 발휘하기 위해서는 1차적으로 체내에 급여된 생균제가 소화기관을 통과하는 동안 사멸하지 않고 장관에 도달해야 한다(Fuller, 2012). 본 연구에서는 선발된 MSP 균주가 소화기관을 통과하여 생존할 수 있는 균주를 평가하기 위하여 내산성 및 내담즙성을 평가하였다(Fig. 2). 위산에 대한 생존력을 측정하기 위한 pH 저항성 실험에서 L. rhamnosus GG는 약 100%의 생존율을 보였으며, L. acidophilus LA14를 제외한 나머지 3개의 균주가 L. rhamnosus GG와 비슷한 생존율을 보였다. 다음으로, 담낭에서 분비되는 담즙산에 대한 저항성을 측정하기 위한 담즙산 저항성 실험에서 L. salivarius 167만이 L. rhamnosus GG보다 담즙산 저항성이 낮게 나타났으며, 나머지 3종은 L. rhamnosus GG보다 높은 담즙산 저항성을 나타내었다. 다음으로 장관에서의 부착 능력을 평가하기 위한C. elegans 장관 부착능 실험에서 L. salivarius 167을 제외한 나머지 3종의 균주가 C. elegans의 장관에 colonization 하는 것을 확인하였다(Fig. 2C). 따라서 위 실험의 결과로서 MSP에 사용되는 유산균들이 체내에 급여되었을 때 소화액에 대한 저항성을 가진 후 최종적으로 장에 도달하고, 장에서 효율적으로 군집화하는 것으로 판단된다.
생균제 급여는 병원성 균이 장내 mucosa에 부착하는 것을 막거나, 병원성 균의 성장을 저해시켜 체내 병원성 균 감염을 막아준다는 이전 연구들의 보고가 있다(Roussel et al., 2017). In vitro 실험에서 B. lactis Bb12와 L. rhamnosus GG는 단독으로 또는 혼합하여 돼지에게 급여되었을 때 Salmonella, Clostridium, E. coli가 장내 mucosa에 부착되는 것을 방해하였다는 보고가 있었다(Collado et al., 2007). 본 연구에서 MSP의 특성을 분석하기 위해 돼지 산업에서 가장 감염이 많이 되는 병원성 균 4종에 대한 MSP의 항균 활성 능력을 분석하였다. L. rhamnosus GG와 비교해 보았을 때 Listeria monocytogenes EDG-e, Staphylococcus aureus Newman, Salmonella typhimurium SL1344, Escherichia coli EDL933에 대한 4종의 생균제의 항균 활성 능력이 비슷한 수준을 보였으며, 특히 L. acidophilus LA14 는 E. coli O157:H7에 대한 항균 활성 능력이 더 높은 것으로 확인되었다(Fig. 3A).
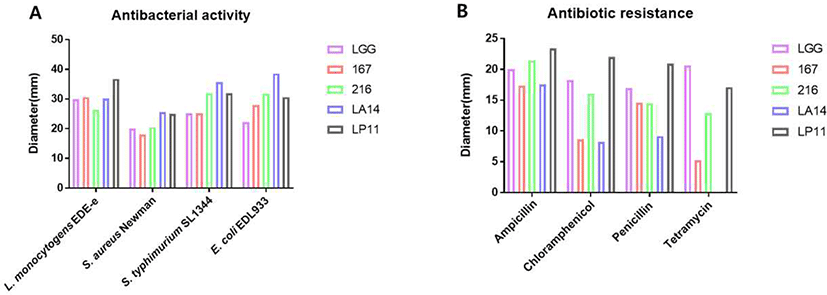
돼지 산업에서 항생제에 대한 저항성을 가진 bacteria는 매우 위험한 요소로 인식되고 있다(Austin et al., 1997). MSP가 아무리 좋은 기능을 가지고 있고, 체내에 긍정적인 효과를 발휘한다고 하더라도 항생제에 대한 저항성을 가지고 있다는 사실은 다른 의미로 위험할 수 있다(Park, 2003). 따라서 본 연구에서 항생제에 대한 MSP의 저항성을 4종의 항생제로 확인하였다. L. rhamnosus GG 와 비교해 보았을 때 L. salivarius 167과 L. acidophilus LA14의 경우 L. rhamnosus GG에 비하여 다소 저항성이 높은 것으로 나타났으나, L. fermentum 216과 L. plantarum LP11은 L. rhamnosus GG와 비슷한 수준을 보이는 것을 확인하였다(Fig. 3B). 따라서 MSP를 사료에 첨가하여 급여하였을 경우, 항생제에 대한 저항성이 낮은 것을 확인하여 이에 대한 위험성은 다소 낮을 것으로 판단되었다.
최근 생균제의 급여가 돼지의 면역력을 증진시켜 결과적으로 돼지의 생산성을 증가시킨다는 많은 연구들이 보고되고 있다(Kim et al., 2015; Yang et al., 2015). 이에 따라, 양돈 산업에서도 이러한 생균제를 농가에 적용하려는 움직임이 보이고 있으나, 생균제에 대한 명확한 이해없이 급여하는 방법으로는 생균제의 급여를 통한 효율적이고 경제적인 효과를 가져올 수 없다는 연구들도 보고되고 있다(Bosi and Trevisi, 2010; Li et al., 2012). 따라서 본 실험에서는 MSP의 효과적이고 효율적인 배양과 급여를 위해서 농장 자가배양시스템을 통해 MSP를 농장 자체적으로 배양 및 급여할 수 있는 시스템을 설계하였다(Fig. 1).
농장에서 자체적으로 생균제를 배양하기 위해서는 배양에 사용될 배지의 경제성과 효율성이 중요하다. 따라서 본 연구에서는 농장 자가배양시스템에서 MSP 배양에 사용할 최적 경제 배지를 개발했으며, 일반적으로 Lactobacillus의 배양에 사용되는 MRS 배지와의 비교를 통해 효율성과 경제성을 확인하였다(Fig. 4). 최적 경제배지에서 L. fermentum 216을 제외한 나머지 3종의 Lactobacillus는 MRS 배지와 비교하여 성장이 비교적 감소하는 경향을 보였다. 하지만 L. plantarum LP11 균은 감소한 성장에도 1×108 CFU/mL 이상의 성장을 보이고 있어, 농장에서 생균제를 자체 배양하기 위한 배지로의 경제성과 균 성장 효율성을 고려할 때 적합하다고 사료된다.
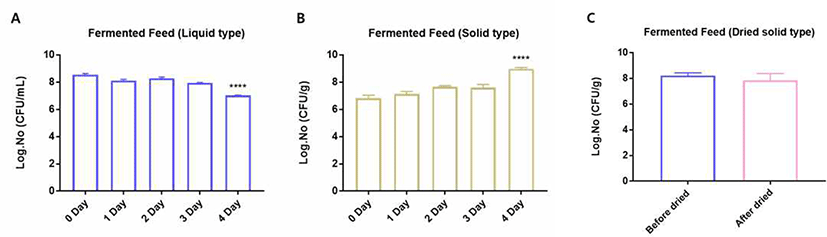
돼지에게 급여되는 사료에서의 균의 함량은 생균제가 체내에서 제대로 기능을 하는데 있어서 중요한 요소이다(Bosi and Trevisi, 2010). 본 실험에서는 농장 자가배양시스템을 통해 배양된 생균제를 각 유형별 사료에 적용하여 발효하였을 때 각각의 생균제의 균 수를 측정하였다(Fig. 5). 음수에 첨가되어 급여되는 fermented feed에서 발효 1일차에는 5×108 CFU/mL의 생균제의 균 수를 보였지만, 함량이 점점 감소하여 발효 4일차에는 1×107 CFU/mL의 함량을 보였다. 고형 사료에서의 생균제의 균 수는 발효 1일차 약 8×106 CFU/mL이었다가 점차 증가하여 발효 4일차에서는 약 9×108 CFU/mL까지 크게 증가하는 경향을 보였다. 이러한 고형 fermented feed에서의 생균제의 성장률은 Lactobacillus로 인한 생균제의 효과를 극대화 할 수 있을 것으로 기대된다(Kenny et al., 2011). 또한, 농장에서 생균제를 급여하는데 있어서 일반적으로 장기간 사료 보관이 가능해야 한다. 이를 위해서 fermented feed를 건조시켜 수분함량을 12% 이하로 낮췄을 경우 생균제의 균 수를 측정하여, 농장에서도 장기간 보관이 가능하면서도 그 기능의 정상적으로 유지될 수 있는지를 확인하였다. 그 결과, 건조 전과 후 fermented feed의 생균제의 균 수는 두 경우 모두 약 1×108 CFU/mL로 건조과정을 거쳐도 생균제의 균 수에는 유의적인 차이를 보이지 않았다. 결과적으로, MSP를 첨가하여 배양한 fermented feed는 발효가 진행되는 동안 1×107 CFU/mL 이상의 생균제 균 수를 유지하였으며, 특히 고형 fermented feed에서는 1×109 CFU/mL 이상의 높은 함량을 나타내어 고농도의 생균제를 돼지에게 급여할 수 있는 가능성을 제시하였다. 또한 장기간 보관을 위한 건조과정에서도 생균제의 균 수의 감소를 보이지 않아, 농장에서 고농도의 생균제를 장기간 보관하며 급여할 수 있는 가능성을 제시한 것으로 판단되었다.
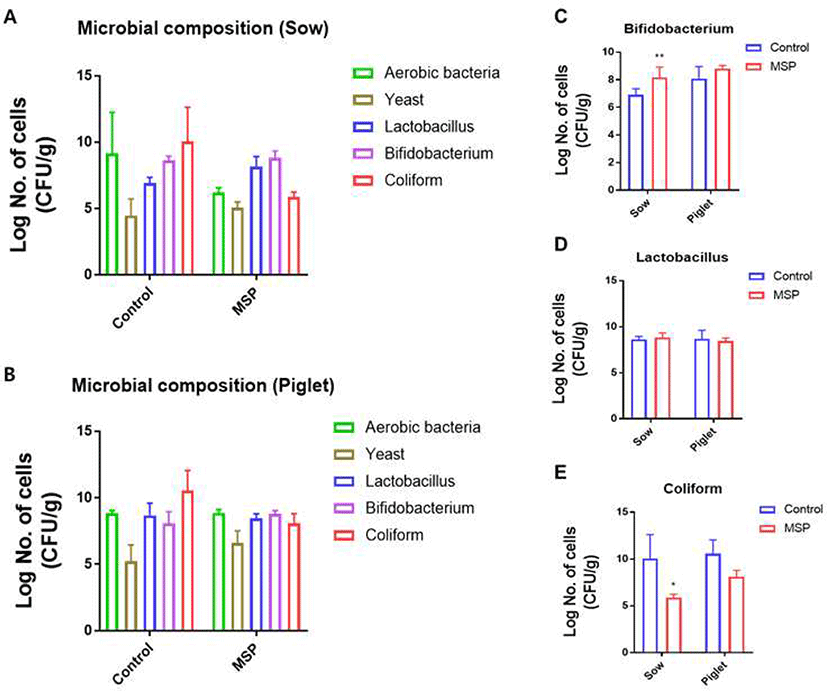
본 실험에서는 MSP의 급여가 돼지의 장내 미생물 균총에 미치는 영향을 관찰하기 위해 MSP를 급여한 농장과 급여하지 않은 일반 농장 간의 모돈과 이유자돈의 분변에서 장내 미생물 균총에 대하여 비교분석을 실시하였다(Fig. 6). 그 결과 Bifidobacterium은 자돈에서 MSP 농장과 일반 농장 간의 유의적인 균 수 차이를 보이지 않았지만, 모돈에서 MSP를 급여한 농장에서 유의적으로 Bifidobacterium 수가 더 많을 것을 확인하였다(Fig. 6C). Lactobacillus는 모돈에서 두 농장 모두 대부분 8×108 CFU/g 이상의 균 수가 관찰되어 대조군과 처리군 간의 유의적인 차이를 보이지 않았으며, 자돈에서도 역시 4×108 CFU/g 수준의 균 수를 나타내며 두 농장 간 유의적인 균 수 차이는 보이지 않았다(Fig. 6D). Coliform은 일반 농장의 모돈에서의 균 수는 5×109 CFU/g의 균 수를 보였으나, MSP를 급여한 농장에서는 6×105 CFU/g의 균 수를 보여 유의적으로 낮은 microbial composition이 관찰되었다(Fig. 6E). 또한 일반 농장의 자돈 분변에서 Coliform은 1×1010 CFU/g의 균 수를 보였으나, MSP를 급여한 농장의 경우 6×107 CFU/g의 균 수를 보여 모돈에서와 같이 유의적으로 낮은 microbial composition이 관찰되었다. MSP를 급여한 농장의 자돈은 일반 농장에 비해 개체의 microbial composition 균 수 분석 값의 개체간 차이, 즉 표준 편차가 적은 것이 관찰되었으며(Fig. 6A, 6B), 이것은 농장의 개체 간 장내 미생물 균총의 균일성(uniformity)를 높여 줄 것으로 판단된다. 따라서 MSP의 급여는 모돈에서 유익균으로 알려진 Bifidobacterium을 증가시켜 주고, 유해균으로 알려진 Coliform을 감소시켜 주며, 자돈의 장내 미생물 균총의 개체 간 uniformity를 상승시켜 줄 수 있을 것으로 사료된다.
고 찰
본 연구에서는 농장 자가배양시스템을 통한 MSP의 효율적이고 경제적인 배양 방법을 제시하고, 돼지에게 급여 시 장내 미생물 균총의 변화를 평가하였다. 생균제는 현재 항생제의 대체제로 세계적으로 많은 연구들이 진행되고 있으며, 그 효과에 대한 입증도 지속적으로 보고되고 있다(Mingmongkolchai and Panbangred, 2018; Wan et al., 2019). 하지만 생균제를 급여함에 있어서 급여되는 생균제의 특성에 대한 명확한 연구와 분석이 없이는 명확한 효과를 기대하기 어려우며, 특히 섭취에서 표적 기관까지의 생존 여부, 병인을 방해하는 능력, 미생물 제제의 안정성 등에 대한 실험은 가장 기본적으로 평가되어야 할 항목으로 보고되고 있다(McFarland et al., 2018). 본 연구에서 MSP의 효율적인 급여와 효과의 극대화를 위해 급여되는 생균제의 특성 평가를 실시하였을 때 4종의 생균제는 위산과 담즙과 같은 소화액에 대한 저항성을 가지고 있었고, 다음으로 표적 장기인 장에서의 군집화할 수 있는 능력도 있는 것으로 확인되었다. 또한 MSP는 돼지 산업에서 가장 빈번하게 감염되는 병원성에 대한 항균 능력도 가지고 있는 것으로 확인되었으며, 사료에 첨가되어 급여하는데 있어서 안정성을 보증할 수 있는 항생제에 대한 저항성도 낮은 것으로 관찰되었다. 따라서 MSP의 급여된 생균제는 체내에서 표적 기관에 살아서 도달하여 군집화될 수 있을 것으로 사료되며, 병원성 균에 대한 항균 능력을 통해 여러 병원균들에 대한 저항성을 가질 수 있을 것으로 사료된다.
다음으로 선별된 MSP를 농장에서 자체적으로 배양할 수 있도록 경제적이고 효율적인 경제 배지를 개발하였으며, 일반적으로 실험실에서 Lactobacillus 배양에 사용하는 MRS 배지와 비교분석하여 그 효율성과 경제성을 관찰하였다. 최적 경제배지에서 L. fermentum 216은 MRS 배지와 비슷한 성장을 보였으며, L. plantarum LP11 은 비록 MRS 배지보다는 낮은 성장률을 보였지만, 최적 경제배지에서도 1×108 CFU/mL 이상의 높은 성장률을 보였다. 결과적으로 경제 배지에서 MSP의 성장은 L. fermentum 216과 L. plantarum LP11의 성장이 다른 2종의 생균제보다 주도적으로 증가했다. 이러한 현상은 4종의 Lactobacillus가 혼합 배양하면서 서로의 성장에 길항 작용이 일어났기 때문으로 추측되었다(Ouwehand et al., 2018). 그럼에도 불구하고 본 연구에서의 최적 경제배지에서의 생균제의 성장률은 기존 실험실에서 사용되는 배지의 성분 가격과 균 성장 효율을 고려하였을 때, 농장에서 돼지에게 생균제를 고농도로 효율적이고 경제적으로 배양하여 급여하기에 적합하다고 사료된다. 특히 주도적인 성장을 보인 L. fermentum과 L. plantarum은 이유 자돈에서 growth performance와 소화 효율성, 사료 효율성을 개선시켜 증체량을 증가시킨다는 연구가 있으며(Wang et al., 2018), 특히 L. fermentum은 자돈의 면역계에서 serum specific anti-OVA IgG level을 증가시켜 면역력을 향상시킨다는 이전 연구 보고가 있어 그 활용가능성이 기대되고 있다(Suo et al., 2012; Yang et al., 2020).
생균제를 급여하는데 있어서 급여 용량은 생균제의 특성 발현과 농장의 사료비 상승에 관련이 있기 때문에 매우 중요하다(Liao and Nyachoti, 2017). 이전 연구에서 돼지에게 급여되는 생균제 용량은 일반적으로 1×107 CFU/mL 이상 급여하는 것이 가장 이상적인 용량일 것으로 사료된다(Bajagai et al., 2016). 본 연구에서는 돼지에게 적절한 용량의 생균제가 급여되는 것을 확인하기 위해서 농장 자가배양시스템을 통해 생산된 사료에서 생균제의 균 수를 확인하였다. 음수용 fermented feed에서 발효 기간 동안 생균제의 균 수는 점차 감소하는 경향을 보였지만, 발효 4일차에서도 1×107 CFU/mL 이상의 균 수를 보이며 적절한 생균제 균 수가 급여되고 있음을 확인했다. 고형 fermented feed에서는 발효 기간 동안 생균제의 균 수가 계속해서 증가하는 것을 확인했으며, 발효 4일차에는 9×108 CFU/mL의 균 수를 나타냈다. 또한 농장에서의 효율적인 생균제의 사용을 위한 열처리를 통한 건조 과정을 거쳐도 생균제의 균 수가 여전히 8×107 CFU/mL 이상을 나타냈다. 농장 자가배양시스템을 통한 MSP는 사료에 첨가되어 발효되는 동안에도 높은 사료 안정성을 보였으며, 장기간 보관을 위한 열처리 과정에서도 높은 안정성을 보이는 것으로 관찰되어 양돈산업에서 생균제의 적용을 위한 새로운 방안을 제시한 것으로 판단되었다.
또한, 본 연구에서는 MSP의 급여로 인한 돼지 장내 미생물 균총 변화를 관찰하기 위해 MSP를 급여한 농장과 일반 농장의 모돈과 자돈의 분변에서 정량분석을 실시하였다. Lactobacillus는 MSP 농장과 일반 농장에서 유의적인 차이를 보이는 반면, 일반적으로 유익균으로 알려진Bifidobacterium 은 MSP 농장의 모돈에서 일반 농장과 비교했을 때 유의적으로 수가 증가하였다. Bifidobacterium의 증가는 Salmonella 가 분비하는 분비물을 감소시키거나 Salmonella 감염으로 인한 병원성을 감소시킨다는 이전 연구 보고가 있으며(Barba-Vidal et al., 2017a; Barba-Vidal et al., 2017b), 이와 유사하게 유해균으로 알려진 Coliform은 MSP 농장의 모돈과 자돈에서 일반 농장에 비해 유의적으로 수가 크게 감소했다. Bifidobacterium의 급여는 Enterotoxigenic Escherichia coli의 장내 군집화를 억제한다는 이전 연구(Barba-Vidal et al., 2017a)에 근거하여 MSP 급여로 인한 Bifidobacterium의 증가가 Coliform의 감소가 밀접한 상관관계가 있을 것으로 판단되었다. 중요하게도 MSP 농장과 대조군 농장의 자돈의 장내 미생물 균총 분석에서 MSP 농장의 개체간 편차가 일반 농장의 개체 편차보다 더 적은 것으로 나타났다. 이는 MSP 농장의 자돈의 장내 미생물 균총의 균일성(uniformity)이 일반 농장의 자돈보다 더 우수하다는 것을 나타내며, 결과적으로 농장에서 사육 환경의 영향을 최소화하며 일정하고 동일한 고품질의 돼지를 생산하는데 기여할 것으로 사료된다.