서 론
우리나라의 발효식품은 미생물을 이용한 발효를 거쳐, 원재료에는 존재하지 않았던 특성이 다른 새로운 물질들이 만들어지면서 맛과 향, 기능이 달라지게 된다. 이에 따라 발효식품 속 물질들의 특수한 생리적 기능에 관한 연구가 증가하고 있다(Shin, 2010). 염장 채소를 이용한 김치류와 콩을 이용한 장류, 그리고 생선류를 이용한 젓갈 등은 숙성과정에서 미생물들의 상호작용에 따라 자연 발효되는 우리나라의 대표적인 전통 발효식품이다(Park, 2012). 그 중 김치는 Leuconostoc spp., Lactobacillus spp., Streptococcus spp., Pediococcus spp. 및 Weissella spp. 등의 유산균을 포함한 미생물들에 의해 발효가 이루어지며, 이 과정을 통해 특유의 맛과 향미를 발달시킨 한국 전통 발효 식품이다(Cheigh et al., 1994). 이러한 김치 및 김치 유산균은 항산화 효과, 암 예방 효과, 면역기능 강화, 아토피 및 알러지 저하 효과 등 다양한 건강 기능성을 가진 것으로 보고되고 있다(Lee et al., 1998). 또한 간장, 된장, 고추장, 청국장 등의 전통 장류는 주로 Bacillus, Aspergillus, 유산균 및 효모들의 복합적인 대사 과정에 의해 발효된다. 그 중 된장, 고추장과 같은 장류는 펩타이드, 아미노산, 이소플라본, 비타민 E와 같은 다양한 기능성 물질을 함유하고 있다. 이러한 성분들은 항암 및 항동맥경화, 치매 및 골다공증을 예방하는 등의 건강 증진에 도움을 준다고 알려져 있다(Park, 2006). 특히 이러한 식품의 자연발효에 관여하는 각종 미생물의 식중독 미생물 성장 억제 및 사멸 효과가 입증됨에 따라, 최근에는 장내 미생물 균총을 개선하여 장 건강을 유지하는 정장 작용에도 효과적인 프로바이오틱 유산균으로도 각광받고 있다(Choi et al., 2014).
유산균(lactic acid bacteria)은 발효 과정에서 당을 분해하여 젖산과 같은 유기산을 생성하는 미생물을 총칭하며, 통상적으로 그람양성의 통성 혐기성 구균 또는 간균으로 알려져 있다. 유산균은 대사산물로 젖산을 생성하여 pH를 저하시키며, bacteriocin, diacetyl, 과산화수소 등 다양한 항균성 물질을 통해 병원성 균의 생육을 효과적으로 억제할 수 있다(Chang, 2005). 이러한 생성물질은 유산균의 배양액을 여과시킨 상등액에 존재하는데, 그 중 bacteriocin은 항균활성을 가지고 있는 천연물질로서 미생물의 생육에 영향을 미치는 저분자 단백질성 항균물질로 알려져 있다(Abdel-Ba et al., 1987).
한국의 사찰음식은 우유를 제외한 모든 동물성 식품과 오신채(향이 강한 자극성이 있는 다섯가지 채소로 파, 마늘, 부추, 달래, 양파를 의미)를 금하고 있다(Kim et al., 2009). 육류 제한으로 콩제품을 많이 이용하며 사계절의 변화나 산중에 위치한 한국 사찰의 환경적 특성에 따라 식량을 자급자족해야 했기 때문에 저장식품인 장아찌류와 발효식품인 장류가 발달했다(Jung, 2012). 이러한 한국 사찰음식의 특징에 따라, 일반적으로 마늘과 어류를 사용한 젓갈류로 만든 전통적인 발효식품과 사찰에서 만든 발효식품 속 관여 미생물의 종류에 차이가 있을 것으로 추정한다.
식중독을 유발하는 대표적인 병원성균인 Staphylococcus aureus와 Escherichia coli O157:H7을 제어하는 것은 식품위생에 있어 중요하다. 독소를 비롯한 식중독 유발 요소들 중 이들이 불리한 환경에서 생성하는 biofilm은 extracellular polymeric substances라는 여러 종류의 biopolymer로 이루어져 있다(Flemming and Wingender, 2010). 특히 S. aureus의 biofilm은 숙주 내부의 면역시스템, 환경적 스트레스와 항균물질에 대한 내성을 증가시킨다(Yum et al., 2017). 병원성균의 생장 억제와 관련하여, S. aureus와 E. coli O157:H7이 probiotics 균의 증가로 인해 균 수가 감소하는 연구 결과가 있으며, bacteriocin의 항균 활성에 의해 저해된다는 연구가 선행되었다. 이와 같이 각종 병원균과 유해미생물에 대한 유산균의 항균작용에 관한 많은 연구가 국내외적으로 계속되고 있지만(Gilliland and Speck, 1977; Lewus et al., 1911; Kim et al., 1977), 사찰의 발효식품에서 추출한 유산균의 항균작용에 관한 연구는 미비한 실정이다. 따라서 본 연구에서는 국내 3곳의 사찰 발효식품 5종으로부터 순수분리한 균종의 상등액을 이용하여, 대표적인 유해 장내균총이며 식중독 유발 균종인 E. coli O157:H7와 S. aureus에 대한 항균효과 및 biofilm 억제 효과를 알아보고자 한다.
재료 및 방법
본 실험에서는 국내 사찰에서 분리한 유산균주를 de Man, Rogosa and Sharpe(MRS, Neogen, USA)와 bromocresol purple (BCP, HARDY diagnostics, USA)에 37℃, 48시간 배양하여 사용하였다. 실험에 사용한 병원균 E. coli O157:H7 ATCC 35150은 Luria-Bertani(LB, LPS solution, Korea), S. aureus ATCC 29213은 Brain Heart Infusion(BHI, Becton, Dickinson and Company, USA)에 37℃, 24시간동안 배양하여 실험에 사용하였다.
국내 3곳의 사찰에서 발효식품을 공수 받아 실험을 진행하였다. T사찰에서 제조한 간장, 된장, 고추장과 B사찰에서 제조한 배추김치, J사찰에서 제조한 깍두기와 배추김치를 사용하였다. 각각의 발효 식품 10 g을 phosphate buffer saline(PBS) 10 mL에 희석하여 1 g/mL로 고정한 후 PBS에 serial dilution하였다. 희석액을 MRS agar에 100 μL 접종한 후 도말하여 37℃에서 48시간 동안 배양하였다. MRS agar에 나타나는 유백색의 단일 콜로니를 선택적으로 분리하기 위해, 형성된 콜로니를 loop로 취해 도말하는 과정을 반복하여 순수 분리하였다. 그 후 BCP agar에서 37℃, 24시간 배양하여 단일 콜로니 주위가 균이 생성한 산성물질에 의해 노란색으로 변화하여 젖산발효를 하는 유산균임을 확인하였다. 최종적으로 순수 분리된 균주임을 확인하기 위하여 각 균주마다 Gram 염색을 진행하여 형태 및 그람양성균주임을 확인하였다. 각 사찰마다 4개의 균주를 선택하여 TS1, TS2, TD3, TG4, BK1, BK2, BK3, BK4, JKK1, JKK2, JK3, JK4로 표시하고, MRS agar에 37℃, 48시간 동안 배양하여 나타난 단일 콜로니를 loop로 채집하여 MRS broth에 1% 계대배양하여 얻어진 균주를 50%(v/v) glycerol MRS broth에 현탁하고, –80℃ deep freezer에서 보관하였다.
12개의 균주 TS1, TS2, TD3, TG4, BK1, BK2, BK3, BK4, JKK1, JKK2, JK3, JK4를 MRS broth에서 37℃, 48시간 각각 배양한 후 균질화하였다. 이후 16,000 × g으로 20℃에서 15분동안 원심분리 후, 상등액의 pH를 1N NaOH를 사용하여 6.5로 보정하였다. 이후 0.45 μm, 0.20 μm syringe filter(Samchun Chemical Co., Korea)로 차례대로 여과 후 –80℃ deep freezer에 보관하여 실험에 사용하였다.
600 nm에서 O.D 0.05로 맞춘 E. coli O157:H7 배양액 100 μL와 각 균주의 CFS 시료 100 μL를 96-well plate에 처리한 뒤, serial dilution하여 37℃, 24시간 배양하였다. 대조군은 접종하지 않은 fresh LB broth를 사용하였고, 시료는 TS1, TS2, TD3, TG4, BK1, BK2, BK3, BK4, JKK1, JKK2, JK3, JK4로 시료마다 항균효과 분석을 독립적으로 진행하였다. 이후 microtiter plate reader(AMR-100, Allsheng, China)로 595 nm에서 흡광도를 측정하였다. 동일한 방법으로 600 nm에서 측정한 흡광도를 0.05로 맞춘 S. aureus 배양액을 BHI broth를 대조군으로 사용하였으며, 시료 TS1, TS2, TD3, TG4, BK1, BK2, BK3, BK4, JKK1, JKK2, JK3, JK4에 대하여 독립적으로 항균효과를 분석하였다.
600 nm에서 측정한 흡광도를 0.05로 맞춘 E. coli O157:H7와 S. aureus 배양액 100 μL와 시료(TS1, BK1, JK4) 100 μL를 2개의 96-well plate에 동시처리한 뒤 37℃에서 각각 24시간, 72시간 배양하였다. 상등액을 제거한 후 PBS 200 μL로 세척하고, 0.1% crystal violet 용액 200 μL를 넣어 암실조건에서 30분간 염색한 뒤 PBS 200 μL로 세척하여 염색된 생물막을 얻었다. 이를 용해용액(ethanol 95%, 멸균처리한 3차 증류수 4.9%, acetic acid 0.1%) 200 μL로 용해시킨 후 microtiter plate reader(AMR-100, Allsheng, China)로 595 nm에서 흡광도를 측정하였다.
600 nm에서 측정한 흡광도를 0.05로 맞추어 E. coli O157:H7과 S. aureus 배양액을 준비하여 E. coli O157:H7 배양액 100 μL에 시료(LB broth, TS1, BK1, JK4) 100 μL를, S. aureus 배양액 100 μL에 시료(BHI broth, TD3, BK3, JK3) 100 μL를 각각 96-well plate에 동시처리한 후 37℃에서 24시간, 72시간 배양하였다. 배양 후 얻은 상등액을 PBS를 이용하여 serial dilution을 진행하고, MRS agar에 도말하여 37℃에서 24시간 배양하여 생균수를 측정하였다.
결과
국내 3개 사찰의 발효식품에서 분리된 총 41종의 유산균 중에 병원성균에 대하여 생장 저해 효과가 우수한 12종의 유산균주(간장 2종, 된장 1종, 고추장 1종, 배추김치 6종, 깍두기 2종)을 선별하였다. 선별된 유산균주 12종의 특성은 Table 1과 같다.
선별한 유산균 12종의 E. coli O157:H7과 S. aureus에 대한 항균 효과는 Fig. 1과 같다. CFS 처리에 따른 OD 측정 결과 1:4 이하의 농도에서는 대조군과 유의적 차이가 나타나지 않았으나, 1:2 이상의 농도에서는 통계적으로 유의적인 OD 값의 감소를 나타내었다. E. coli O157:H7와 CFS를 1:1로 처리한 결과(Fig. 1A), JK3를 제외한 11개의 CFS 처리 모두 유의미한 억제 효과를 확인하였다(p<0.05). 특히, TS1은 47.64%, BK1은 43.39%, JK4는 32.97%의 억제 효과를 확인하였다. S. aureus와 CFS를 1:1로 처리한 결과(Fig. 1B), 12개의 CFS 처리 결과 모두 유의미한 생장 억제 효과를 확인하였다(p<0.05). 특히, TD3는 52.81%, BK3는 44.79%, JK3는 34.94%의 억제 효과를 확인하였다. MIC test 결과 E. coli O157:H7에 대하여 억제 효과가 높은 TS1, BK1, JK4와, S. aureus에 대하여 억제 효과가 높은 TD3, BK3, JK3를 선별하였다.
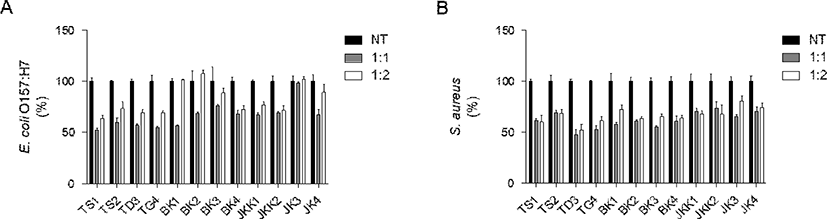
Fig. 2은 E. coli O157:H7에 대하여 높은 억제효과를 보인 CFS를 동시에 처리하여 24시간, 72시간 배양한 뒤 염색하여 595 nm에서 흡광도를 측정한 결과이다. E. coli O157:H7에 TS1, BK1, JK4의 CFS를 처리하여 24시간 배양한 결과(Fig. 2A), 3종 모두 유의적으로 E. coli O157:H7에 biofilm 억제 효과를 확인하였다(p<0.05). 특히 TS1는 61.76%, JK4는 66.55%의 유의적으로 강한 억제능을 확인하였으며, BK1은 55.1%의 억제능을 확인하였다. 같은 방법으로 72시간 배양한 결과(Fig. 2B), JK4에서 E. coli O157:H7의 biofilm 형성이 48.34% 감소되어 유의적 차이를 확인하였다. Fig. 3은 S. aureus에 대하여 높은 억제효과를 보인 CFS를 동시 처리하여 24시간, 72시간 배양한 뒤 염색하여 595 nm에서 흡광도를 측정한 결과이다. S. aureus에 TD3, BK3, JK3를 동시에 처리한 뒤 24시간 배양한 결과(Fig. 3A), JK3만 64.48%로 유의적인 biofilm 억제 효과가 있음을 확인하였다. TD3와 BK3는 2배 이상 증가한 흡광도를 보였다. 72시간 배양한 결과(Fig. 3B), 24시간 배양과는 다른 양상을 나타내었다. 3종의 시료 중 TD3만 S. aureus의 biofilm 형성을 28.79% 억제하였다. 72시간 배양한 경우, TD3에 의하여 유의적으로 S. aureus의 biofilm 형성이 억제되었지만, 24시간 배양한 경우 오히려 흡광도가 증가하였다. BK3는 S. aureus의 biofilm 형성을 억제하지 못하는 것으로 확인되었고, JK3은 24시간 배양할 경우 72시간 배양할 경우와 달리 biofilm 형성을 강하게 억제함을 확인하였다.
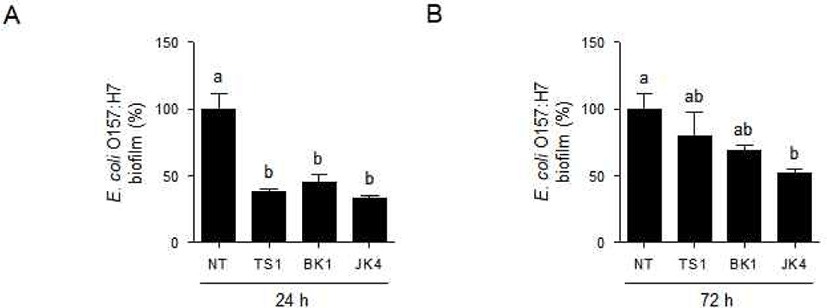
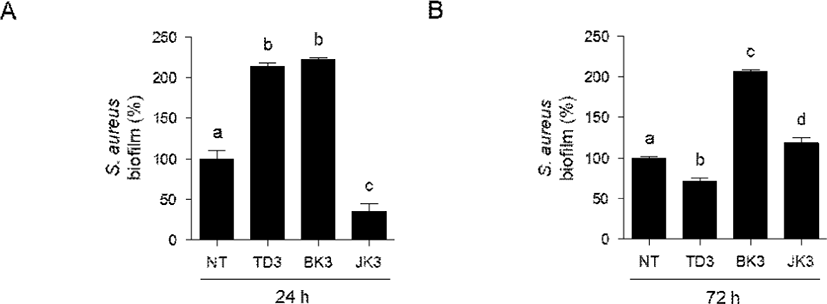
Table 2는 E. coli O157:H7과의 반응에 대한 선별 유산균인 TS1, BK1, JK4의 CFS를 동시 처리한 뒤 24, 72시간동안 배양 후 serial dilution하여 E. coli O157:H7의 생장 억제 효과를 확인하였다. 24시간 처리한 경우 대조군과 비교하여 약 1 Log CFU/mL 감소하였으며, 72시간 처리한 경우, 대조군과 비교하여 약 2 Log CFU/mL로 유의적으로 감소하는 경향을 보였다. 3개의 실험군 모두 CFS에 의해 감소하는 경향을 보였지만 24시간 배양했을 때보다 72시간 배양했을 때 더 큰 폭으로 감소하였다. Table 3은 S. aureus와의 반응에 대한 선별 유산균인 TD3, BK3, JK3의 CFS를 동시 처리한 뒤 24, 72시간 동안 배양 후 serial dilution하여 S. aureus의 생장 억제 효과를 확인한 결과이다. 3개의 균종을 각각 24시간 처리한 경우 대조군과 비교하여 유의적으로 감소하지 않았다. 한편, 72시간 처리한 경우 대조군과 비교하여 TD3과 BK3에 의하여 약 2 Log CFU/mL 감소하는 경향을 보였다.
고찰
국내 사찰의 발효식품으로부터 분리한 유산균의 CFS를 이용하여 식중독유발균 중 그람음성균인 E. coli O157:H7과 그람양성균인 S. aureus에 대한 biofilm 및 생장 억제 효과 특성을 확인하였다. 유산균의 CFS 제작 시 pH 6.5로 보정하여 유기산의 생성으로 인한 pH 변화의 영향을 배제함으로써, 본 연구에서 유산균의 생성물질에 의한 사멸효과임을 뒷받침한다. 또한 유산균의 항균활성은 bacteriocin과 같은 발효생성물이 작용한 결과일 것으로 추측되며, 사찰의 발효식품 속 관여 미생물의 종류에 따라 항균물질의 종류 및 활성 정도에 차이가 있었을 것으로 생각된다(Kim et al., 2002). E. coli O157:H7에 TS1, BK1, JK4의 CFS를, 그리고 S. aureus에 TD3, BK3, JK3의 CFS를 각각 동시에 처리하여 배양한 결과, TS1, BK1, JK4는 E. coli O157:H7에 대하여 생장 억제 및 biofilm 형성 억제 효과가 있음을 확인하였다(Fig. 2, Table 2). 반면 S. aureus에 대하여 TD3와 BK3는 72시간 배양에서만 생장 억제 효과가 있었고, JK3는 생장 억제 효과는 없지만 24시간 배양했을 때 biofilm 억제 효과가 가장 좋았다(Table 3, Fig. 3). 이처럼 본 연구를 통해 그람음성균인 E. coli O157:H7과 그람양성균인 S. aureus의 biofilm 형성과 생장을 유의적으로 억제한 균주가 동일하지 않았으며, 배양시간에 따른 억제 양상 또한 동일하지 않은 것을 확인하였다. 병원균의 biofilm 형성은 먼저 점액성분에 의해 cell이 표면에 부착하고, 다음으로 세포내 응집 및 세포간 응집 등의 상호작용에 의해 당질의 다층구조가 형성되는 과정이 수반되어야 한다. 따라서 biofilm의 억제는 균의 생장을 억제하면서 동시에 biofilm의 형성을 억제하거나, 또는 세균의 biofilm 구조물 형성을 억제하는 두 가지 원인에 의한 것으로 알려져 있다(Herald et al., 1988; Marsh et al., 2003; Roy et al., 2018). 본 연구 결과를 통해 사찰 발효식품에서 분리한 유산균 중 TS1, BK1, JK4는 그람음성균인 E. coli O157:H7에 대하여 병원성균의 생장과 biofilm 형성을 동시에 억제한다고 추측한다. 반면, 본 연구에서 그람양성균인 S. aureus에 대한 실험 결과는 일반적으로 bacteriocin이 그람양성균의 biofilm 형성과 발달을 방해한다는 선행연구의 결과와 상반되는 결과를 얻었다(Kim et al., 2019). 병원성균에 대한 생장 억제와 biofilm 억제의 명확한 기작 파악을 위한 다양한 후속연구가 필요하다.
항생제 및 살균제에 저항성을 가진 식중독균뿐만 아니라, 이들이 형성하는 식품 위해요소인 biofilm을 억제하기 위한 연구의 중요성은 점차 증가하는 추세이다. 그 중 발효식품에서 분리된 유산균의 E. coli O157:H7, S. aureus, Pseudomonas aeruginosa, Salmonella Typhimurium와 같은 병원균에 대한 항균활성 효과에 대한 연구가 심도 있게 이루어지고 있다(Adesokan et al., 2008, Obadina et al., 2006, Puttalinggamma et al., 2006). 김치와 콩 발효식품으로부터 분리, 동정한 Helicobacter pylori 억제 유산균 Lactobacillus plantarum은 그람양성균 및 그람음성균의 생장을 억제할 뿐만, 아니라 장내 생존 가능성도 높아 정장용 프로바이오틱스로 활용될 것으로 기대된다(Lee et al., 2008, Apostolidis et al., 2011). 한편, 일반적으로 판매되는 김치와 국내 사찰에서 전통 방법으로 만든 김치의 발효과정과 미생물의 다양성을 비교한 결과, 유산균 생장에 도움을 주는 젓갈, 마늘, 파가 없어도 유해 미생물보다 유산균이 우세한 것으로 밝혀졌다. 또한 일반 김치와 비교하였을 때 사찰 발효식품 속 유산균 생장 또한 뒤쳐지지 않았다(Lee et al., 2019). 또한 국내 사찰에서 제조한 된장에서 분리한 Bacillus licheniformis YB-1234의 a-amylase 생산 여부를 확인하고 그 효소 특성을 연구한 결과, pH 6.0에서 최대활성을 보였고, 열에 대한 안정성이 매우 높았다(Lee et al., 2012). 이렇듯 최근 발효식품으로부터 분리한 균주를 형태적 특성, 생화학적 성질 및 16S rRNA 유전자 염기서열에 근거하여 동정하고, 유용 유산균의 특성을 규명하기 위한 연구가 활발히 이루어지고 있다. 그러나 사찰의 발효식품에서 분리된 유산균의 대사산물을 이용한 병원균의 항생물막 효과 및 항균효과에 관한 연구는 아직 미비한 실정이다. 따라서 본 연구는 사찰 발효식품으로부터 항균활성이 있는 유산균의 활용성을 확보함으로써 향후 발효미생물을 이용한 기능성식품 등 새로운 산업군에서의 유산균제제의 소재로 활용이 가능할 것으로 사료된다.







