서 론
식품 발효는 몇 세기 동안 사용된 효율적인 식품 가공 보존 기술이다. 발효에 사용되는 미생물은 식품에 복합 화합물 분해, 유기산 생산, 비타민 농도 증가 등과 같은 이점을 준다. 발효 중 영양소의 흡수를 방해하는 화합물들을 저하시키며, 유익한 화합물의 생물학적 이용 가능성을 증가시킬 수 있다 (Das et al., 2020; Di Cagno et al., 2016). 발효식품에 대한 관심이 높아지면서 효능이 좋은 발효식품에 대한 연구 개발도 활발해졌다. 식품에서 가장 많이 사용되는 미생물은 유산균(lactic acid bacteria)에 있는 프로바이오틱스이다. 유산균은 다양한 제품을 생산하기 위해 유제품, 야채, 시리얼 등에 사용되었다(Bevilacqua et al., 2016).
곡물은 생리 화학적 화합물로 알려져 있지 않지만, 다양한 종류의 식품에서 기능성을 가진 화합물 운반체로 사용된다 (Di Cagno et al., 2016). 세계적으로 쌀은 주식으로 생산되고 소비한다. 또한 쌀을 프로바이오틱스와 함께 발효시 유산균을 자극하고 유기산 생산을 증가시키고(Hong and Ko, 1991), 발효 유기농 쌀 당화액과 유산균으로 만든 음료는 맛을 증가시키며, 대중적으로 소비자들에게 잘 맞을 것이다(Kim et al., 2017).
GABA(gamma-amino butyric acid)는 자연계에 분포하는 비단백질 아미노산의 일종이며, 포유동물에서 뇌와 척수에 존재하는 신경 전달 물질 중 하나이다. 또한 뇌의 혈류를 개선하여 뇌의 산소 공급이 증가되고, 뇌의 대사 향상과 의욕 저하의 치료제로 사용된다(Oh et al., 2002; Xing et al., 2007). 또한 혈압강하작용, 통증과 불안증세 완화, 당뇨병 예방, 불면, 우울증 완화 등 여러가지의 기능성을 나타내는 것으로 보고되었으며(Lim and Kim, 2009), GABA의 농도가 급격히 감소하거나 함량이 줄어들 때에는 발작이나 경련 등이 발생하고, 이러한 현상이 지속되면 간질, 치매 등 신경에 관련된 신경성 질환을 일으킬 수 있다(Shelp et al., 1999). 그리고 항이뇨호르몬에서 바소프레신 분비를 억제하고, 혈관을 확장해서 혈관을 낮추는 고혈압 저하 효과 또는 이뇨 효과 등 여러가지 생리 작용을 한다. 그러나 식물에서의 GABA는 발아 현미, 녹차 등에 다소 함유되어 있지만, 약리작용을 하기에 턱없이 함량이 낮아서 일반적인 섭취로 GABA의 생리작용을 기대하기는 어렵다. GABA의 대량 생산에 관한 연구가 활발히 진행되어 왔으나, 합성 GABA의 경우에는 식욕 부진, 설사 등 부작용이 있어 발효제법을 이용하여 GABA를 생산을 하는 연구 개발을 하고 있으나, 아직까지는 수율이 낮다(Lim and Kim, 2009).
본 연구는 쌀 당화액을 유산균을 이용한 쌀뜨물 발효액으로 발효하여 이화학적 특성을 확인하여 유산균 쌀 발효액의 음료 베이스의 가능성을 확인하였다. 또한, 이때 쌀 발효액 제조시 glutamic acid을 첨가하여 GABA 함량을 높였다.
재료 및 방법
쌀당화액, 찹쌀당화액을 쌀발효액의 첨가량이 30%, 40%가 되게 하여 발효 시간(36 h, 72 h), 발효 온도(30℃, 40℃)를 다르게 하여 발효시켰고, 여과 후 25℃에서 72시간 숙성시켜 최종 발효액을 만들었다.
쌀 당화액 발효를 위해서 쌀뜨물 발효액 발효제 2종을 사용하였다. 발효제 A는 곰팡이 2종, 세균 10종, 젖산균 6종, 효모 10종을 배양한 것이며, 발효제 B는 젖산균 3종으로 배양한 것이다. 이때 발효제 B에 사용된 젖산균은 김치로부터 GABA 생산능력이 우수한 균주로 Lactobacillus brevis (KACC91548P), Lactobacillus plantarum(KACC91549P), Lactobacillus mesenteroides (KACC9 1547P)를 이용하였다. 쌀 당화액(50°Brix) 30 mL에 라이젠 21.6 mL를 배합하여 35℃에서 48시간 배양한 후, 배양액을 8,000 rpm에서 30분간 원심분리하였다. 배양액 상징액을 filter paper (Advantec No.1, Advantec MFS, Japan)로 여과하였다.
GABA가 함유된 발효 쌀 당화액을 만들기 위해 쌀 당화액 (50°Brix) 30 mL에 유산균 쌀뜨물 발효액 30 mL, 1 g monosodium glutamate(MSG)를 배합하여 35℃에서 48시간 발효하였다. 발효액은 8,000 rpm에서 30분간 원심분리하였다. 배양액 상징액을 filter paper(Advantec No.1, Advantec MFS, Japan)로 여과하였다. 여과 후, 쌀 당화액 1 L당 100 mL 발효액을 첨가하여 35℃에서 24시간 발효하였다. 최종 발효액은 70℃에서 1시간 동안 방치하여 살균 공정을 거친 후, 8,000 rpm에서 30분간 원심분리 및 여과를 하여 최종 유산균 쌀 발효액을 제조하였다.
쌀뜨물 발효액의 GABA 생성 여부를 확인하기 위하여 얇은막 크로마토그래피(TLC, thin-layer chromatography) 분석을 이용하였다. 알루미늄 TLC plate를 사용하였으며, Sample은 5 μL씩 분주하여 전개용매를 통해 전개시켰다. 전개용매는 n-Butanol: acetic acid:D.W = 3:2:1이 되도록 준비하였으며, 발색용매는 0.4% ninhydrin-acetone 용액을 준비하였다. 전개시킨 TLC는 발색시킨 후 110℃ 오븐에서 10분간 말려 시각화하였다.
발효 쌀 당화액의 GABA 함량의 정량분석을 하기 위해서 발효 쌀 당화액을 ο-phthaldialdehyde(OPA)를 이용하여 유도체화를 수행하였고, 이를 고성능 액체 크로마토그래피(HPLC, Class-VP10, Shimazu, Japan)을 사용하여 분석하였다. OPA 유도체화는 0.4 N borate buffer(pH 10.4) 25 μL에 0.45 μm syringe filter로 여과한 발효액 5 μL와 OPA reagent(Agilent Technologies, Germany) 5 μL를 넣은 후 상온에서 5분간 방치하였다. 그 후 멸균수 330 μL를 첨가하여 HPLC로 분석하였다. 분석컬럼은 Zorbax Eclipse AAA 컬럼(4.6×150 mm I.d. , particle size 3.5 μm, Agilent Technologies)을 사용하였다. Detection wavelength는 338 nm, 컬럼 온도는 40℃로 설정하였다.
발효 쌀 당화액의 유리당 함량은 high performance anion-exchange chromatography(HPAEC, ICS-5000, Dionex, USA)을 이용하였다. 발효 쌀 당화액을 0.45 μm syringe filter를 이용하여 불순물을 제거한 후 HPAEC에 25 μL를 주입하였다. 이동 용매로는 150 mM sodium hydroxide(NaOH)(A)와 500 mM sodium acetate(B)를 이용하였고, A 용매에서 B 용매로 선형농도구배를 유속 1.0 mL/min으로 주었다. HPAEC는 Dionex model DX-600(Dionex, USA)을 사용하였고, Detector는 ED50 electrochemical detector(Dionex)를, 컬럼은 CarboPacTM PA-1 colume(250 × 4 mm, Dionex)을 사용하였다.
결과 및 고찰
멥쌀당화액 및 찹쌀당화액을 쌀발효액의 첨가량이 30%, 40%가 되게 하여 발효시간(36 hr, 72 hr), 발효온도(30℃, 40℃)를 다르게 하여 발효시켰고, 여과 후 25℃에서 72시간 숙성시켜 발효액을 만든 후 품질 특성을 비교하였다. 36시간 발효한 쌀 당화액의 품질특성 결과는 Table 1에 나타내었다. pH의 경우, 여과 전보다 여과 후의 값이 증가함을 나타냈으며, 산도의 경우 여과 후의 값이 낮아지며, 탁도의 경우 여과 후의 값이 낮아짐을 나타나 여과 후의 변화 중 탁도의 값이 큰 폭으로 변화함을 나타내었다. 그리고 72시간 발효한 쌀 당화액의 품질 특성 결과는 Table 2에 나타내었다. 72시간의 경우 역시 pH는 여과 후의 값이 증가하였으며, 산도 값은 낮아지며, 탁도의 경우 여과 후의 값이 낮아짐을 나타나 여과 후의 변화 중 탁도의 값이 큰 폭으로 변화함을 나타내어 멥쌀에서는 36시간과 72시간 발효 시간에 따른 변화의 추이가 같은 경향을 나타내었다. 멥쌀 당화액과 더불어 찹쌀 당화액의 실험결과는 Table 3, 4에 나타내었다. 그 결과, 멥쌀 당화액의 변화추이와 같은 경향으로 여과 후의 결과 값 중 pH는 증가함을 나타내며, 산도의 값은 낮아짐을 나타내었다. Leuconostoc mesenteroides와 함께 접종한 현미 당화액의 pH는 배양 9시간 이후 pH 3.63으로 급격히 감소한 후에 배양 15시간에 pH 3.57로 감소하였으며, 적정산도는 지속적으로 증가하여 0.40%에 도달하였다. 이로 인하여 배양 시간에 따라서 적정산도는 시간이 지날수록 더 높아지고, 그에 비하여 pH는 점차 줄어지는 것을 볼 수 있었다(Kim DC, 2011).
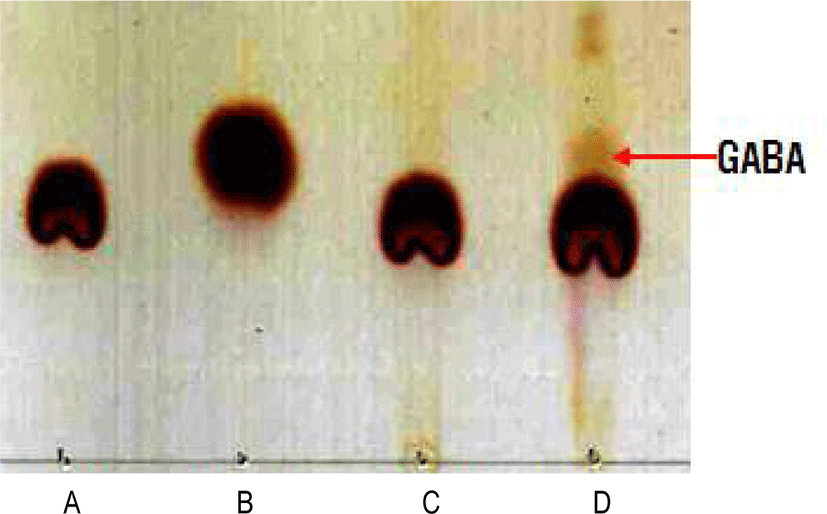
GABA 함량이 증진된 프리미엄 발효 쌀 당화액을 제조하기 위해 곰팡이 2종, 세균 10종, 젖산균 6종, 효모 10종을 쌀뜨물에 발효한 것(쌀뜨물 발효액A)과 김치로 분리한 젖산균 3종을 쌀뜨물에 발효한 것(쌀뜨물 발효액B) 2종류로 확인하였다. 쌀뜨물 발효액 A와 쌀뜨물 발효액 B의 GABA생성 능력을 확인하기 위해 1% MSG를 기질로 하여 발효제 A와 발효제 B를 35℃에서 24시간 반응한 후, thin-layer chromatography(TLC) 분석을 수행하였다(Figure 1). TLC 분석 결과, 두 쌀뜨물 발효액 중에서 발효액 B만 MSG를 이용하여 GABA로 전환시킬수 있음을 확인하였다. 발효액 B에 접종된 젖산균은 Lactobacillus brevis, Lactobacillus plantarum, Leuconostoc mesenteroides로 모두 GABA 생산 능력이 뛰어난 균주로 알려져 있다. TLC 분석에서 GABA의 생산량이 적은 이유는 GABA 생산은 발효 과정에 의해서 크게 일어나지만, 본 실험 조건에서는 발효액 B의 미생물들이 생장할 수 있는 탄소원이 없기 때문에 GABA 생산 발효가 충분히 일어나지 않았다. 이와 같이 미생물에 의하여 GABA가 생성이 될 때 GAD 효소에 의하여 glutamate가 decarboxylation이 되는 동시에 proton이 소비가 됨으로써 GABA 생성과 함께 pH를 높이므로, 이에 따라 2차 젖산균 발효가 진행이 되며, pH가 증가하는 현상은 기질인 MSG가 GABA로 전환이 되었음을 보여준다(Lim and Lee, 2014).
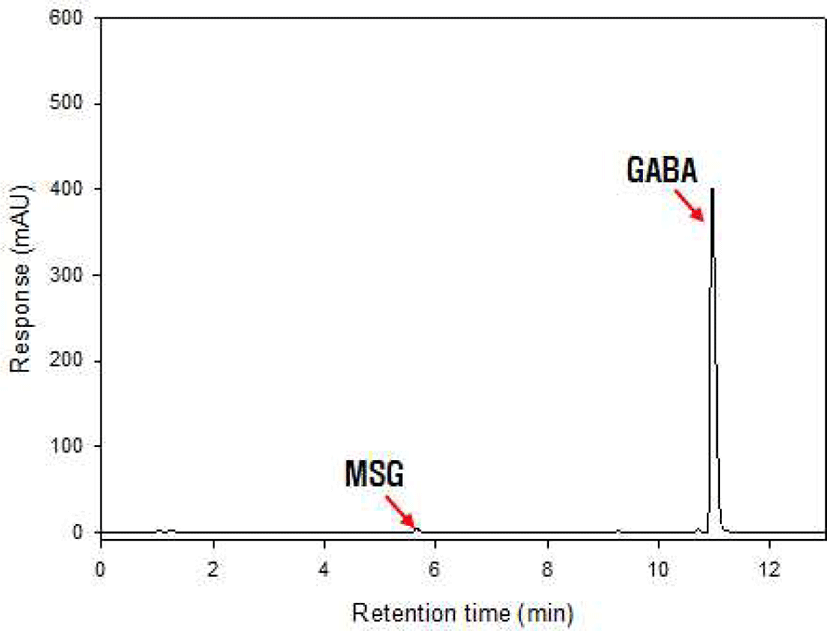
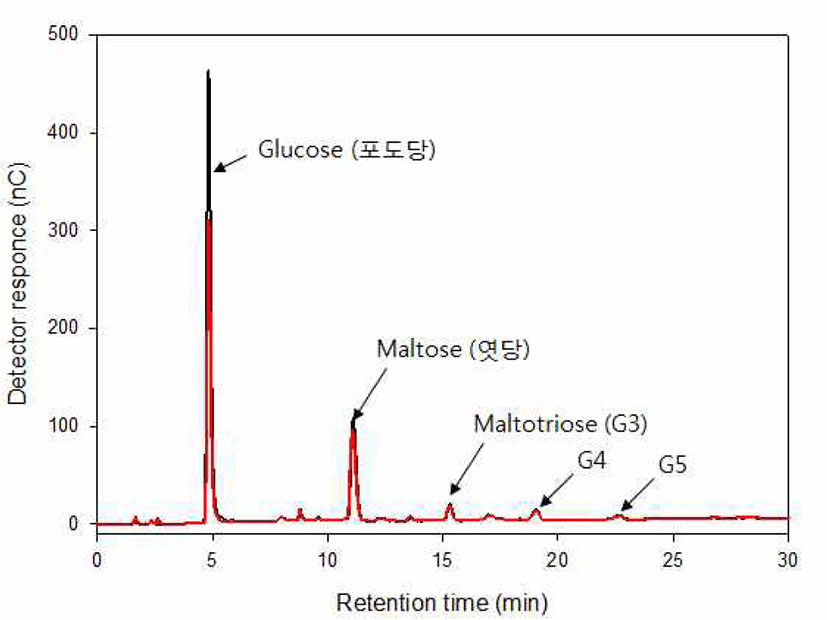
쌀뜨물 발효액 B을 이용하여 쌀 당화액을 35℃에서 48시간 발효를 수행하였다. 발효된 쌀 당화액의 GABA는 HPLC를 이용하여 분석하였다. 발효액에서 GABA의 함량은 3.89 mg/100g으로 미량이 검출되었다. GABA의 함량을 증진하기 위해 MSG를 첨가하여 발효하였다. 발효액에서는 기질로 사용된 MSG가 극히 미량 검출이 되었으며, GABA가 크게 검출되었다(Figure 2). 이 때의 GABA 함량은 700 mg/100g으로 약 180배 증가하였다. 이는 발효제 B의 젖산균들이 쌀 당화액을 탄소원으로 발효를 하면서 MSG를 GABA 생산을 위한 전구물질로 모두 소모했다는 것을 의미한다. 발효 과정 중 발효당을 확인해 보기 위해서 발효 쌀 당화액의 당 성분을 HPAEC 분석을 통하여 확인하였다(Figure 3). HPAEC 분석 결과, 쌀 당화액에는 포도당과 엿당이 주성분으로 존재하였고 미량의 maltooligosaccharides(G3∼G5)가 존재함을 확인할 수 있었다. 발효제 발효 후, 엿당과 maltooligosaccharides의 변화가 미미한 반면에 포도당의 함량이 크게 감소함을 확인할 수 있었다. 이는 MSG가 첨가된 쌀 당화액을 유산균 발효액으로 발효시, 거의 대부분의 MSG가 GABA로 전환이 되었음을 확인된다. 그리고 쌀 당화액은 포도당과 엿당이 주성분을 이루며, 쌀뜨물 발효액으로 발효 후, 포도당만 발효로 사용되고, 그 외 엿당 및 maltooligosaccharide(G3∼G5)는 사용하지 않음을 확인했다.
녹각 추출물을 이용하여 GABA의 생산 최적화를 위하여 추출액 농도, 질소원인 Yeast extract(YE), 탄소원 포도당, GABA 생성 전구물질인 MSG 농도에 따른 최적 조건을 YE 0.5%, 포도당 1.5%, MSG 3.5%를 첨가해 30℃에서 7일간 젖산 발효를 한 결과, MSG가 GABA로 전환이 되어 GABA를 1.43% 생성하는 것으로 나타났다고 보고하였으며, MSG가 GABA로 전환이 되는 것이 연구결과 일치하였다(Kwon and Lee, 2018).
본 GABA 함량이 증가된 발효 쌀 당화액을 쌀 복합소재 음료에 직접 사용하기에는 발효에 의한 이취 및 관능적 특성이 적합하지 않아 GABA 함량이 증가된 발효 쌀 당화액을 쌀 당화액과 다시 발효하여 음료베이스를 제조하였다. 발효 쌀 당화액과 발효 쌀 음료베이스의 품질 특성은 Table 5에 나타냈다.
발효 쌀 당화액의 총수용성 성분 함량은 28.7 °Brix이며, pH는 4.01, 산도는 0.882%로 나타났다. 포도당과 엿당의 함량은 각각 6.2%, 12.1%였으며, 맛은 단맛이 거의 느껴지지 않았고, 짠맛 및 발효에 의한 이취(泥醉)가 나타났다. 이 때의 유산균 수는 9.3 × 108 CFU/mL로 발효가 활발히 이루어졌지만 음료에 바로 적용할 수 없는 특성이 나타났다. 이에 발효 쌀 당화액을 발효액으로 이용하여 쌀 당화액과 2차 발효를 수행하였으며, 이것은 발효 쌀 당화액보다 총수용성 성분 함량, pH 및 당류의 함량이 높았으며 산도는 낮게 나타났다. 이때의 GABA 함량은 0.068%로 2차 발효시에 희석에 의해서 함량이 낮게 나왔지만, 이는 원래의 쌀 당화액 음료베이스보다 17배 이상 많은 함량이다. 발효 쌀 당화액 음료베이스의 맛은 달며 발효에 의한 이취(泥醉)가 거의 느껴지지 않았다. 또한, 열처리 통하여 유산균을 모두 제거하여 후 발효에 의한 음료의 변패를 막았으며, 발효 쌀 당화액보다 구연산의 함량이 많았으며, 아세트산의 함량은 감소하였다. 산돌배 추출액을 이용하여 젖산균 혼합발효를 통한 고농도의 GABA 생산을 수행한 실험에서 산돌배의 수용성 고형분함량은 5.25 °Brix였으며, 1차 젖산균의 발효물은 pH 4.19와 1.03%의 산도를 가졌다. 그 이후에 3%의 MSG를 첨가하여 2차발효를 한 결과, pH 4.50, 1.44%의 산도를 가짐으로써 최종적인 산돌배 혼합 발효물은 환원당과 MSG가 모두 소진되면서 1.78%의 GABA를 생산하는 것을 알 수 있었다(Choe and Lee, 2019).
요약
GABA 물질은 혈압저하 및 알코올성 손상으로부터 간을 보호하는데 도움을 주는 생리활성기능 2등급의 기능(지표)성분이며, 각종 채소와 과일에 널리 분포되어 있는 것으로 알려져 있다. 본 연구는 GABA 함량이 증진된 쌀 발효액을 제조하였다. GABA함량이 증진된 쌀 발효액은 쌀 당화액에 monosodium glutamate(MSG)를 첨가한 후, γ-aminobutyric acid(GABA)생성 능력이 뛰어난 3종 유산균 (Lactobacillus brevis, Lactobacillus plantarum, Leuconostoc mesenteroides) 복합물을 이용하여 만들었다. 쌀 발효액의 최종 이화학적 변화를 측정하였고, 발효액의 pH는 4.7, 총 수용성고형분은 22.1 °Brix로 나타났다. 이중 당 성분은 포도당 (39.6 mg/mL)과 엿당(12.7 mg/mL)이 주성분으로 분석되었으며, MSG를 모두 GABA로 변환함을 확인하였다. 본 실험 결과, 발효 쌀 당화액을 이용하여 2차 발효를 한 발효 쌀 당화액이 음료베이스에 적합하다고 할 수 있다. 본 발효 쌀 당화액은 기존의 쌀 발효물(증자된 쌀에 맥아를 이용한 식혜와 누룩을 이용한 당화 공정과 효모를 이용한 알코올 발효 공정이 복합적으로 일어나는 막걸리 이후 초산균이 발효하는 식초가 대표적)과는 차별적으로 쌀 당화액에 유산균을 이용하여 발효한 유산균 쌀 발효액이다.







