서 론
프로바이오틱스(probiotics)는 2001년 국제연합식량농업기구(Food and Agriculture Organization of the United Nations, FAO)와 세계보건기구(World Health Organization, WHO)에 의해 ‘적정량을 섭취했을 때 숙주의 건강에 도움을 주는 살아 있는 미생물’로 정의되었다(FAO/WHO, 2002). 최근 많은 연구들을 통해 프로바이오틱스는 인간 마이크로바이옴과 깊은 연관성이 있는 것으로 알려지면서, 장내 환경을 변화시키는 조절제로서의 기능에 대해 주목을 받고 있다(Sanders et al., 2018).
인간 마이크로바이옴은 인체와 공생하는 미생물 생태계를 의미하는 것으로, 2007년에 미국 국립보건원(NIH)에서 ‘휴먼마이크로바이옴 프로젝트(human microbiome project, HMP)가 출범하면서 본격적으로 연구되었다. 현재까지 8만 편이 넘는 관련 연구 논문이 축적되면서, 마이크로바이옴과 프로바이오틱스의 연관성이 상세히 밝혀지고 있다. 초기에는 인체 마이크로바이옴이 단순히 장내 소화 기능을 돕는 역할로 여겨졌었다. 그러나, 최근에는 여러 신체 질병과의 인과관계가 밝혀지고, 질병의 치료에 활용되는 수준까지 이르렀다.
프로바이오틱스의 섭취는 마이크로바이옴 조절기능을 통해 소화 촉진은 물론, 과민성 대장증후군(irritable bowel syndrome, IBS), 염증성 장질환(inflammatory bowel disease, IBD) 등 여러 질환의 개선에 도움을 주고, 감염성 질환이나 유해세균의 억제 기능도 하는 것으로 알려져 있다. 인체의 면역시스템을 증진시켜 아토피, 류마티스 등의 면역질환에도 효능이 있는 것으로 밝혀지고 있다(Maurya et al., 2014).
위와 같은 이유로 전세계적으로 프로바이오틱스 시장은 빠르게 성장하고 있다. 국내에서도 최근 3년간 주요 건강기능식품 원료 판매 추이를 보면, 프로바이오틱스 시장은 다른 건강기능식품 소재들에 비해서 큰 성장세를 이어가고 있다. 2020년 기준, 국내 건기식 원료판매액은 8,856억 원으로 전년(7,415억 원) 대비 20% 가량 증가하였다(한국건강기능식품협회, 2020). 현재 국내 식약처 가이드는고시형 원료로서의 프로바이오틱스의 기능성을 ‘유산균 증식 및 유해균 억제, 배변활동 원활, 장건강에 도움을 줄 수 있음’으로 고시하고 있다. 한편, 최근 5년 내 개별인정형으로 등록된 프로바이오틱스 원료를 살펴보면 면역과민반응 조절, 여성 질 건강 증진, 갱년기 여성 건강 증진, 체지방 감소와 관련된 기능들이다. 프로바이오틱스의 기능성이 장 건강은 물론 다양한 질환 개선 효능으로 확대되고 있다(식품안전나라, 2021).
건강기능식품분야도 크게 성장하면서, 프리바이오틱스(prebiotics), 신바이오틱스(synbiotics), 포스트바이오틱스(postbiotics)에 대해서도 많은 관심을 모으고 있다. 프리바이오틱스(prebiotics)는 ‘숙주의 미생물 중에서 건강에 도움을 주는 유익균에 의해 선택적으로 이용되는 물질’로 정의되는데, 유산균의 먹이가 되는 식이섬유와 올리고당이 대표적인 예이다. 신바이오틱스(synbiotics)는 이 프로바이오틱스와 프리바이오틱스가 함께 포함되어 있는 형태를 말한다(Pandey et al., 2015). 이때 단순히 혼합의 형태가 아니라, 숙주의 건강에 유익한 효능을 상승시키는 배합 처방을 통해 유익균의 장내 정착성과 대사물질의 생산으로 마이크로바이옴을 개선시키는 기능을 동반한다.
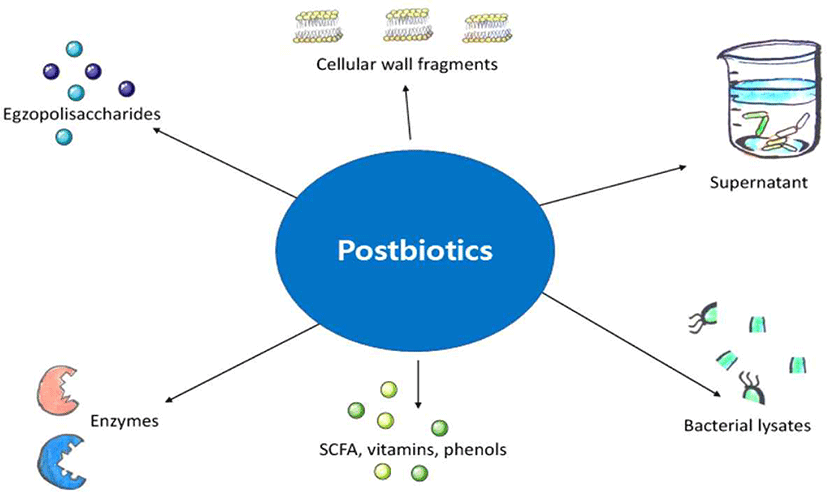
한편, 최근 주목받고 있는 포스트바이오틱스(postbiotics)는 프로바이오틱스가 생산하는 유용한 대사산물과 미생물의 구성성분을 포함하는 소재이다(Fig. 1). 국제 프로바이오틱스 ․ 프리바이오틱스협회(ISAPP)는 최근 네이처 총설 논문에서 포스트바이오틱스를 ‘숙주의 건강에 유익한 미생물의 살아 있지 않은 형태 또는 그 미생물의 성분이 포함된 제형’으로 명확하게 정의하였다(Salminen et al., 2021).
포스트바이오틱스는 기존 프로바이오틱스 소재가 갖는 안전성(safety), 기능성(function), 안정성(stability)의 한계를 극복할 수 있는 새로운 대안 소재로 주목받고 있다. 생균의 프로바이오틱스를 사균화 처리하여, 특정 대사물질의 복합물 형태로 제조되고 있기에 기존 생균제보다 가공, 포장, 유통, 섭취가 용이해지는 장점이 있다(Ouwehand et al., 2000). 따라서, 개발도상국들에서 생산과 보관 과정에서 발생하는 어려움을 해결할 수 있다. 프로바이오틱스가 갖는 부작용이 우려되는 면역력 저하 환자나 영유아, 노인층이 좀 더 안전하게 섭취할 수 있다는 장점이 있다(Deshpande et al., 2018). 한편, 기존 프로바이오틱스가 갖는 다양한 질환 개선 효능도 동등하게 유지되는 것으로 여러 연구 결과들이 보여주고 있다(Kataria et al., 2009). 이런 장점들로 포스트바이오틱스를 활용한 건강기능식품들이 향후 다양한 형태로 출시될 것으로 예상된다. 본 논문에서는 포스트바이오틱스에 대한 정의, 종류, 효능에 대하여 설명하고, 건강기능식품 개발을 위한 활용에 대해 설명하고자 한다.
본 론
포스트바이오틱스는 ‘숙주의 건강에 유익한 미생물의 살아 있지 않은 형태 또는 그 미생물의 성분이 포함된 제형’이다. 즉, 건강에 유익한 미생물인 프로바이오틱스(probiotics)가 식이섬유 또는 올리고당과 같은 프리바이오틱스(prebiotics)를 영양원으로 이용하여 생성한 대사산물이나 세포 자체의 구성성분이 포함된 제재를 의미한다.
포스트바이오틱스는 프로바이오틱스와 유사한 효능을 갖고 있으며, 개별 프로바이오틱스 미생물이 생성하는 대사물질을 통해 다양한 기능성을 획득할 수 있다. 국제 프로바이오틱스 ․ 프리바이오틱스협회(ISAPP)가 최근 발표한 논문에서는 “Preparation of inanimate microorgansms and/or their components that confers a health benefit on the host”라고 정의하였다(Salminen et al., 2021). 이 정의에 의하면 미생물이 생성하는 대사물질뿐만 아니라, 미생물 그 자체도 포함하는 것으로 기술하였다.
실제 사균화된 유사균에 대한 학술적 개념은 이미 오래 전부터 여러가지 용어로 유사하게 사용되어 왔다. 가령, ‘parabiotics’, ‘parapsychobiotics’, ‘ghost probiotics’, ‘metabiotics’, ‘tyndalized probiotics’, ‘heat-killed probiotics’, ‘bacterial lysates’ 등이 대표적인 유사 용어들이다. 이들 용어들에 대한 명확한 개념과 활용 여부에 대해서는 추후 학계와 관련 기관들에 의해서 구체적으로 정리될 것으로 예상된다.
포스트바이오틱스는 프로바이오틱스에 의해서 생성되는 다양한 대사물질들을 포함하는데, 특히 단쇄지방산(short-chain fatty acids), 항균펩타이드(antimicrobial peptide), 비타민, 효소, 세포외다당류, 세포벽성분 등이 대표적이다(Fig. 2). 이들 유산균 대사물질의 생체 내 효능은 다음과 같이 보고되어 있다.
-
단쇄지방산 (Short-chain fatty acids): 식이섬유 섭취시 장내 유익균들이 분해하여 생성한 짧은 사슬 지방산(6개 미만의 탄소원자)으로, 장 상피세포의 주요 에너지원으로 사용되고, 장내 환경을 산성으로 만들어 유익균들이 잘 증식하도록 도와주는 기능을 한다(Sanna et al., 2019). 젖산(lactic acid), 초산(acetic acid), 인산(phosphoric acid), 푸마르산(fumaric acid), 구연산(citric acid), 사과산(malic acid), 뷰티르산(butyric acid), 개미산(formic acid), 프로피온산(propionic acid), 카프릴산(caprylic acid) 등이 대표적인 예이다.
-
항균펩타이드 (Antimicrobial peptides): 일반적으로 유산균은 다양한 항균물질을 생성하여 병원균이나 부패균을 억제하는 기능을 가지고 있다. 대표적인 항균물질인 박테리오신(bacteriocin)은 유산균이 생성하는 항균펩타이드로 내성이 적고, 유해균의 성장을 억제하므로 여러 식품에 천연 방부제로 활용이 가능하다. 대표적인 예로, Lactococcus lactis에 의해 생성되는 Nisin은 미국 FDA에서 허가된 물질로 C. difficile 과 같은 유해균을 억제한다. 이들 항균펩타이드는 식품 보존제의 원료가 되며, 항생제 내성균이나 요로감염균의 치료제로도 활용된다(Delves-Broughton et al., 1996).
-
비타민 (Vitamins): 비타민은 미량으로 물질대사와 생리작용 조절에 중요하게 관여하는 유기화합물로, 대부분은 체내에서 직접 만들지 못하므로 외부 섭취를 통해서 보충한다. 그러나 식이로 보충가능한 비타민군(vitamin A, D, E 등)과 달리 일부 비타민군(folic acid-89, cobalamin-B12, riboflavin-82 등)은 장내 미생물이나 프로바이오틱스 균주들에 의해서 합성되어 체내에서 간접적으로 흡수된다. 실제로 장내에 우점하는 미생물들을 대상으로 유전체를 분석한 결과, 8개의 비타민 B군(biotin, cobalamin, folate, niacin, pantothenate, pyridoxine, riboflavin, thiamin)에 대한 생합성 유전자를 갖는 종이 다수 존재하였다(Magnúsdóttir et al., 2015). 또한 일부 유산균 종에는 리보플라빈 생합성에 필요한 유전자(ribA, ribB, ribG, ribH) 를 유전체 내에 보유하고 있는 것으로 확인되었다(Thakur et al., 2016).
-
세포외다당류 (Exopolysaccharides): 미생물이 생산하는 다당류의 종류 중 세포벽 외부에 점질 형태로 존재하는 세포외다당류(exopolysaccharides, EPS)는 세포벽 주위에 형성되는 협막(capsule)이나, 세포벽 외부에 축적되는 점질(slime) 등을 포함한다. EPS는 구조적 특성으로 인해 다양한 물성을 지니고 있고, 배양액으로부터 쉽게 수확할 수 있는 장점을 가지고 있어 산업적 가치가 높다. 현재 물성증진 효과, 유화제, 응집제, 접착제 등과 같이 식품, 농업, 화학 분야에서 광범위하게 활용되고 있다(Andhare et al., 2014). 유산균이 생산하는 EPS를 이용하여 제조된 요거트에서 점도를 높이고, 떡과 같은 식품의 저장성을 높인 것이 대표적인 사례이다(김수현 등, 2005). 뿐만 아니라, 유산균이 생산하는 EPS가 항산화작용, 콜레스테롤 저하, 면역조절작용 등의 다양한 효능을 보인 연구결과도 보고되어 있다(Labeer et al., 2011).
-
효소 (Enzyme) : 유산균이 생성하는 효소는 체내에서 소화할 수 없는 식물유래 탄수화물을 분해함으로써 칼로리 섭취를 도와주고, 다양한 생리활성 물질인 비배당체 화합물로 변환시킬 수 있는 기능이 있다. 대표적인 예로, 배당체 가수분해효소(glycoside hydrolases), 다당체 분해효소(polysaccharide lyases) 등이 있다. 그 외에도 유산균 세포에 존재하는 단백질이 항염, 독성물질 흡착 등의 기능에 관여하는 것으로 밝혀진 바 있다(Kumar etal., 2009).
-
세포벽성분(Cell wall component): 유산균 세포벽 성분으로 펩티도글리칸(peptidoglycan), 지질 단백질(lipoprotein), 테이코산(teichoic acid) 등이 있는데, 이들 성분들이 생체내에서 다양한 유익기능을 수행한다. 유산균에서 추출한 펩티도글리칸이 면역조절작용, 항염 작용을 하는 것으로 보고된 바 있다(Shida et al, 2009). Lactobacillus paracasei D3-5의 사균체에서 분리한 테이코산은 고지방 다이어트로 유도된 대사증후군 유발 쥐에서 장내 염증을 완화하고, 운동과 인지능력을 향상시킨 것으로 보고되었다(Wang et al., 2020).
포스트바이오틱스에 포함된 아미노산, 항균 펩타이드, 단쇄 지방산은 장내 유익균의 증식 및 유해균을 억제하는 효능을 나타내며, 특히 장점막 재생에 효과적인 것으로 알려져 있다. 살아 있는 형태가 아니기 때문에 프로바이오틱스와 달리 위산과 담즙산에 영향을 받지 않고 장까지 이동하여 장내 유해균을 억제시키며, 장을 보호하는 역할을 한다. 장누수증 환자의 경우, 섭취한 프로바이오틱스 생균이 혈관으로 유입되면 패혈증의 위험이 있지만, 사균체로 섭취할 경우 부작용이 거의 없는 것으로 보고되었다. 따라서, 포스트바이오틱스는 소아 및 중증의 병에 걸리거나 면역력이 약화된 환자들에게도 사용이 가능하다(Deshpande et al., 2018). 이런 장점으로 건강기능식품과 의약품의 원료로 다양하게 활용할 수 있다. 포스트바이오틱스의 장내 마이크로바이옴 영향은 숙주와 대사물질의 상호작용에 기인한다. 즉, 대사물질과 사균체는 유전물질 전달, 숙주 세포와의 신호 전달 등으로 장내 투과성과 면역 반응을 유발하여 장내 마이크로바이옴에 영향을 미친다.
실제 사례로, 사균화한 L. casei 균주를 대상으로 in vitro 실험 조건에서 macrophage가 면역 반응을 보였고, 염증 cytokine과 Toll-like receptor (TLR-2, TLR-3, TLR-4)의 발현을 증가시킨 연구 결과가 있다(Wang et al., 2013). 열처리 사균화된 Bifidobacterium 균주가 궤양성 장염 환자에서 유래한 장세포에서 IL-8 분비를 저해함으로써 면역, 항염증 작용을 일으킨 결과도 보고되었다(Imaoka et al., 2008). Bifidobacterium breve C50과 Streptococcus thermophilus 065의 유래 물질로 실험한 결과, dendritic 세포의 생존과 성숙을 증가시켰고, IL-10 생산을 유도하였다. 대사물질은 마우스 실험에서 세포장벽을 강화하고, Th1 반응을 증가시켰다(Menard et al., 2005). 세포외다당류(EPS)도 항궤양증, 항산화, 콜레스테롤 저하능에 효능을 보였고, L. plantarum 70810 유래 EPS는 HepG-2, BGC-823, HT-29 등의 암세포를 저해하는 것으로 보였다(Wang et al., 2014). 이러한 사균체 및 대사물질에 대한 실제 효능은 인체 적용시험을 통해 추가적인 검증이 필요하다. 다양한 포스트바이오틱스에 대한 in vitro 실험과 동물실험은 점차 증가하고 있지만, 실제 인체 적용시험 사례는 상대적으로 많지 않은 상황이다.
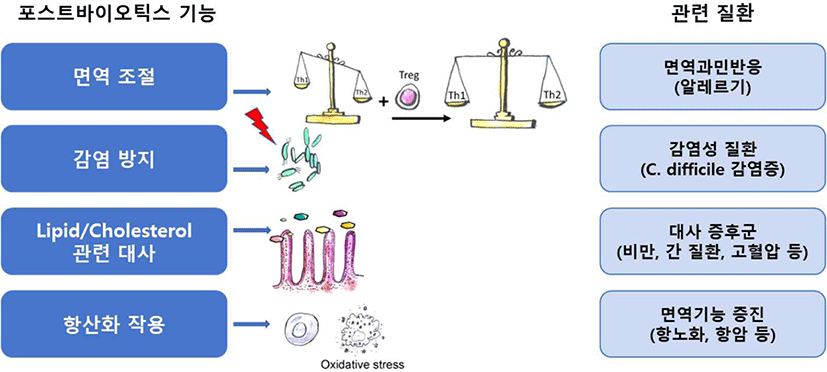
포스트바이오틱스는 프로바이오틱스와 마찬가지로 체내에서 면역조절, 감염방지, 지질 및 콜레스테롤 대사, 항산화 작용 등에 영향을 미치는 것으로 알려져 있다(Mantziari et al., 2020). 해당 기능들은 면역, 간, 장, 비만, 노화 및 암을 포함한 다양한 질환의 개선에 적용될 수 있다(Fig. 3). 그 외에도 장내환경 개선과 시력 개선 등의 효능도 보고되어 있다.
포스트바이오틱스는 면역체계의 기능을 조절함으로써 면역을 강화하기도 하고, 과민 면역 반응을 억제하기도 한다. 세포외다당류(EPS)의 한 종류인 β-글루칸은 대식세포 표면의 Dectin-1 수용체와 상호 작용하여 박테리아, 바이러스, 기생충 및 암세포에 대한 세포 면역 반응을 향상시킨다. 또한 장 상피에 대한 유산균의 부착을 촉진함으로써 프로바이오틱스의 효능에 긍정적인 영향을 미친다(Oerlemans et al., 2020). Cyclophosphamide로 유도된 면역저하 마우스를 대상으로 L. plantarum nF1의 사균체를 투여한 결과, 여러가지 면역지표(IL-12, TNF-α, IFN-γ)를 증가시키고, 자연살해세포(NK cell)와 대식세포를 활성화하여 면역기능을 증진시킨 것으로 확인되었다(Choi et al., 2018; Moon et al., 2019). 사균화 효소 제품으로 이미 제품화된 OM-85 BV는 알레르기성 비염의 빈도를 줄이고, 아토피 성 피부염의 증상을 완화시키는 것으로 보고되었다. 또한 어린이의 천명 및 천식 악화 빈도를 줄이는 데도 효과가 있음이 보고되었다(Koatz et al., 2016).
CDI 감염증(Clostridioides difficile infection)은 장내 병원성 세균인 C. difficile에 의한 감염성 질환이다. 보통 복통, 설사 및 발열이 동반되고, 광범위한 항생제 사용 후 장에서 발생하는 염증 등을 유발하며 생명을 위협할 수 있다. CDI 감염증의 치료를 위해 항생제를 사용하고 있지만, 이로 인한 독성과 내성의 문제가 발생하여 새로운 CDI 치료기술의 개발이 요구되고 있다. 포스트바이오틱스가 포함된 다양한 프로바이오틱스가 CDI의 치료와 예방에 대해 연구된 바 있는데, Lactobacillus casei, L. bulgaricus 및 Saccharomyces cerevisiae를 생균제로 복용한 결과, 항생제로 인한 설사와 CDI를 완화시키는 효능을 보였다(Hickson et al., 2007). L. plantarum nF1의 열처리 사균체의 효능을 시험한 결과, 영유아의 대변을 변화시키고, 가스 발생으로 인한 복부 불편감을 해소하는 것으로 확인되었다(Lee et al., 2019).
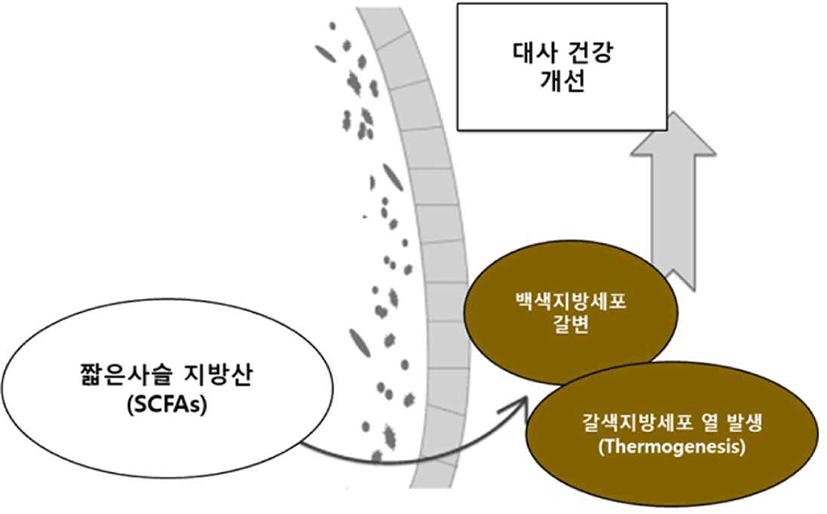
단쇄지방산(SCFAs)인 Propionate와 Butyrate는 다양한 기전을 통해 포도당 신생합성(gluconeogenesis) 유전자의 발현을 유도하고, 장내에서 포도당 신생합성을 활성화시켜 체중과 지방세포를 감소시킨 연구가 보고되었다(Han et al., 2018). 또한, 동물실험에서 Acetate가 열발생(thermogenesis)과 관련하여 백색지방조직(WAT)과 갈색지방조직(BAT)의 갈변을 증가시킨 사례가 보고되었다(Reynés et al., 2019)(Fig. 4).
세포 구성성분의 일종인 세포외다당류(exopolysaccharides)는 콜레스테롤 흡수를 억제함으로써 지질 대사에 긍정적인 영향을 미친 연구 결과를 보였다(Khalil et al., 2018). Lactobacillus kefiranofaciens으로부터 생산된 EPS(exopolysaccharides)의 섭취로 콜레스테롤 유도 모델 쥐의 혈압 상승을 예방하고 혈당 수치를 안정화시켰으며, 동맥경화증의 발생을 지연시킨 것으로 확인되었다(Caggianiello et al., 2016). 이러한 연구결과들은 EPS가 심혈관 질환을 예방할 수 있는 유용한 포스트바이오틱스 소재임을 증명한다.
Lactobacillus fermentum과 L. delbrueckii 균주의 사균체 Lactobacillus LB는 인체 장에서 Bifidobacterium을 증가시키는 Bifidogenic 효과를 유도하는 것으로 보고되었다(Warda et al., 2021). 포스트바이오틱스의 섭취가 눈 건강에도 영향을 미치는 것으로 연구되었다. 열처리 사균화된 Lactobacillus paracasei를 섭취하면 LED 화면에서 방출되는 청색광에 장기간 반복적으로 노출될 때 발생하는 안구 건조증의 증상을 개선하는 것으로 보고되었다 (Morita et al., 2018).
결 론
포스트바이오틱스는 프로바이오틱스, 프리바이오틱스 소재들과 더불어 마이크로바이옴의 조절제로서 건강 증진에 유용한 소재이다. 단독사용은 물론, 기존 소재들과의 혼합 사용이 가능하여, 다양한 건강기능식품 개발에도 적용이 가능하다. 한편, 프로바이오틱스의 단점을 보완할 수 있는 많은 가능성이 있음에도, 포스트바이오틱스 소재들이 널리 활용되기 위해서는 해결되어야 할 과제들도 있다. 사균화 처리공정, 대사산물의 분리, 정제, 분석에 대한 표준화, 효능 검증, 제품 품질관리 등이 확립되어야 한다. 다양한 질환 개선에 대한 구체적인 효능 연구도 아직은 부족한 상황이다. 또한 국내의 경우, 사균화 처리나 공정화를 위한 표준화와 대량 생산 시설이 부족하고, 관련 법과 제도도 아직은 충분하지 않다. 관련 식품 법규상 프로바이오틱스 대사체를 직접 상용화하는 것은 현재로서는 매우 어렵기에, 대사물질의 직접적 활용보다는 사균체 중심의 제품으로 한정될 수밖에 없다. 향후 이런 단점들을 보완하기 위해 기능성 포스트바이오틱스의 발굴과 원료표준화, 대량 생산, 임상시험에 대한 정부와 기업의 활발한 투자가 이루어져야 한다. 또한, 포스트바이오틱스 소재와 제품에 대한 건강기능식품 인허가 가이드라인도 마련되어야 할 것이다.
요 약
포스트바이오틱스(postbiotics)는 프로바이오틱스(probiotics)가 발효과정 중 생산하는 유용한 대사산물과 미생물의 구성성분을 포함하는 개념이다. 포스트바이오틱스는 기존 프로바이오틱스 소재가 갖는 안전성(safety), 기능성(function), 안정성(stability)의 한계를 극복할 수 있는 새로운 대안 소재로 주목받고 있다. 사균화 처리과정으로, 특정 대사물질의 복합물 형태로 제조되고 있기에 기존 생균제보다 가공, 포장, 유통, 섭취가 용이하다. 면역력이 낮은 환자나 건강 취약 계층의 소비자들도 안전하게 섭취할 수 있는 것도 장점이다. 뿐만 아니라, 체내에서 면역 조절, 감염 방지, 지질 및 콜레스테롤 대사, 항산화 기능을 보이고 있어, 앞으로 건강기능식품 우수 소재로 활용될 가능성은 더 커질 것이다. 다만, 대부분의 연구들이 아직은 세포실험과 동물시험인 단계이기에 실제 인체적용 시험을 마친 소재들은 적은 편이다. 향후 꾸준한 연구성과를 바탕으로 다양한 기능을 가진 포스트바이오틱스 소재와 제품들이 개발된다면 건강기능식품 산업에 새로운 성장동력이 될 것으로 예상된다.