서 론
보리(Hordeum vulgare)는 세계적으로 소비가 많은 곡물 중 하나로서 단백질, 지방질 및 무기질 등의 영양성분을 고르게 함유하여 영양학적으로 매우 우수하다(Park et al., 2018). 또한 보리가 지닌 여러 생리활성으로 인해 소비자의 관심은 증대되었으나, phytic acid와 전분의 강한 결합구조로 인하여 식감이 떨어지는 단점이 있다(Ju et al., 2007). 이러한 측면에서 기존의 주식 원료인 쌀이나 보리, 밀을 발아시켜 식감과 건강 기능성을 향상시키는 연구가 다수 진행되고 있다(Park et al., 2018; Kim et al., 2011). 보리를 발아시키면 phytic acid와 전분이 분해되어 식감과 소화성을 개선할 수 있을 뿐만 아니라 amylase, protease, phytase 및 β-glucanase와 같은 다양한 효소들에 의해서 γ-aminobutyric acid (GABA), 아미노산, arabinoxylan, 비타민 E 등 다양한 생리활성 물질들의 함량이 증가된다(Cha et al., 2012). 쌀보리는 껍질이 잘 분리되어 주로 식용으로 사용되고, 겉보리는 가공특성상 식용보다는 녹말질을 얻기 위한 원료로 사용되고 있다(Kim 과 Park, 1995). 본 연구에서는 겉보리에 대한 연구는 미미한 실정이어서 겉보리를 기질로 이용하여 고체발효생산 연구를 수행하였다.
고체발효법(solid-state fermentation, SSF)은 잉여수분이 최소화된 고체의 표면에서 부착 미생물을 배양하는 발효방법으로 고체기질은 고착 표면뿐만 아니라, 탄소원 및 질소원으로 사용된다(Robinson et al., 2001). 한편, Aspergillus속의 균주들은 다량의 단백질을 분비하는 능력, 효소의 대량생산에 적합한 발효 특성, 식품 및 사료 사용의 안전성 등의 이유로 고체발효생산에 많이 이용되고 있다(Sandhya et al., 2005). 또한 Aureobasidium pullulansKCCM60122는 흑효모라고 알려진 균류로 낮은 점도와 작은 분자량(약 100 kDa)의 수용성 β-l,3/l,6-glucan을 생성하는데, 이 β-l,3/l,6-glucan은 암세포 생장과 간 전이를 억제하는 데 효과가 있다고 보고되어 있다(kimura et al., 2006). 따라서 본 연구에서는 A. oryzae NIBRFGC000501965와 A. pullulansKCCM60122의 단독 또는 혼합발효를 통해 효소 및 β-glucan 생산에 대한 연구를 진행하였다.
본 실험의 목적은 겉보리를 고체 기질로 사용하여 A. oryzae NIB RFGC000501965를 이용한 액체발효(liquid state fermentation, LSF)와 고체발효(SSF)의 효소 및 β-glucan 생산에 대한 profile을 검토하였고, 또한 β-glucan 함량을 증가시키기 위해 보리 발아(germination)시간에 따른 SSF, 그리고 A. oryzae NIBRFGC 000501965와 A. pullulansKCCM60122의 혼합발효를 통해 효소 및 β-glucan 생산에 대한 연구를 수행하였다.
실험 재료 및 방법
본 실험에서 사용된 겉보리(Hulled barley)는 소화농장(Yecheon- gun, Korea)에서 구매하였으며, 실험에 사용된 시약들은 reagent grade로 Sigma Chemical Co.(St. Louis, MO, USA)로부터 구매하였다. 또한 Aspergillus oryzae NIBRFGC000501965는 국립생물자원관 (NIBR, Incheon, South Korea)에서 분양받았으며, Aureobasidium pullulansKCCM60122는 (사)한국종균협회 부설 한국 미생물보존센터 (Korean Culture Center of Microorganisms, Daejeon, Korea)에서 분양받아 사용하였다.
A. oryzae NIBRFGC000501965에 대한 seed culture는 액체발효 배지를 250 mL flask (working volume 100 mL)에서 121°C에서 15분간 멸균한 배지를 사용하였으며, seed culture에 포자 1 × 108spores/mL를 접종하여 shaking incubator에서 30°C에서 150 rpm으로 48 h 배양하였다. 액체발효배지 조성은 70 g/L 겉보리 분말, 5 g/L soytone, 6 g/L ascorbic acid (vitamin C)으로, 추가 배지성분 5 g/L K2HPO4, 0.25 g/L MgSO4를 따로 멸균하여 접종 전에 액체발효 배지에 첨가하였다. 한편, A. pullulansKCCM60122에 대한 seed culture는 DifcoTM Potato Dextrose Broth (Becton, Dickinson and Company, Sparks, MD, USA)를 250 mL flask (working volume 100 mL)에서 제조하였으며, 5% (v/v)로 접종한 후 shaking incubator (30°C, 150 rpm)를 이용하여 48 h 동안 배양하였다.
겉보리 발아는 4°C에서 24시간 동안 수침시킨 보리를 물에 충분히 적신 솜이 깔린 500 mL stainless steel rectangular tray (CY- 1070; 260 × 170 × 50 mm, Chunyangsa Co., Ltd., Seoul, Korea)에서 30°C, 습도 50% 조건의 항온항습기(DS-150 TM; Daewon Science, Bucheon-si, Korea)를 이용하여 각각 24, 48, 72 h 동안 발아시켰다.
겉보리 또는 발아된 겉보리 100 g과 150 mL의 증류수를 500 mL stainless steel rectangular tray(CY-1070; 260 × 170 × 50 mm, Chunyangsa Co., Ltd., Seoul, Korea)에 넣어 121°C에서 60분간 멸균한 후 상온에서 냉각하였다. 무균 조건 하에서 액체배지 5 mL를 첨가배지로 rectangular tray에 첨가한 뒤, A. oryzae NIBRFGC000501965와 A. pullulansKCCM60122 균주들을 각각 10 mL씩 단독 또는 혼합 형태로 접종하고 혼합하여 고체발효를 진행하였다. 고체발효는 항온항습기를 이용하여 온도 30°C, 습도 50-70 %에서 고체발효를 수행하였으며, 일정 시간마다 발효시료를 채취하여 동결건조기 (BFD85-F8; IlShinBioBase Co. Ltd., Dongducheon, Korea) 를 통해 동결 건조하였다. 샘플들을 미분쇄한 후 amylase, protease, ergosterol, β-glucan 등의 활성 및 농도를 분석하였다.
조효소액은 시료 1 g에 증류수 20 mL를 넣고 진탕 교반하여 추출 후 100 mL로 정용하고, 여과한 것을 조효소액으로 사용하였다. Amylase 활성 측정을 위해서 1% 전분용액과 조효소액 1 mL를 37°C에서 15분간 반응시킨 후 2 mL의 3,5-dinitrosalicylic acid를 넣고 100°C의 항온수조에서 5분간 반응시켰다. 이후 실온으로 냉각하여 UV/Vis 분광광도계(EMC-18PC-UV, EMCLAB®, Germany)를 이용하여 540 nm에서 흡광도를 측정하였다. 조효소액 1 mL에 의해 분해되는 전분의 μmol 수를 효소활성단위 1 unit으로 하여 시료 1 mL 당 환산하여 표시하였다(Qureshi et al., 2016).
Protease 활성 측정을 위해서 0.1M phosphoric acid로 pH 7로 조정한 0.6% casein 용액 1 mL에 조효소액 1 mL를 혼합하여 37°C 에서 10분간 반응시켰다. 이후 2 mL의 0.4 M trichloroacetic acid 를 혼합하고, 37°C에서 25분간 반응시킨 다음, 원심분리기(Centrifuge FLETA-5, Hanil Science Co., Ltd, Korea)를 이용하여 원심분리 (994 × g, 5 min) 하였다. 여액 1 mL에 0.4 M sodium carbonate 5 mL와 Folin reagent 용액 1 mL를 혼합하여 37°C에서 30분간 발색한 후 UV/Vis 분광광도계(EMC-18PC- UV, EMCLAB®, Germany)를 이용하여 660 nm에서 흡광도를 측정하였다. 조효소액 1 mL에서 1분간 1 μmol의 tyrosine을 유리할 때 1 unit로 하여 시료 1 mL당 환산하여 표시하였다(Qureshi et al., 2016).
에르고스테롤(ergosterol)은 고등균류 균사세포막의 중요한 구성 성분으로 균의 생장에 중요한 기능을 한다. 따라서 균사배양체에서 이 물질의 함량을 분석함으로써 고체상 배지 속에 있는 곰팡이의 균체량을 추정하였다(Mille-Lindblom et al., 2004). 시료 0.5 g을 정밀하게 취하여 0.07 M potassium hydroxide (in methanol) 10 mL에 첨가하여 shaking incubator (30℃, 150 rpm)에서 1 h 동안 추출하였다. 추출한 용액을 원심분리 (994 × g, 5 min) 하여 새로운 tube에 옮겨 0.1 M HCl 200 μL를 첨가하였다. 상등액에 있는 ergosterol를 VisiprepTM SPE vaccum Manifold (Merck KGaA, Darmstadt, Germany)과 C-18 SPE colum (Discovery® DSC-18 SPE Tube, Sigma-Aldrich, Supelco, USA)을 이용하여 여과분리한 뒤, isobutanol 2 mL를 첨가하여 ergosterol을 용출하였다. 이후 ergosterol 농도는 HPLC (Agilent 1200 Series; Agilent Technologies, Santa Clara, CA, USA)와 UV detection (282 nm)을 통해 분석을 진행하였다. 컬럼은 SUPERSIL ODS I-C18 column (250 × 4.6 mm) 를 사용하여 injection volume 10 μL, 컬럼온도 30°C, 이동상 100% methanol을 1 mL/min의 유량으로 설정하여 분석하였다.
베타글루칸은 β-glucan kit (K-BGLU, Megazyme, Chicago, IL, USA)으로 효소 분해 후 UV/Vis 분광광도계(EMC-18PC-UV, EMCLAB®, Germany)로 510 nm에서 흡광도를 측정하여 kit 분석법으로 계산하여 산출하였다. 시료 약 100 mg에 50% 에탄올 0.2 mL와 20 mM 인산완충용액 (pH 6.5) 4.0 mL를 순차적으로 가하여 5분간 교반하고 끓는 물에서 2분간 방치한 후 리체네이스(lichanase, Megazyme, Bray, Ireland) 0.2 mL (10 U)을 가하여 50°C에서 1시간 동안 처리하였다. 효소처리액에 200 mM 아세트산 완충용액(pH 4.0) 5.0 mL를 가하여 반응을 종료시킨 후 원심 분리 (994 × g, 5 min) 하여 상층액을 취하였다. 상층액 0.1 mL를 3개의 시험관에 각각 넣은 후 하나의 시험관에는 50 mM 아세트산 완충액(pH 6.0) 0.1 mL를 가하고, 나머지 시험관에는 베타글루코시데이스(β-glucosidase, Megazyme, Bray, Ireland) 0.1 mL(10 U)를 가하여 50°C에서 10분간 방치하였다. 효소가수분해액에 GOPOD (glucose oxidase/peroxidase, Megazyme) 3.0 mL를 가하고 50°C에서 20분간 방치한 후 510nm에서 흡광도를 측정하여 β-glucan의 함량을 계산하였다(Lee et al., 2012).
실험결과 및 고찰
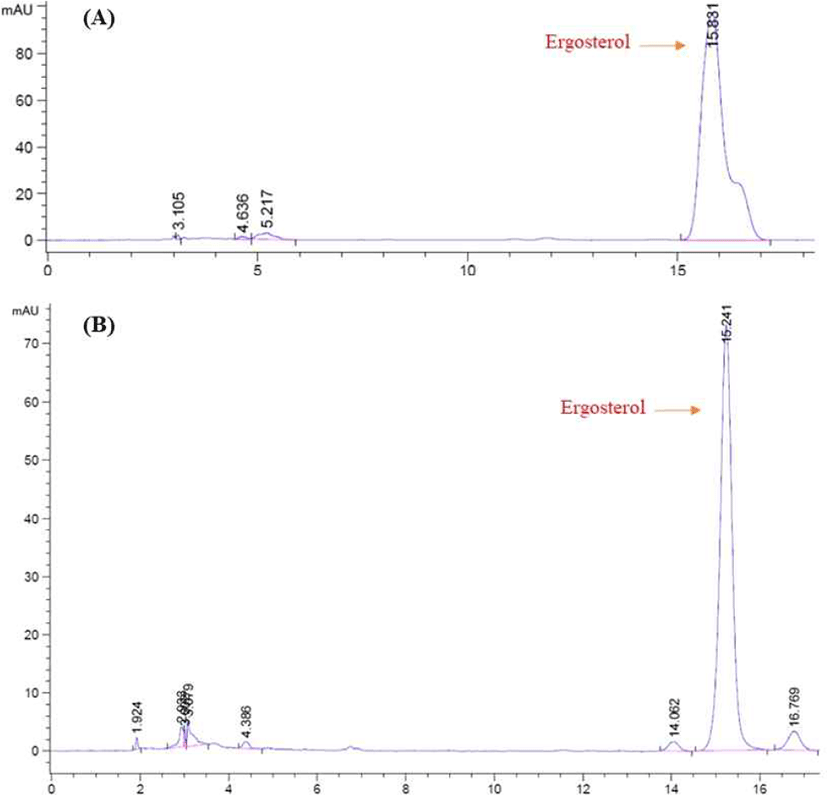
에르고스테롤(ergosterol)은 고등균류의 세포막에 있는 주요한 스테롤로서 식물이나 다른 미생물에는 거의 없고, 살아 있는 균류의 세포에만 있는 특징물질이다. 따라서 고체발효 동안 균체량을 추정하기 위해 발효 샘플로부터 ergosterol을 추출하여 HPLC 분석방법을 이용하여 정량분석하였다(Fig. 1). 그 결과, Fig. 1 (A)는 ergosterol 성분의 HPLC standard peak이며, Fig. 1 (B)는 A. oryzae NIBRFGC000501965를 이용한 고체발효에서 샘플의 ergosterol을 추출한 뒤 측정한 HPLC 분석결과이다. Fig. 1 (A)에서 standard 용액의 ergosterol은 15.8 min에서 peak를 확인하였다. 또한 Fig. 1(B)에서 고체발효물의 ergosterol은 15.2 min에서 peak가 나타났으며, 이 peak 면적을 ergosterol 표준곡선에 대입하여 함량을 구하였다.
A. oryzae NIBRFGC000501965를 이용한 액체발효는 250 mL Erlenmeyer flask에서 working volume 100 mL로 30°C, 150 rpm, 120 h 동안 발효를 진행하였다. 그 결과, Fig 2(A)에서 효소 및 β-glucan은 48 h가 가장 높은 농도를 생산하였고, fungal biomass, amylase, protease, 그리고 β-glucan 함량은 0.15 mg/g, 12589.65 U/g, 3279.77 U/g, 3.03% (w/w) 등으로 나타났다. 따라서 종균 생산을 위한 액체발효는 48 h 동안 배양하는 것으로 진행하였다.
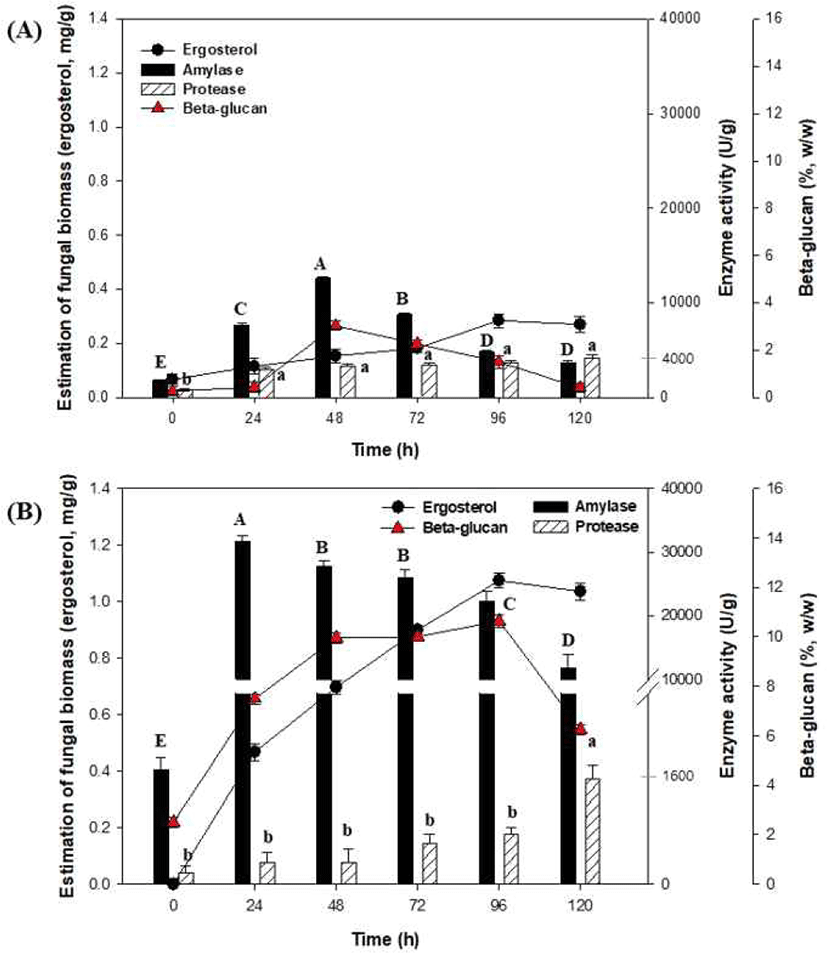
한편, A. oryzae NIBRFGC000501965를 이용한 고체발효는 500 mL rectangular tray에 겉보리 100 g과 150 mL의 증류수를 넣어 121°C에서 60분간 멸균한 후 냉각한 고체배지에 종균 10 mL를 접종하고 혼합하여 120 h 동안 고체발효(온도 30°C, 습도 50%)를 진행하였다. 그 결과, Fig 2(B)에서 세포성장(ergosterol)은 96 h에 stationary phase로 진입하였다. 고체발효 동안 amylase 생산은 초기 24 h 에 31655.17 U/g으로 가장 높은 활성을 나타내었고 이후 감소하는 경향을 보였다. 반면, protease생산은 120 h에서 가장 높은 효소활성(1,662.04 U/g )을 나타내었으며, 이때 수분함량은 54%로 측정되었다(data not shown). 이는 Sivaramakrishnan et al.(2007)의 논문에서 초기 수분함량이 증가할수록 α-amylase 생산이 증가하고, 수분함량이 낮아질수록 효소생산이 감소한다는 보고와 일치하였다. 그리고 발효 96 h 동안 β-glucan 함량이 10.6% (w/w)로 생산되었고, 이후 6.3%(w/w)로 감소하였다. 이는 Lambo et al.(2005)의 논문에서 native oat와 barley fiber 농축액을 이용한 LAB 발효에서 β-glucan 함량이 크게 감소하는 연구결과와 일치하였다. 유산균에 의한 발효과정 중 β-glucan 함량이 감소하는 메커니즘은 명확하지 않지만, 셀룰로스 분해와 유사한 효소 분해일 가능성이 높다(Schwarz, 2001).
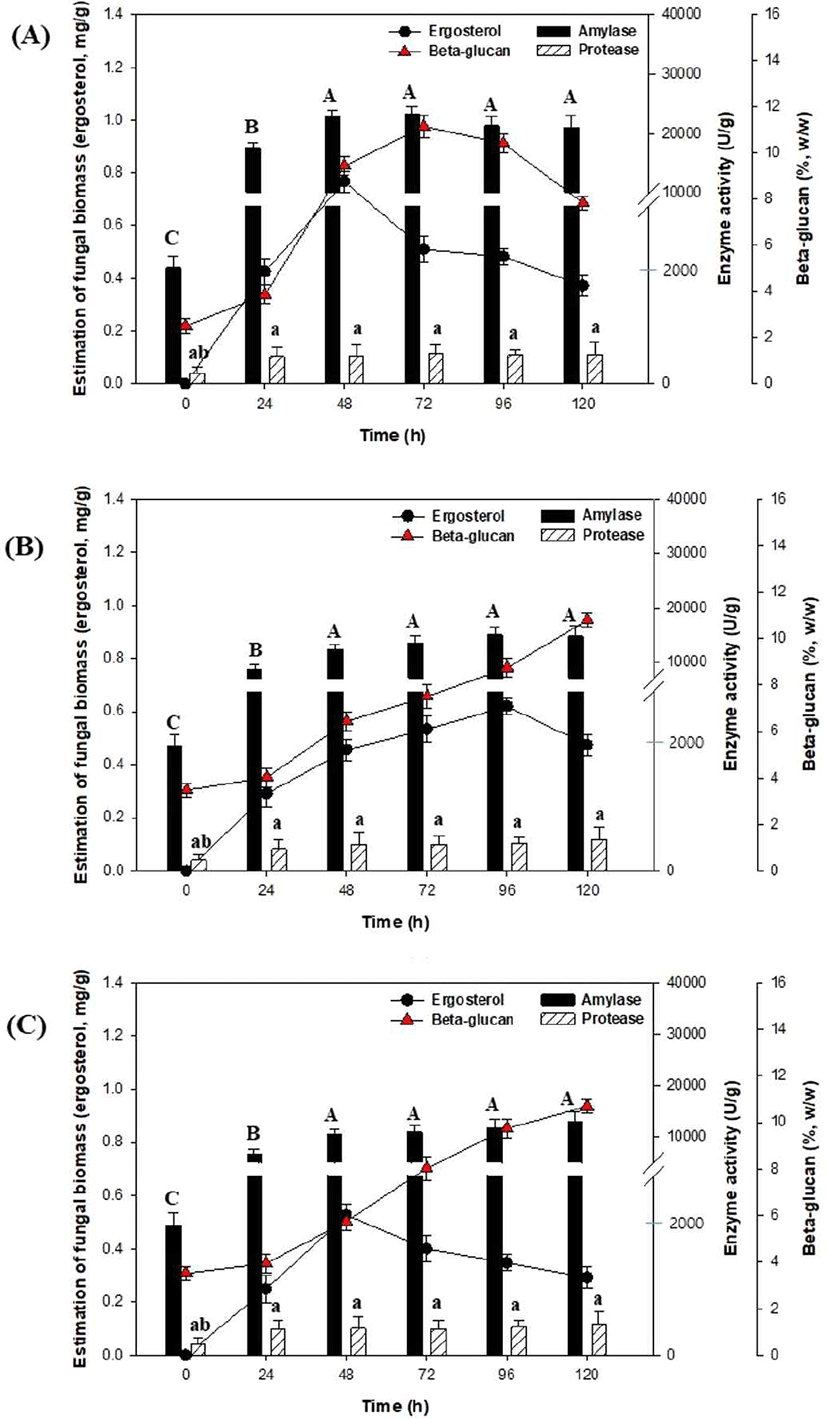
겉보리 발아 시간(24 h, 48 h, 72 h)에 따른 고체발효 결과는 Fig. 3과 같다. Fig. 3(A)의 고체발효 결과(겉보리 발아 24 h), 세포성장(ergosterol)은 48 h에 0.76 mg/g으로 증가한 이후 감소하는 결과를 나타내었다. 또한 고체발효 동안 효소생산은 48 h에 amylase (23,293.10 U/g)와 72 h에 protease (512.6 U/g) 활성이 가장 높게 나타났으나, Fig. 2(B)의 겉보리를 발아하지 않는 효소생산과 비교하였을 때 효소 활성은 감소하였다. 반면, β-glucan 함량은 72 h에 11.2% (w/w)로 증가하였다. 겉보리 발아를 48 h (Fig. 3 (B))와 72 h (Fig. 3 (C)) 진행한 고체발효 결과, 효소 활성과 β-glucan 함량은 크게 증가되지 않았으며, 수분함량은 120 h에서 22-30%로 측정되었다(data not shown). 또한 겉보리 발아 시간(24 h, 48 h, 72 h)에 따른 고체발효는 모두 발효시간에 따라 pH가 5.5에서 4.2로 감소하였는데(data not shown), 이와 같은 pH 감소는 곡물의 수용성 물질(유기산, 지방산 등)의 용출과 미생물의 생육 때문으로 설명되고 있다 (Kim and Bang, 1996; Chun et al., 2004). 고체발효는 free flowing water가 최소화된 상태에서 교반 없이 고정층에서 미생물을 배양함으로 고체배지 중의 수분함량, 온도, pH 및 열분포를 균일하게 유지하는 것이 어려운데, 향후 곡류 발아에 따른 고체발효에서 수분함량, 온도 및 pH 조절법에 대한 추가적인 연구가 필요할 것으로 생각된다.
겉보리에 포함된 β-glucan 함량을 증가시키기 위해 A. oryzae NIBRFGC000501965와 A. pullulansKCCM60122 균주의 혼합배양을 통해 고체발효를 수행하였다. 각각의 균주들을 배양한 종균으로부터 10 mL씩 접종하고 혼합하였으며, 항온항습기를 이용하여 온도 30°C, 습도 50% (Fig. 4(A)), 60% (Fig. 4(B)), 70% (Fig. 4(C))에서 고체발효를 수행하였다. 그 결과 Fig. 4(A)에서는 효소 및 β-glucan은 48 h가 높은 농도를 생산하였고, fungal biomass, amylase, protease, 그리고 β-glucan 함량은 0.81 mg/g, 31051.72 U/g, 1106.55 U/g, 10.7% (w/w) 등으로 나타났다. 이는 고체기질 내의 수분함량은 산소 및 영양분의 확산에 중요한 매개체 작용을 하기 때문에 수분함량이 낮을 경우(50% 이하)에는 함수율 감소로 인해 영양분과 기체 공급제한이 발생하여 세포성장 저해의 원인이 되었으며, 그 결과 효소 및 β-glucan 생산 감소가 발생했다고 판단된다(He and Chen, 2013; Nampoothiri et al., 2004; Yu et al., 2017).
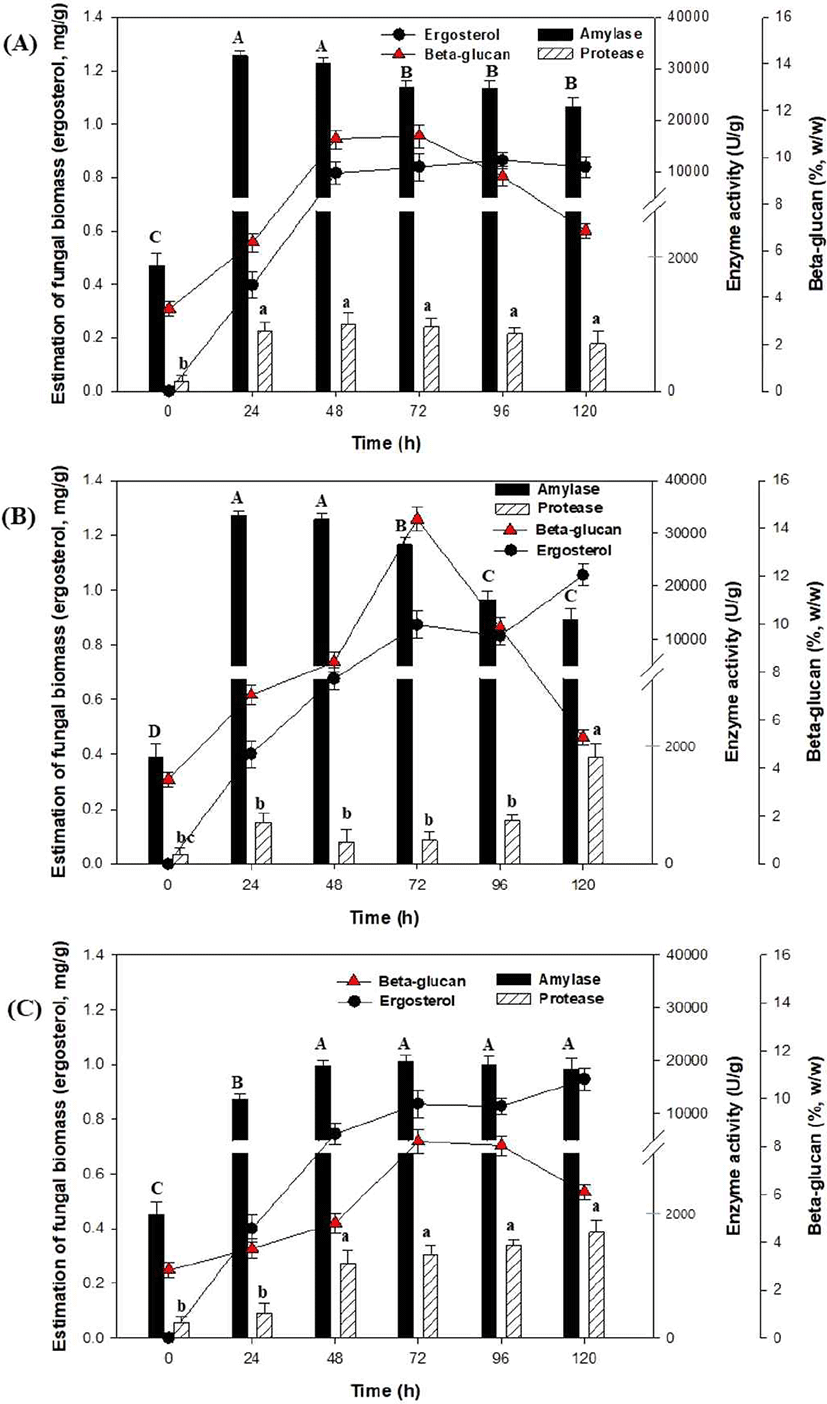
또한, Fig. 4(B)에서는 고체발효 동안 효소생산은 24-48 h에 amylase (33,206.89 U/g)와 120 h에 protease(1,735.9 U/g) 활성이 가장 높게 나타났으며, β-glucan 함량은 72 h에서 13.3% (w/w)로 나타났다. 반면, Fig. 4(C)에서 나타난 바와 같이 배양 습도를 70%로 유지하여 고체발효를 진행하였을 때, 고체발효 생성물들은 기존 고체발효(습도 50-60%)에 비해 크게 증가하지 않았다. 이는 적정 수준 대비 높은 수분함량에서는 잉여수분이 발생하여 통기율 제한, 채널링(channeling), 산소공급 저해 및 균사체 성장 저해가 발생하여 세포성장 및 효소생산을 저해한다고 알려져 있다(EI-Naggar et al., 2009).







