서 론
김치는 배추나 무 등의 채소 주재료에 소금, 고춧가루, 마늘, 생강, 젓갈 등의 양념을 혼합하여 발효시킨 한국의 대표적인 전통발효식품으로 유산균이 풍부한 건강식품으로 인식되고 있다(Kim et al., 2020).
김치 유래 주요 유산균으로 Lactobacillus 속, Leuconostoc 속, Pediococcus 속, Weissella 속 등이 속한다. 특히 김치 유래 유산균은 오랜 기간 동안 김치의 발효에 이용되어 왔기 때문에 식용 가능한 안전한 미생물(GRAS, generally recognized as safe)로 간주되고 있을 뿐만 아니라, 프로바이오틱스(probiotics)로서 활용가치가 높다고 알려지고 있다(Hwang et al., 2020). 프로바이오틱스는 ‘적절한 양을 섭취하였을 때 숙주의 건강에 유익한 작용을 하는 살아있는 미생물’로, 기본적으로 장내 정장작용(유해균 억제 및 유익균 증식)과 배변활동에 도움을 주며, 그 외에도 균주의 특성에 따라 면역조절 작용, 항산화 활성, 콜레스테롤 저하, 항당뇨, 항비만 등 다양한 생리활성을 나타낸다는 것이 밝혀지고 있다(Kim et al., 2018; Quinto et al., 2014).
요구르트(yogurt)는 우유 또는 탈지유에 유산균을 스타터로 접종하여 발효시킨 것으로 젖산, 펩타이드, 펩톤 등의 생리활성 물질을 함유하고 있을 뿐만 아니라 정장작용, 유당불내증 억제, 변비 개선 등 건강에 유익한 효과가 있으며, 이러한 생리활성은 유산균의 기능성에 기인하는 것으로 알려지고 있다(Sung and Choi, 2014). 최근 기능성 식품에 대한 소비자의 관심이 높아지면서 학계와 산업계에서는 기존의 요구르트에 복분자, 구기자, 홍삼, 마늘, 알로에, 오미자, 유자 등과 같은 식물성 기능성 원료를 첨가하여 생리활성이 강화된 요구르트 제품을 개발하려는 연구가 활발히 이루어지고 있다(Cho et al., 2007; Kim and Lee, 1997; Kim et al., 2008; Lee et al., 2008).
인삼(Panax ginseng C. A. Mayer)은 오가과(Araliaceae)의 인삼속(Panax)에 속하는 다년생 초본식물로 한국과 중국을 비롯한 동양에서 오랫동안 뿌리를 약용으로 이용하고 있다. 인삼에는 인삼사포닌, 페놀성분, 폴리아세틸렌, 알칼로이드, 산성다당체, 비타민 등 다양한 생리활성 성분들이 함유되어 있는데, 그 중에서 진세노사이드(ginsenoside)라고 불리는 인삼사포닌 성분이 약리적 효능을 발휘하는 유효성분으로 가장 주목을 받고 있다(Tark et al., 2009).
홍삼은 인삼의 껍질을 벗기지 않고 증숙한 후 건조하여 가공한 인삼으로, 열처리 과정에서 수삼이나 백삼에 존재하지 않는 진세노사이드 Rg3 등이 생성되고, 인삼에 미량으로 존재하는 저분자 진세노사이드의 함량이 증가되기 때문에 항암작용, 혈압강하 작용, 뇌신경 세포 보호작용, 항혈전작용, 항산화작용 등 약리적 효능이 수삼과 백삼에 비해 우수하다고 보고되고 있다(Bao et al., 2005; Jung et al., 1998; Keum et al., 2000; Kim et al., 1999; Yue et al., 2006). 현재까지 유산균과 홍삼의 생리활성에 대한 연구는 활발히 이루어져 왔으나, 프로바이오틱스 유산균과 홍삼을 활용한 기능성 요구르트의 개발에 대한 연구는 매우 미흡한 실정이다. 특히 기존에 보고된 연구는 0.5-1.0%의 저농도 홍삼 추출물을 원료로 이용하여 수행되었기 때문에 홍삼의 생리활성을 발휘하기에는 어려운 실정이다(Jang et al., 2018; Kim et al., 2008).
본 연구에서는 김치로부터 내산성, 내담즙성 및 항산화 활성이 우수한 유산균을 분리하였으며, 최종 선발된 2종의 균주에 대하여 상용균주와 비교하여 프로바이오틱스 균주로서 개발 가능성을 검토하였다. 또한 프로바이오틱스 활성이 우수한 2종의 균주를 스타터로 이용하여 고농도의 홍삼 추출물을 첨가한 요구르트를 제조하고 그 품질 특성과 항산화 활성을 평가함으로써 기능성이 강화된 요구르트를 개발하고자 하였다.
재료 및 방법
실험재료로 사용된 홍삼은 충청남도 금산인삼도매시장에서 판매하는 홍미삼을 구입하여 사용하였다. 발효유의 기질로 탈지분유(Namyang Dairy Product Co., Ltd, Seoul, Korea)와 우유(Maeil milk, Asan, Korea)를 시중 대형마트에서 구입하여 사용하였다. 유산균은 경기도 안양 지역의 가정에서 담근 배추김치를 시료로 이용하여 분리하였으며, 상업용 유산균인 Lacticaseibacillus rhamnosus GG(KCTC 5033)는 생물자원센터에서 분양 받아 사용하였다. 항산화 분석에 이용된 Folin & Ciocalteu's phenol, Na2CO3, gallic acid, DPPH, ethanol 등은 Sigma-Aldrich Co.(St. Louis, MO, USA)에서 구입하였다.
증류수 200 mL에 홍삼 시료 10%(w/v)를 첨가한 후 80℃의 항온수조(C-10B, Chang Shin Co., Hwaseong, Korea)에서 24시간 동안 열수 추출을 진행하였다. 24시간 추출 후 회전감압농축기(SB-1200, EYELA, Tokyo, Japan)를 이용하여 30 brix까지 농축하고, 동결건조기(FDU-1200, EYELA, Tokyo, Japan)에서 24시간 동결건조하여 홍삼 추출분말을 제조하였다.
김치 시료(25 g)에 멸균 생리식염수 225 mL를 첨가하고 Stomacher (BagMixer 400W, Interscience, Saint Nom, France)를 이용하여 3분 동안 마쇄하였다. 마쇄된 용액을 십진법에 의해 희석한 후 DeMan Rogosa Sharpe(MRS, DifcoTM, MD, USA) 고체배지에 도말하고, 37℃에서 24시간 배양하였다. 배양 후 균락의 크기가 큰 단일 콜로니를 선별하여 BCP 고체배지(Eiken chemical Co., Ltd., Japan)에 도말하여 배양한 후, 젖산 생성에 의해 노란색을 나타내는 콜로니를 최종 선별하였다. 선별된 유산균은 MRS 액체배지에 접종하여 배양한 후, 25%(v/v) glycerol stock으로 –70℃의 deep freezer(NF-140SF, Nihon Freezer Co., LTD., Tokyo, Japan)에 보관하여 사용하였다.
선별된 유산균주의 형태학적 특성을 현미경(AE31 Trinocular, Microscope World, Carlsbad, USA)을 이용하여 관찰하였으며, Gram 염색 및 catalase 활성을 확인하였다. 선별된 유산균주의 동정을 위하여 16S rRNA gene sequencing을 진행하였다. 유전자 증폭은 universal rRNA gene primer(27F and 1492R)를 사용하여 수행되었으며 전기영동으로 PCR 산물의 증폭 여부를 확인하였고, 각 과정은 BIOFACT사(Daejeon, Korea)를 통하여 진행하였다. 분석된 16S rRNA sequencing 결과는 National Center for biotechnology Institute(NCBI)의 BLAST online program (http://www.ncbi.nlm.nih.gov/blast)을 이용하여 Genbank database와 비교하여 동정하였다.
유산균의 내산성과 내담즙성은 Lertcanawanichakul 등(2015)의 방법을 일부 수정하여 진행하였다. MRS 액체배지에서 배양(37℃, overnight)한 유산균 배양액을 OD600 = 1.0으로 조정한 현탁액을 실험에 사용하였다. 내산성은 0.3% pepsin(Sigma-Aldrich, MO, Wyoming, USA)이 첨가된 MRS 액체배지(pH 3.0)에 유산균을 접종하고 3시간 반응시킨 다음 MRS 고체배지에 도말하여 배양한 후 생균수를 측정하여 균의 생존율을 확인하였다. 내담즙성은 0.3% oxgall(DifcoTM, MD, Kansas, USA)이 함유된 MRS 액체배지에 유산균을 접종하여 24시간 반응시킨 다음 MRS 고체배지에 도말하고 배양한 후 생균수를 측정하여 균의 생존율을 확인하였다.
유산균의 항균활성은 Paper disc diffusion assay(Kim et al., 1999)를 이용하여 측정하였다. 병원성 지시균으로 Escherichia coli KCTC 1039, Staphylococcus aureus KCCM 11335, Salmonella Typhimurium KCTC 2515, Listeria monocytogenes KCTC 40307을 사용하였다. MRS 액체배지에서 배양(37℃, overnight)한 유산균 배양액 1.5 mL를 원심분리(12,000 × g, 4℃, 5 min, CT15RE, Hitachi Chemical Co., Ltd., Tokyo, Japan)한 후 상등액을 취하고 0.45 μm Syringe filter를 사용하여 균체를 제거하였다. 지시균주는 Tryptic soy broth(DifcoTM, MD, Kansas, USA)에 각각 접종하고 37℃에서 overnight 배양하여 얻어진 배양액을 동일한 농도로 희석한 후 고체배지 표면에 접종하고 멸균한 면봉으로 도말하였다. 지시균주가 도말된 평판배지 위에 8 mm 직경의 paper disc를 올려놓고 균체가 제거된 유산균 상등액을 100 μL씩 균일하게 분주한 후 37℃에서 24시간 배양하였다. 유산균주의 항균활성은 paper disc 주변에 형성된 억제환의 크기를 측정하여 확인하였다.
유산균의 auto-aggregation과 co-aggregation 능력은 Tareb 등(2013)의 방법을 일부 수정하여 진행하였다. MRS 액체배지에서 전 배양(37℃, overnight)한 유산균과 TSB 액체배지에서 전 배양(37℃, overnight)한 병원성 세균의 배양액(5∼10 mL)을 각각 원심분리(6,000 × g, 4℃, 10 min)하여 균체를 회수했다. 회수된 균체를 phosphate-buffered saline(PBS, pH 7.0) 용액으로 2번 세척한 다음 PBS 용액을 첨가하여 OD600 = 0.3으로 조정한 후 실험에 사용하였다. 유산균의 auto-aggregation 능력은 유산균 현탁액(OD600 = 0.3) 4 mL를 vortex하여 혼합한 후 37℃에 방치하면서 24시간에 600 nm에서 흡광도를 측정하고 다음의 계산식에 따라 계산하였다.
유산균과 병원성 세균과의 co-aggregation 능력은 유산균 현탁액(OD600 = 0.3) 2 mL와 병원균 현탁액(OD600= 0.3) 2 mL를 혼합하고 vortex한 후, 37℃에서 방치하면서 24시간에 600 nm에서 흡광도를 측정하고 다음의 계산식에 따라 계산하였다.
API ZYM kit(BioMerieux Co., Marcyl'Etoile, France)를 사용하여 유산균의 효소활성을 측정하였다. MRS 액체배지에서 24시간 동안 배양한 유산균을 원심분리(12,000 × g, 4℃, 10 min)한 후 상등액을 제거하고 PBS 용액으로 두 번 세척하여 균체를 회수하였다. 회수한 균체를 API KIT에 65 μL씩 분주하고 37℃에서 4시간 배양한 후 ZYM A와 ZYM B 시약을 각 kit에 한 방울씩 첨가하여 5분간 실온에서 반응시켰다. 이후 각 kit에서 색 변화를 관찰하여 기질 효소에 대한 활성 여부를 판독하였다.
항산화 활성 측정을 위하여 유산균과 요구르트 시료의 전처리를 진행하였다. MRS 액체배지에서 overnight 배양한 유산균을 원심분리(12,000 × g, 4℃, 10 min)한 후 상등액을 제거하고 PBS 용액으로 두 번 세척한 후 회수한 균체만을 시료로 사용하였다. 요구르트 시료의 경우, 요구르트 2 g을 80% methanol로 희석하고 37℃에서 30분 동안 sonication(JeioTech Co., Itd, Daejeon, Korea) 처리 후 원심분리(10,000 × g, 4℃, 10 min)하여 상등액만을 취하고 0.2 μm Syringe filter(WhatmanTM, Dassel, Germany)로 여과한 액을 사용하였다.
DPPH(1,1-diphenyl1-2-picrylhydrazyl) 라디칼 소거능은 Wang 등(2016)의 방법을 일부 수정하여 진행하였다. 시료 2 mL를 0.4 mM DPPH 에탄올 용액 2 mL와 혼합하고 30분 동안 실온의 암실에서 방치한 후 원심분리(12,000 × g, 4℃ , 10 min)하여 상등액을 회수하였다. 회수된 상등액에 대하여 517 nm에서 흡광도를 측정하고 다음의 계산식에 따라 DPPH 라디칼 소거능(%)을 계산하였다. 대조구는 증류수를 사용하였다.
β-Carotene bleaching assay는 Son 등(2017)의 방법을 일부 수정하여 진행하였다. 감압농축플라스크에 linoleic acid(Sigma- Aldrich, Wyoming, USA) 66 μL, β-carotene(Sigma-Aldrich, Wyoming, USA) 3 mg, Tween 80(Sigma-Aldrich, Wyoming, USA) 300 μL, chloroform(Daejung Chemical Co., LTD, Gunpo, Korea) 10 mL를 첨가하고 혼합한 다음 감압농축기로 40℃에서 chloroform을 증발시킨 후 증류수 75 mL를 추가하여 β-carotene-linoleic acid 시약을 완성하였다. 시료 200 μL를 β-carotene-linoleic acid 시약 4 mL와 혼합하고 항온수조(50℃, 2시간)에서 반응시킨 후 470 nm에서 시료의 흡광도를 측정하고 다음의 계산식에 따라 β-carotene bleaching inhibitory activity(%)를 계산하였다. 대조구로는 PBS 용액을 사용하였다.
홍삼 추출분말의 gensenoside 함량은 Park 등(2021)의 방법에 따라 HPLC를 이용하여 분석하였다. 사용한 HPLC 장치는 HPLC 1260(Agilent, Santa Clara, CA, USA)이며, column은 Zorbax SB-C18(4.6 × 150 mm, 5 μm, Agilent, USA)을 사용하였다. 홍삼 동결건조 분말은 증류수 100 mL에 5%를 첨가하여 용해시킨 후 원심분리(13,000 × g, 4℃, 10 min)를 하여 상등액을 0.45 μm Syringe filter를 이용하여 여과한 후 분석에 사용하였다. 이동상은 water(A)와 Acetonitril(B)를 사용하여 B를 기준으로 30%(0분), 60%(20분), 90%(30분), 30%(31분)으로 농도 변화를 주었으며, column의 온도는 30℃, 유속은 1.0 mL/min으로 설정하였다(Zhou et al., 2008). 크로마토그램은 Diode array detector (Agilent, USA)를 이용하여 203 nm에서 검출하였다. 사용한 표준물질은 총 8종이며, 각각 표준검량선을 대입하여 함량을 계산하였다.
홍삼 요구르트 제조를 위해 시판우유(Maeil milk, Asan, Korea) 200 mL, 탈지분유 2%(Namyang Dairy Product Co., Ltd, Seoul, Korea), 정제포도당 1.5%(ES food, Gunpo, Korea)가 첨가된 발효 배지에 홍삼 추출분말을 각각 1, 2, 5, 10%씩 첨가하고 90℃에서 10분간 살균처리를 진행하여 홍삼 요구르트 제조 배지로 사용하였다. 프로바이오틱스 활성이 높은 균주 2종(L. plantarum SY46 또는 L. brevis SY65)을 요구르트 발효용 종균으로 선정하여 실험을 진행하였다. MRS 액체배지에서 overnight 배양한 유산균 배양액을 원심분리(12,000 × g, 4℃, 10 min)한 후 상등액을 제거하고, 증류수로 두 번 세척하여 회수한 균체를 사용하였다. 요구르트 제조용 starter로 단일 균주 또는 복합 균주를 사용하였다. 홍삼 추출분말이 첨가된 우유 배지에 L. plantarum SY46 또는 L. brevis SY65 균주를 각각 0.1%(v/v) 접종하거나, 두 균주를 1:1비율로 0.05%(v/v)씩 접종한 후 37℃에서 24시간 배양하여 홍삼 요구르트를 제조하였다.
pH meter(pH / Ion S220, Mettler-Toledo AG 8603, Ohio, USA)를 사용하여 pH를 측정하였고, 총산 함량은 시료 5 g을 100 mL로 mess up하고 삼각플라스크에 25 mL를 분주한 후 1% phenolphthalein 용액을 1방울 넣고, 0.1 N NaOH 용액으로 중화 적정하여 환산계수가 0.009인 젖산 함량(%)으로 나타내었다. 유산균 생균수는 발효액 시료를 멸균한 생리식염수에 10단계로 희석한 후, 희석액을 MRS 고체배지에 도말하여 37℃에서 24시간 배양한 후 나타난 콜로니 수를 측정하였다.
결과 및 고찰
멸균수로 희석한 김치 시료를 BCP 고체 배지에 접종하여 37℃에서 24시간 동안 배양한 후 젖산 생성에 의해 노란색을 나타내는 단일 군락을 유산균으로 판단하였다. 분리된 유산균 군락 중에서 노란색 환의 형성이 빠르고 크기가 상대적으로 큰 50개의 콜로니를 산 생성 능력이 우수한 균주로 간주하고 선별하였다. 선별한 균주를 대상으로 내산성, 내담즙성, 항산화활성 및 생육실험을 실시하여 SY46과 SY65 2종의 균주를 최종 선발하였다. 선별된 2종의 형태와 특성을 확인한 결과, Gram 양성균으로 catalase 음성 반응을 나타냈고 운동성이 없으며 포자 형성을 하지 않는 간균으로 확인되었다. 선별 균주의 16S rRNA 유전자 염기서열을 NCBI database에서 표준 균주들과 비교하여 상동성을 검토한 결과 Lactiplantibacillus plantarum SY46과 Levilactobacillus brevis SY65로 규명되었고 각각 99.10% 이상의 높은 상동성을 나타내며 동정되었다.
유산균이 체내에서 생리적 기능을 발휘하기 위해서는 기본적으로 pH 3.0 이하의 위장을 통과한 후 소장까지 도달하여 생존해야 한다(Lim et al., 2019). 인공위액에서 L. plantarum SY46은 83.20%, L. brevis SY65는 84.94%의 생존율을 나타내었으며, 상업균주인 L. rhamnosus GG(LGG)의 79.80%와 비교하여 높은 생존율을 보였다(Table 1). Gou 등(2010)은 체내에서 위액의 pH는 약 3.0으로 유지되며, pH 3.0의 조건에서 3시간 이상 생균수를 유지하면 일반적으로 산에 대한 내성이 있는 것으로 간주하였으며, Lim 등(2019)은 프로바이오틱스 활성이 있는 L. plantarum B19 균주가 인공위액에서 86.0%의 생존율을 나타낸다고 보고하였다. 담즙염에 대한 내성은 프로바이오틱스 균주가 소장에서 살아남기 위해 지녀야 할 특성으로, 담즙산은 미생물의 세포막에 영향을 주어 성장을 억제하는 것으로 알려졌다(Chu and Kook, 2019). 선별된 균주의 담즙염에 대한 내성을 확인한 결과, L. plantarum SY46은 86.80%, L. brevis SY65는 86.19%로 상업균주인 LGG(80.08%)보다 높은 생존율을 나타내었다(Table 1). 따라서 본 연구에서 분리한 2종의 유산균주들은 상용균주와 비교하여 우수한 내산성 및 내담즙성을 나타내어 생균제로서의 가치가 충분할 것으로 판단되었다.
선별된 유산균의 병원성 미생물에 대한 항균활성 결과는 Table 2와 같다. Paper disc 방법을 이용하여 E. coli, S. aureus, L. monocytogenes, S. Typhimurium 등 4종의 세균에 대하여 항균활성을 비교한 결과 L. plantarum SY46와 L. brevis SY65 균주는 5.3-9.7 mm의 저해환을 형성하여 병원성 미생물의 생육을 억제하는 것으로 나타났다. 일반적으로 유산균은 대사산물로 생성된 젖산과 아세트산 등의 유기산 외에 bacteriocin, hydrogen peroxide, diacetyl 등의 항균 물질을 생성하여 병원성 세균과 부패성 세균의 생육을 억제한다고 알려져 있다(Ouwehand, 1998). 따라서 본 연구에서 선별된 균주를 발효유의 스타터로 이용할 경우, 유해세균의 증식을 억제하여 장내 균총을 개선하는 효과를 기대할 수 있을 것으로 사료된다.
프로바이오틱스 균주가 장관 내에서 유용한 작용을 발휘하기 위해서는 장세포에 부착할 수 있는 능력이 요구되며, 유산균의 auto- aggregation 실험은 유산균의 장세포 부착능을 간접적으로 확인할 수 있는 방법으로 이용되고 있다(Del Re et al., 2000). L. plantarum SY46의 auto-aggregation 능력은 59.73%로 상업균주인 LGG(57.37%)와 유사하였으나, L. brevis SY65는 49.12%로 다소 낮은 값을 보였다(Table 3). Tuo 등(2013)은 Lactobacillus 속 22종이 24.48-43.39%의 auto-aggregation 능력을 갖고 있다고 보고하여, 본 연구에서 선별된 L. plantarum SY46과 L. brevis SY65 균주의 장 부착능이 우수한 것으로 확인되었다.
유산균의 병원성 세균에 대한 co-aggregation 능력은 장내에서 병원성 세균을 억제하기 위한 중요한 요인으로 알려져 있다. 본 연구에서는 지시균으로 E. coli와 S. aureus 균주를 이용하여 선별된 유산균의 co-aggregation 능력을 측정하였다. L. plantarum SY46과 L. brevis SY65 균주는 E. coli에 대하여 52∼56%의 응집률을, S. aureus에 대해서는 50-55%의 응집률을 보였다. Son 등(2017)은 프로바이오틱스 활성이 높은 L. brevis KU15006 균주가 식중독균인 E. coli, S. Typhimurium, L. monocytogeges 균주에 대하여 50-65%의 응집율을 나타내었다고 보고한 바 있다. 상업 균주인 LGG는 장관 흡착능이 우수하다고 알려져 있어(Son et al., 2017), 본 연구에서 분리된 L. plantarum SY46과 L. brevis SY65 균주는 장관 흡착능과 병원균에 대한 응집력이 우수할 것으로 판단된다.
API ZYM kit을 이용하여 L. plantarum SY46과 L. brevis SY65 균주의 효소활성을 측정하였다(Table 4). 일반적으로 프로바이오틱스로 이용되는 유산균은 benzopyrene 등과 같은 발암성 전구물질이 간에서 무독화된 이후 장에서 발암물질로 재전환시키는 β-glucuronidase 효소를 생성하지 않아야 한다(Borriello et al., 2003). 선별된 2종의 균주 모두 발암효소인 β-glucuronidase에 대한 활성이 없는 것으로 확인되어 요구르트 제조에 사용 가능한 안전한 종균으로 판단되었다. 또한 선별된 균주는 유당분해효소인 β-galactosidase에 대한 높은 활성을 나타내어 유당불내증 저감화에 도움을 줄 수 있을 것으로 기대된다.
김치에서 분리된 유산균의 DPPH 라디칼 소거능과 β-carotene bleaching 억제능을 측정한 결과는 Table 5와 같다. 산화과정에서 생성된 free radical은 생체 내에서 생물학적인 분자를 공격하여 세포 손상을 일으키는 주요 요인으로 알려져 있다. DPPH 라디칼은 화학적으로 안정한 free radical로 DPPH 라디칼 소거능이 높다면 free radical을 환원시키거나 소거시키는 항산화 활성이 높다는 것을 의미한다(Lee et al., 1997). DPPH 라디칼 소거능 측정결과, L. plantarum SY46과 L. brevis SY65 균주는 각각 49.84%와 48.64%의 활성을 나타냈으며, 상업균주(45.17%)와 비교하여 유의적으로 높은 DPPH 라디칼 소거능을 나타내었다(p < 0.05). β-carotene bleaching assay는 황색의 β-carotene이 lipid peroxyl radical(LOO · )에 의하여 탈색화되는 것을 측정하는 방법으로(Choi et al., 2009), 상업균주(71.83%)와 비교하여 L. plantarum SY46과 L. brevis SY65 균주는 각각 80.23%와 76.16%의 높은 β-carotene bleaching 억제 능력을 나타내는 것으로 확인되었다(p < 0.05). 따라서 본 연구에서 선별된 2종의 균주는 지질과산화를 억제하는 능력이 우수하다고 판단된다.
홍미삼 열수추출물을 회전감압농축기로 농축하고 동결건조하여 홍삼 추출분말을 제조하였다. HPLC를 이용하여 홍삼 추출분말의 ginsenoside 함량을 분석한 결과, Rb1 23.70 mg/g, Rc 15.39 mg/g, Rh1 8.99 mg/g, Rd 6.69 mg/g, F2 2.35 mg/g, Rg3 2.88 mg/g을 함유하는 것으로 나타났다(Table 6). 홍삼 추출분말이 각각 1%, 2%, 5%, 10%씩 첨가된 우유배지에 L. plantarum SY46과 L. brevis SY65 단일 균주 또는 복합 균주(SY46+SY65)를 0.1%(v/v) 접종하고 40℃에서 24시간 배양한 후, pH, 적정산도 및 생균수를 측정한 결과는 Table 7과 같다. 유산균 starter를 첨가하여 24시간 배양한 결과, 홍삼 요구르트의 pH는 4.28-5.82, 적정산도는 0.36-1.53% 범위를 나타내었으며, 홍삼 추출분말의 첨가량이 증가할수록 홍삼 요구르트의 산도가 증가하고 pH가 감소하는 경향을 나타내었다. 유산균의 생균수는 5% 이상의 홍삼이 함유된 모든 시료에서 9 Log CFU/mL 이상으로 나타났으며, 홍삼 추출분말의 첨가량이 증가할수록 발효 후 높은 생균수를 나타내어, 고농도의 홍삼 추출물이 유산균의 생육과 산생성능을 높이는 것으로 확인되었다. L. plantarum SY46과 L. brevis SY65의 복합 균주로 발효한 경우 단일 균주에 비하여 높은 생균수를 나타내었으며, 5%와 10%의 고농도 홍삼 추출분말이 첨가된 시료에서 각각 9.26 Log CFU/mL와 9.90 log CFU/mL의 높은 생균수를 나타내었다.
| Ginsenoside (mg/g) | |||||
|---|---|---|---|---|---|
| Rb1 | Rc | Rh1 | Rd | F2 | Rg3 |
| 23.70±0.28 | 15.39±0.03 | 8.99±0.02 | 6.69±0.43 | 2.35±0.19 | 2.88±0.05 |
일반적으로 유산균 발효에 의한 젖산 등 유기산 생성에 따른 적정산도와 pH 값은 요구르트의 품질검사에 널리 이용되고 있다. Chamber(1979)와 Davis(1970)는 요구르트의 바람직한 pH 범위를 3.80∼4.5로, 적정산도는 0.70∼1.20% 범위로 제시하였다. Ko 등(2013)은 시판되는 농후 발효유-스터드 타입 요구르트 79종을 분석한 결과, pH는 3.85∼4.56, 농후 발효유-드링크 타입 요구르트 71종의 pH는 3.84∼4.51으로 보고하였다. 본 연구에서 홍삼 추출분말 5%를 첨가하여 복합균주로 24시간 발효한 홍삼 요구르트의 pH는 각각 4.46, 산도는 1.25%, 유산균 생균수는 9.26 Log CFU/mL로, 전체 시료 중에서 가장 바람직한 요구르트의 품질 범위 내에 있는 것으로 사료된다.
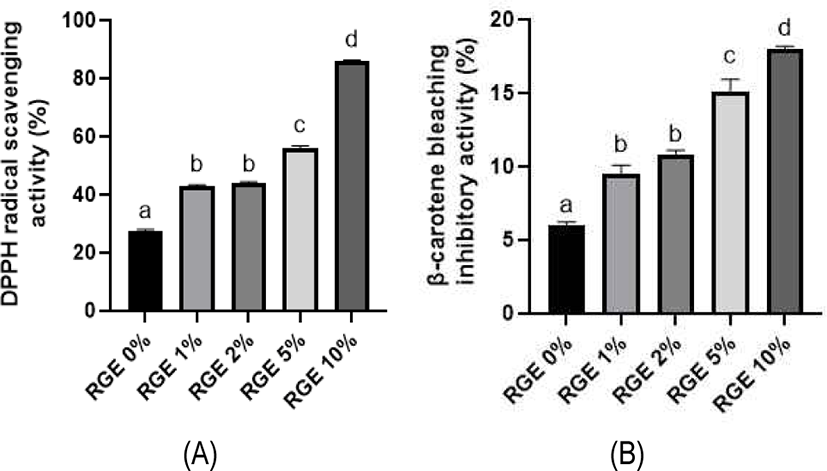
L. plantarum SY46과 L. brevis SY65 복합균주로 발효한 홍삼 요구르트의 DPPH 라디칼 소거능과 β-carotene bleaching 억제능을 측정한 결과는 Fig. 1에 나타내었다. 복합균주로 발효한 홍삼 요구르트의 DPPH를 측정한 결과 대조군(무첨가군)은 27.47%로 가장 낮은 값을 보였고, 1% 홍삼 추출분말 첨가군은 42.95%, 2% 첨가군은 43.84%, 5% 첨가군은 53.0%, 10% 첨가군은 86.14%의 값을 나타내어 홍삼의 첨가량이 증가할수록 항산화활성이 증가하는 것으로 나타났다. β-carotene bleaching 억제능 또한 홍삼의 첨가량이 증가할수록 높은 값을 나타내어, 대조군(5.98%)과 비교하여 5%와 10%의 홍삼 추출분말이 첨가된 요구르트의 경우, 각각 15.14%와 18.04%의 높은 지질과산화 억제능력을 나타내었다. 이는 홍삼 추출물에 함유된 고함량의 phenol과 flavonoid 성분뿐만 아니라, 단백질분해효소 처리와 유산균 발효에 의해 가용성 phenol과 peptide 성분이 증가된 것에 기인한다고 사료된다(Kim et al.; Landete et al., 2014; Park et al., 2013). 따라서 본 연구결과, L. plantarum SY46과 L. brevis SY65 복합균주를 활용하여 고함량의 홍삼과 프로바이오틱스 기능이 강화된 기능성 요구르트의 제조가 가능할 것으로 판단된다.
요 약
김치로부터 내산성, 내담즙성 및 항산화활성이 우수한 유산균을 분리하였으며, 프로바이오틱스 활성이 우수한 2종의 균주를 스타터로 선정하여 고농도의 홍삼 추출물이 보강된 요구르트를 제조하고, 그 품질특성을 평가하였다. 가정에서 제조된 배추김치로부터 분리한 L. plantarum SY46과 L. brevis SY65 균주는 인공위액과 담즙염에 대한 저항성, 병원균에 대한 항균활성 및 항산화활성이 상업용 프로바이오틱스 균주인 L. rhamnosus GG(LGG)와 비교하여 우수하였으며, auto-aggregation과 co-aggregation 능력은 유사한 특성을 나타내었다. 홍삼 추출분말 5%와 10%가 각각 첨가된 우유에 SY46과 SY65의 복합 균주를 접종하고 24시간 발효한 결과, 홍삼 요구르트의 pH는 각각 4.46과 4.28, 산도는 1.25%와 1.53%, 유산균 생균수는 9.26와 9.90 Log CFU/mL를 나타내었다. 홍삼의 첨가량이 증가할수록 DPPH 라디칼 소거능과 β-carotene bleaching 억제능이 증가되어, 유산균체의 항산화능과 더불어 홍삼이 요구르트의 항산화능을 높이는데 기여하는 것으로 나타났다. 따라서 본 연구결과, L. plantarum SY46과 L. brevis SY65 균주를 스타터로 활용하여 프로바이오틱스 및 홍삼의 기능성이 강화된 요구르트의 제조가 가능할 것으로 기대된다.







