서 론
프로바이오틱스는 적당한 양을 섭취할 시, 숙주의 건강에 이익을 줄 수 있는 살아있는 미생물이다 (FAO/WHO, 2001). 인체에서 복잡한 관계를 형성하고 있는 장내 미생물 군집은 생활 방식, 질병에 의한 항생제 복용 등에 의해 숙주의 질병과 건강상태에 영향을 줄 뿐만 아니라 장내 균총 자체의 변화를 유도할 수 있다(Wilkins et al., 2017). 프로바이오틱스는 염증 유발 사이토카인과 관련된 면역 시스템 조절, 유해균 장 정착 억제, 대사산물 생성, 장 투과성 정상화에 기여하여 숙주의 건강 유지에 중요한 역할을 한다(Wilkins et al., 2017). 이러한 프로바이오틱스를 코팅함으로써 저장 반감기 연장과 함께 가공 및 섭취 과정의 스트레스로부터 균을 보호하고 장 정착능을 향상시킬 수 있다(Kwon et al., 2021). 하지만 코팅 공정에서 프로바이오틱스는 탈수 작용에 의해 세포 표면에 존재하는 세포벽, 단백질, 지질, DNA 등이 손상될 수 있고, 이로 인해 섭취한 프로바이오틱스의 장내 부착능력과 같은 기능적인 비활성화가 발생할 수 있다(du Toit E et al., 2013; Perdana et al., 2013; Sehrawat et al., 2022).
프로바이오틱스의 장 체류 시간은 장내 미생물 조성 변화에 영향을 줄 수 있는 중요한 변수의 하나다(Rodes et al., 2011). 복용된 프로바이오틱스는 상부 위 장관(gut intestinal tract)을 지나서 장 미생물 군집의 일부가 되는 반면, 일부는 분변과 함께 배출된다(Yao et al., 2020). 그리고 프로바이오틱스의 장 내 체류시간의 증가는 장을 보다 더 유익균이 지배적인 환경으로 조성하고, 프로바이오틱스가 유익한 효과를 발휘할 수 있는 충분한 시간을 제공한다고 알려져 있다(Fernando et al., 2012; Gueimonde and Salminen, 2006). 따라서, 프로바이오틱스의 기능성을 극대화하기 위해서는 장 체류 시간을 늘리는 것이 중요하고, 이를 위해 균의 장 점막 부착성을 높이는 것이 중요하다(Celebioglu et al., 2018). 뮤신(mucin)은 거대 세포 외 당단백질로 수많은 올리고당 잔기들이 부착된 글리코실화된 구조를 갖고 있어, 점액에서 점도와 젤화 특성을 제공하는 역할을 한다(Celebioglu and Svensson, 2018). 점액층은 일반적으로 음성화된 전하를 띄고 있으며, 이런 점으로 인하여 음전하를 띄는 병원균과 유해 물질의 부착을 방해하는 효과를 갖는다(Celebioglu and Svensson, 2018; Kwon et al., 2021). 프로바이오틱스 장 부착능과 정착능은 장관 체류시간과 밀접한 연관성을 가지고 있으며, 유해균과의 경쟁적인 배제를 통한 장내 균총의 균형화, 장내 세균 효소 활성 조절, 장내 투과성의 안정화, 면역 조절 등 숙주에 유용한 영향을 지속적으로 미칠 수 있다는 점에서 중요하다(Celebioglu et al., 2018; Walker and Duffy, 1998).
선천 면역은 외부의 병원체로부터 숙주의 건강을 지키기 위한 첫번째 방어의 면역시스템이다(Marshall et al., 2018). 병원체가 숙주로 침입하였을 경우, 활성화된 대식 세포는 외부로부터 침입한 병원균을 파괴하기 위해 면역 조절 사이토카인(TNF-α, IL-1β, IL-6 등)을 분비하여 면역 시스템을 조절한다(Noh et al., 2022). 프로바이오틱스는 장 속의 균총을 조절하여 면역 시스템을 활성화하는데 중요한 역할을 한다고 보고되어 있다(Lehtoranta et al., 2020). 섭취된 프로바이오틱스는 장 속에서 정착하여 장 상피 세포의 수용체와 직접적인 상호작용 혹은 장 연관 림프 조직과의 잠재적인 상호작용을 하게 되어 면역 시스템 조절에 관여한다(Yousefi et al., 2019). 이러한 프로바이오틱스 중의 하나인 Streptococcus thermophilus 는 장벽 기능 강화, 병원균 부착 억제, 면역 시스템 조절 등 숙주에게 유용한 효과를 제공하는 다양한 연구가 진행되고 있다(Mizuno et al., 2020). 그 사례로, S. thermophilus 의 면역 조절 효과를 확인함으로써 S. thermophilus 발효 유제품의 섭취가 유용한 효과를 줄 수 있음이 확인되었다(Dargahi et al., 2021). 또한, 본 연구진은 S. thermophilus KCTC14471BP의 전장 유전체 분석을 통하여 면역력에 도움에 줄 수 있는 여러 exopolysaccharide gene cluster를 확인함으로써, 인체에서 유용한 효과를 줄 수 있음을 확인한 바 있다(Kim et al., 2021). 이전 연구에 이어, 본 연구에서는 S. thermophilus KCTC14471BP의 항생제 내성 및 효소 활성을 확인하여 프로바이오틱스 안전성을 평가하고, 뮤신 부착력을 검증하였다. 또한, MTT assay를 통한 세포 독성과 pro-inflammatory cytokines 확인을 통한 면역 조절 능력을 확인함으로써 실크 피브로인 코팅에 따른 면역 활성의 시너지 효과를 평가하고자 하였다.
재료 및 방법
Streptococcus thermophilus KCTC14471BP(ST-27)를 본 연구에서 사용하였다. 이 균주는 Coeuret 등(2003)의 방법에 따라 bromocresol purple(BCP, MB cell, Korea)배지를 사용하여 발효유로부터 분리하였다. 균주의 배양과 보존을 위해 deMan- Rogosa-Sharpe 배지(MRS, BD Difco, USA)를 이용하여 배양과 유지를 수행하였다.
실크 피브로인 코팅에 따른 효과를 보기 위해 Kwon 등(2021)의 방법에 따라 동결 건조하여 샘플을 제조하였다. 간략히 기술하면, 안정기에 도달된 ST-27을 high speed centrifuge(supra R12, Hanil Co., Korea)으로 11,500 ×g, 4℃으로 20분 동안 농축하였다. 1% 수용성 칼슘, 0.1% 실크 피브로인(SF)을 첨가하여 모두 용해됨을 확인한 다음, freeze dryer(freezone 12 L, Labconco Co., USA)으로 동결 건조하여 실크 피브로인 코팅 유산균 분말(SF-ST-27)을 얻었다.
ST-27의 효소 활성을 평가하기 위해 API ZYM kit(BioMerieux, France)를 이용하였다. 제조사의 프로토콜에 따라서 적절한 농도의 세균 시료를 각각 접종하여 37℃에서 4시간 배양하였다. 그 후 ZYM A와 ZYM B 시약을 각각 첨가하여 색 변화를 확인하였다. 색 변화로 기질 효소에 대한 활성 여부를 판독하였으며, 반응의 정도는 -(반응 없음)에서 +++(활발히 반응)으로 표현하였다.
ST-27의 항생제 감수성을 평가하기 위해 ampicillin, vancomycin, gentamicin, kanamycin, streptomycin, erythromycin, clindamycin, tetracycline, chloramphenicol의 E-Test(BioMerieux, France)를 구매하여 제조사의 프로토콜을 따라서 평가하였다. 1.2×108 CFU/mL의 농도로 희석한 세균 시료를 MRS agar plate에 면봉으로 도말 후 E-Test가 겹쳐지지 않도록 올리고 37℃에서 24∼48시간 동안 배양하였다. 이후 생성된 저해환을 확인하여 최소저해농도(MIC)를 확인하였다.
Munoz-Provencio 등(2009)의 실험 방법을 응용하여 mucin binding ability를 평가하였다. Mucin from porcine stomach type Ⅱ(Sigma-Aldrich, Germany)를 carbohydrate coating buffer로 희석한 0.4% mucin 용액을 12-well non-coated plate에 200 μL씩 분주하여 4℃에서 24시간 동안 코팅하였다. Mucin이 코팅된 well에 4×107 CFU/mL의 ST-27 및 SF-ST-27을 접종한 후 37℃에서 습윤한 5% CO2가 채워진 인큐베이터에서 2시간 동안 반응하였고, 부착되지 않은 샘플을 Dulbecco’s PBS solution(DPBS)을 이용하여 3번 세척하여 제거하였다. 그 후 5시간, 24시간 동안 배지를 교체해주면서 부착되지 않는 샘플을 제거하였다. 부착된 유산균은 0.5% trypsin-EDTA를 3분간 처리 후, mucin 코팅막으로부터 분리하여 MRS agar plate에 평판계수법(plate count method)을 이용하여 37℃에서 48시간 배양 후 부착된 생균수를 측정하였다.
마우스 대식세포 RAW 264.7 세포는 한국세포주은행(KCLB, Korean Cell Line Bank)에서 구입하였다. 10%의 fetal bovine serum(Gibco, Ireland)과 1% antibiotics(Thermo Fisher Scientific, USA)를 포함한 Dulbecco’s modified Eagle’s media (WELGENE, Korea)에서 배양되었다. 세포는 37℃에서 5% CO2의 가습 인큐베이터에서 배양하였다.
S. thermophilus KCTC14471BP(ST-27), 실크 피브로인 코팅 균(SF-ST-27), Lactobacillus rhamnosus GG(LGG)의 세포 독성을 평가하기 위해 5-3-(4,5-dimethylthiazol-2-yl)-2,5- diphenyltetrazolium bromide(MTT) assay를 Song 등(2021)의 방법을 변형하여 실시하였다. LGG는 음성 대조군으로써 실험하였다. 미리 배양된 RAW 264.7 세포를 96-well plate에 5×104 cells/well의 농도로 분주하여 24시간 배양하였다. 각각의 well에 50 μL의 배지로 교체하였고 세균이 제거된 상층액을 50 μL를 처리하여 6시간 배양하였다. 대조군은 Lipopolysaccharide(LPS) 1 μg/mL의 농도로 처리하였다. MTT solution(0.5 mg/mL)을 처리하고 4시간 반응시킨 후, 상층액을 제거하고 dimethyl sulfoxide를 첨가하여 상온에서 30분 동안 반응시켰다. Microplate spectrophotometer를 사용하여 518 nm에서 흡광도를 측정하여 세포 생존율(cell viability)을 계산하였다.
실크 피브로인 코팅 유산균 분말(SF-ST-27)의 실크 피브로인의 부착능에 의한 염증 유발 사이토카인의 gene expression 활성을 확인하기 위해 실시하였다. RAW 264.7 세포는 12-well plate에 well당 2.0×105 세포를 분주 후 ST-27와 SF-ST-27를 4×107 CFU/mL의 농도로 각각의 well에 접종하여 2시간 동안 반응시켰고, 부착되지 않은 균은 DPBS로 제거하고 6시간 동안 배양하였다. 이후 2,000×g에서 3분간 원심분리하여 각각의 well에 존재하는 상층액을 얻었다. 대식 세포로부터 얻어진 total RNA는 MiniBEST Universal RNA Extraction Kit(TaKaRa Bio Inc., Japan)를 사용하여 제조사의 매뉴얼에 따라 정량하였다.
실크 피브로인의 부착능에 의한 SF-ST-27의 면역반응을 조절할 수 있는지를 확인하기 위해서, RAW 264.7 세포는 12-well plate에 well당 2.0×105 세포수로 분주하였다. 전반적인 실험 방법은 Real-time PCR과 동일하게 하였다. IL-6, IL-1β 그리고 TNF-α 는 제조사의 프로토콜에 따라 ELISA MAX™ Deluxe Set(BioLegend) 의해 정량하였다. 또한, SF-ST-27의 농도 의존적 효과를 확인하기 위하여 SF-ST-27를 4×107 CFU/mL와 4×108CFU/mL의 농도로 각각의 well에 접종하여 확인하였다. 마찬가지로 얻어진 상층액은 위에 기술한 바와 같이 정량하였다.
모든 결과는 mean±SD로 나타냈다. 데이터 분석은 t-test와 one-way analysis of variance(ANOVA)(IBM SPSS statistics 25, USA)를 이용하여 도출하였다. Significant differences는 SPSS software (IBM SPSS Statistics 25, USA)를 활용하여 Tukey’s multiple comparison test로 다중 비교하였다. Differences는 p<0.05일 때 *, p<0.01일 때 **, p<0.001일 때 *** 로 표현하였다.
결 과
S. thermophilus KCTC14471BP(ST-27)의 효소 활성 결과는 Table 1에서 보는 바와 같다. Esterase(C4), leucine arylamidase, naphthol-AS-BI-phosphohydrolase, β-galactosidase의 활성을 확인하였다. Esterase와 naphthol-AS-BI-phosphohydrolase는 약한 활성을 확인한 반면에, leucine arylamidase와 β-galactosidase의 경우 높은 활성인 3∼4로 확인하였다. β-Glucosidase와 β-glucuronidase의 활성은 확인되지 않았다.
ST-27의 항생제 감수성은 Table 2에서 보는 바와 같다. Ampicillin, vancomycin, gentamicin, kanamycin, streptomycin, erythromycin, clindamycin, tetracycline, chloramphenicol에 대해 ST-27의 항생제 감수성이 있음을 확인하였다.
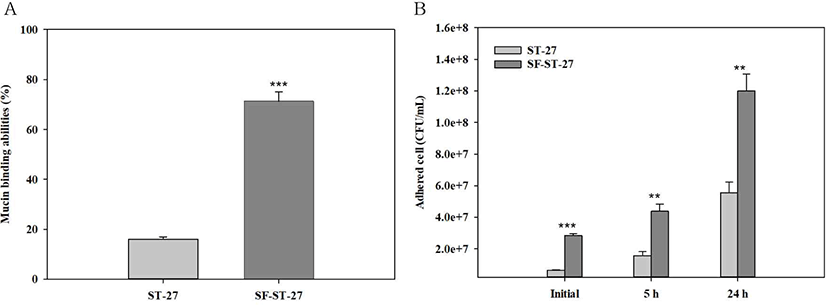
실크 피브로인 코팅에 따른 mucin 부착력을 확인하기 위해 porcine stomach type II mucin이 코팅된 12-well plate에 ST-27과 실크 피브로인 코팅 유산균 분말(SF-ST-27)을 각각 2시간 동안 처리하여 mucin 층에 부착된 균수를 측정하였다. Mucin 층에 부착된 ST-27은 16.1%의 mucin binding ability를 보였고, 실크 피브로인이 코팅된 SF-ST-27은 71.3%의 부착능을 보였다(Fig. 1A). ST-27 및 SF-ST-27의 mucin 부착력에 관하여 일시적 부착 현상인지를 확인하기 위하여, 시간에 따른 부착된 생균수를 확인하였다. ST-27과 SF-ST-27 모두 24시간 동안 생균수가 증가되는 것을 확인하였다(Fig. 1B). 특히 SF-ST-27은 투입 균 대비 약 4.2배의 생균수를 확인하였다.
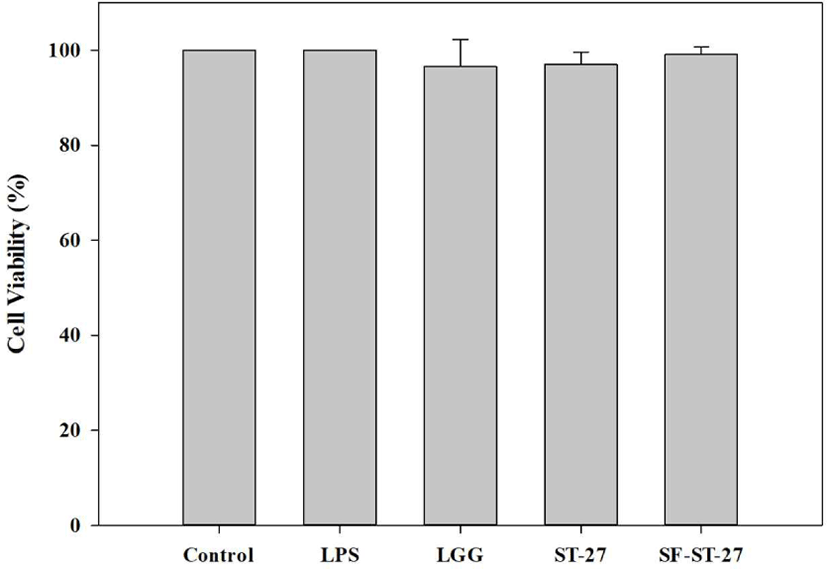
ST-27, SF-ST-27에 대한 세포 독성을 검증하기 위하여, 미리 배양된 RAW 264.7 세포에 Lactobacillus rhamnosus GG(LGG), ST-27, SF-ST-27을 6시간 동안 처리하여 cell viability를 결정하였다. LPS 처리군과 LPS 미처리군 간의 차이와 비교하였을 때, LGG와 ST-27 및 SF-ST-27의 중요한 차이가 없음을 확인하였다(Fig. 2). 따라서 이후 면역 활성 실험에서 ST-27 및 SF-ST-27의 세포 독성을 고려하지 않았다.
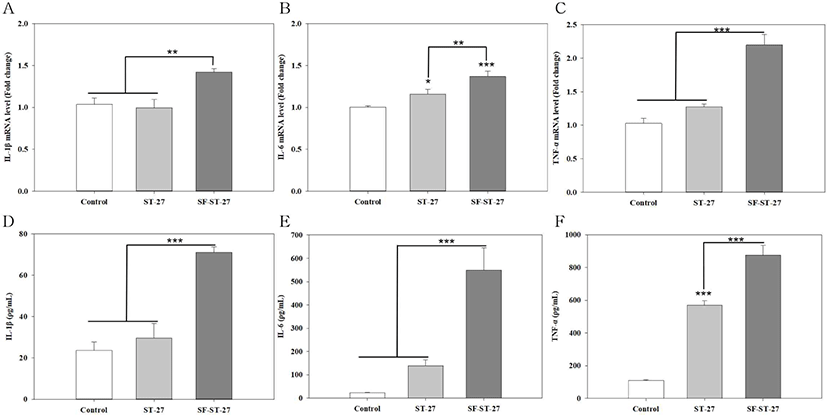
실크 피브로인 코팅에 따른 면역 활성 효과를 확인하기 위하여 RAW 264.7 세포에 ST-27, SF-ST-27을 부착시켜서 면역 조절 사이토카인 IL-1β, IL-6, TNF-α 를 real-time PCR와 ELISA를 이용하여 확인하였으며, RT-PCR 및 ELISA 결과는 각각 mRNA의 발현량과 사이토카인의 양을 나타낸다. ST-27을 처리하였을 경우에 IL-1β 의 mRNA 발현량과 사이토카인의 양은 대조군 대비하여 큰 차이를 확인하지 못하였다(Fig. 3 A,D). IL-6 의 mRNA 발현량은 통계적 유의미한 증가를 확인하였지만, 사이토카인의 양은 통계적으로 유의미하지 않지만 증가함을 확인하였다(Fig. 3 B,E). TNF-α 의 mRNA 발현량은 통계적 유의미함을 확인하지 못하였으며, 사이토카인의 양은 유의미한 증가를 확인하였다(Fig. 3 C,F). 반면에 SF-ST-27을 RAW 264.7 세포에 처리하였을 경우, 대조군 대비 IL-1β, IL-6, TNF-α 의 mRNA 발현량 및 사이토카인의 양은 모두 통계적 유의미한 증가를 확인하였다(Fig. 3). 또한, ST-27 처리군과 SF-ST-27 처리군 간의 IL-1β, IL-6, TNF-α 에 대한 mRNA 발현량 및 사이토카인의 양의 통계적 유의미한 차이를 확인하였다.
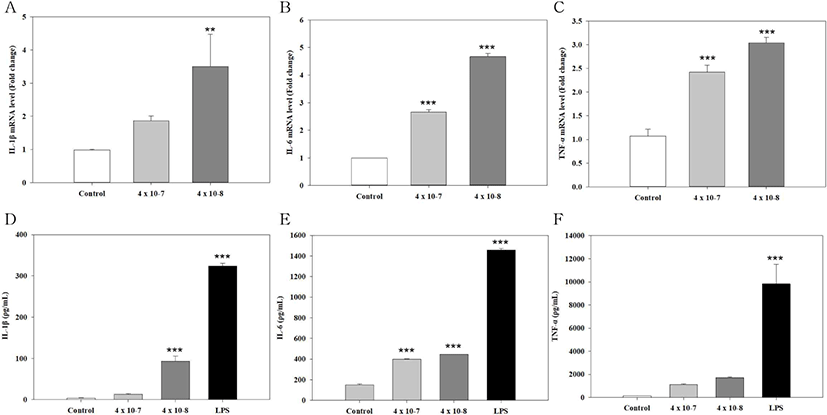
SF-ST-27의 면역 활성에 대하여, RAW 264.7 세포에 대한 SF-ST-27의 농도 의존성을 확인하였다. SF-ST-27은 각각 4×107 CFU/mL와 4×108 CFU/mL의 농도로 RAW 264.7 세포에 처리하여 면역 조절 사이토카인 IL-1β, IL-6, TNF-α 를 real-time PCR와 ELISA을 이용하여 확인하였으며, RT-PCR 및 ELISA 결과는 각각 mRNA의 발현량과 사이토카인의 양을 나타낸다. IL-1β 의 mRNA 발현량을 확인하였을 때, SF-ST-27의 처리 농도가 4×107CFU/mL에서 4×108 CFU/mL로 높아짐에 따라 0.99 fold change에서 각각 1.87, 3.51 fold change로 증가함을 확인하였고, ELISA를 통한 정량화에서 사이토카인의 양은 3.73 ρg/mL에서 각각 12.80, 93.42 ρg/mL로 증가함을 확인되었다(Fig. 4 A,D). 4×107CFU/mL의 농도로 SF-ST-27을 처리하였을 경우, IL-1β 의 mRNA 발현량과 사이토카인의 양은 대조군 대비 통계적 유의미한 결과는 아니지만 증가함을 확인하였다. 반면에 SF-ST-27의 농도 증가에 따른 IL-1β 의 mRNA 발현량과 사이토카인의 양은 통계적으로 유의미한 증가를 확인하였다. IL-6의 사이토카인의 양과 mRNA의 발현량은 대조군과 실험군 간의 비교와 균 처리 농도 간의 비교에 대해 각각 통계적인 유의미한 증가를 확인하였다(Fig. 4 B,E). TNF-α 의 mRNA 발현량은 대조군 대비 실험군의 증가 및 SF-ST-27의 농도 간의 증가에서 통계적으로 유의미한 증가를 확인하였다. 반면에 SF-ST-27의 농도가 각각 4×107CFU/mL, 4×108 CFU/mL로 처리하였을 때, TNF-α 사이토카인의 양은 149.74 ρg/mL에서 각각 1134.22, 1726.87 ρg/mL로 통계적 유의미하지 않지만 증가함을 확인하였다(Fig. 4 C,F).
고 찰
프로바이오틱스를 산업적으로 이용하기 위한 안전성과 유용한 효과는 다양한 선행 연구들에서 실시한 효소 활성시험으로 확인한 바 있다. β-Glucosidase와 β-glucuronidase는 세균성 발암 효소로 발암성 물질(e.g., deoxynivalenol)로 전환하여 간이나 직장에 부정적인 영향을 준다(Ban et al., 2020; Yang et al., 2018). ST-27의 경우 β-glucosidase와 β-glucuronidase의 활성이 없었으므로 안전한 유산균임을 알 수 있다. S. thermophilus IDCC 2201의 결과에서 β-glucosidase 및 β-glucuronidase의 활성이 없음을 확인하여 안전성을 검증하였다(Ban et al., 2020). β-Galactosidase는 유당을 포도당과 단순당으로 분해하므로 우유 발효에서 필수적인 효소이고 유당 불내증 문제를 감소시킬 수 있다(Yang et al., 2018; Yu et al., 2020). β-Galactosidase의 높은 활성을 확인하였으므로, 프로바이오틱스로서 산업적 이용에서 유용한 효과를 보일 것으로 예상할 수 있다.
유산균에 존재하는 항생제 내성 유전자의 전이는 항생제 내성균을 유도할 수 있기 때문에, 프로바이오틱스에 사용되는 유산균은 항생제 감수성 확인을 필수적으로 해야 한다. ST-27의 경우, 9가지의 항생제에 대하여 EFSA cut-off value에 부합함을 확인하였다. 본 연구진이 수행한 이전 연구에서 ST-27의 전장 유전체 분석을 통하여 항생제 내성 유전자가 존재하지 않음을 확인한 바 있다(Kim et al., 2021). 그러므로 ST-27은 항생제 내성과 관련된 안전성 검증과 관련해서 충분히 안전하다고 할 수 있다.
이전 연구에서 우리는 ST-27에 실크 피브로인 코팅을 적용함으로써, 세포 표면 소수성 향상과 장 상피 세포 부착능 향상을 확인한 바 있다(Kwon et al., 2021). 섭취된 프로바이오틱스는 식도, 위를 거쳐 장에 도달하게 되고, 장관내에서 장 상피 세포를 통해 분비되는 끈적한 mucin에 의해 장에 부착되게 된다. ST-27과 SF-ST-27의 mucin 부착 능력과 24시간 동안 처리에 따른 생균수를 확인함으로써, 실크 피브로인 코팅이 mucin 부착 능력 향상에 영향을 주는 것을 확인하였다. ST-27과 비교하여, SF-ST-27의 mucin 부착 능력 향상은 S. thermophilus 표면에서 견고한 실크 피브로인 β-sheet 코팅막을 형성하여 세포 표면 소수성이 향상되었음을 예상할 수 있다(Fig. 1). 향상된 소수성은 mucin과의 전기적인 반발력을 감소시켜 SF-ST-27이 mucin에 안정적으로 부착될 수 있다(kwon et al., 2021). 장내 상주하는 유산균의 안정성은 장에서의 체류 시간에 따라 영향을 받는다고 알려져 있다(Rodes et al., 2011). 그러므로 S. thermophilus 의 실크 피브로인 코팅을 적용하였을 경우, mucin 부착 능력이 향상되어 장 체류 시간에 긍정적인 영향을 줄 것으로 예상할 수 있다.
외래 병원체로부터 숙주를 지키기 위해서 사이토카인은 면역 시스템의 다른 세포 사이의 중재자로 작용함으로써 면역 시스템에서 중요한 역할을 한다. 사이토카인은 외부의 위협에 대한 반응과 신체 방어의 활성 상태를 위한 표지자다. IL-1β, IL-6, TNF-α 는 병원균 혹은 유사한 자극들에 접촉되었을 때, 대식 세포나 단세포와 같은 선천 면역 체계의 세포에 의해 빠른 속도로 생산되는 고전적인 염증성 사이토카인이다(Meyer et al., 2007). 그렇기에 면역 세포 활성은 바이러스나 유해균에 의한 감염으로부터 신체를 보호하기 위해 중요하다. 그중 대식 세포는 모든 주요 기관에 분포되어 있으며, 감염에 대해 방어할 수 있는 선천성 면역 세포이다(Sun et al., 2015). IL-1β, IL-6, TNF-α 에 의해 대식세포의 염증 유발 반응이 촉진되면 유해균을 대식 작용을 통해 직접적으로 공격하고, 적응 면역 반응을 유도하게 된다(Yang et al., 2019). 본 연구진은 이전 연구에서 실크 피브로인 코팅에 따른 장 정착성 향상을 확인한 바 있다(Kwon et al., 2021). 뿐만 아니라, 본 연구에서 향상된 mucin 부착능 및 대식 세포를 더욱 자극하여 사이토카인 분비량 증가를 확인하였다(Fig. 3). 프로바이오틱스는 염증 과정에 관여하여 염증 사이토카인을 분비함으로 인하여 장내 미생물 환경을 안정화하는 것으로 알려져 있다(Salmnen and Isolauri, 2006). 또한, SF-ST-27의 농도가 점차 증가됨에 따라 면역 활성의 정도가 상승됨을 확인하였다(Fig. 4). 따라서 실크 피브로인 코팅의 mucin 부착력 향상은 안정적인 장 정착을 기대할 수 있고 염증에 대한 면역 활성을 더 증진시킬 수 있을 것으로 예상할 수 있다.
효소 활성 평가 및 항생제 감수성 평가를 통하여 ST-27의 안전성을 확인할 수 있었다. 코팅된 프로바이오틱스 부착력이나 내산, 내담즙성에 대한 연구는 많이 되어 있지만, 부착력이 면역 활성과 관련된 시너지 효과에 대한 연구는 거의 진행되지 않았다. 본 연구에서는 이전 연구에 이어서 SF-ST-27이 mucin 부착능 향상으로 인해 증식능과 면역 활성 기능성에 긍정적인 영향을 보여줄 수 있음을 확인하였다.
요 약
원유로부터 분리된 S. thermophilus KCTC14471BP의 안전성을 확인하였고, mucin 부착능 및 면역 활성에 관한 실크 피브로인의 효과를 확인하였다. 1% 수용성 칼슘과 0.1% 실크 피브로인을 첨가하여 S. thermophilus KCTC14471BP를 코팅하였다. S. thermophilus KCTC14471BP는 leucine arylamidase와 β-galactosidase의 높은 활성을 확인한 반면, β-glucosidase와 β-glucuronidase의 경우에 활성이 거의 없음을 확인하였다. S. thermophilus KCTC14471BP은 ampicillin, vancomycin, gentamicin, kanamycin, streptomycin, erythromycin, clindamycin, tetracycline, chloramphenicol에 대해 감수성이 있음을 확인하였다. S. thermophilus KCTC14471BP의 실크 피브로인 코팅함에 따라 mucin 부착능이 16.1%에서 71.3%로 향상됨을 확인하였고, RAW 264.7 대식 세포에 대한 독성이 없음을 확인하였다. 실크 피브로인으로 코팅된 S. thermophilus KCTC14471BP은 농도 의존적으로 면역 활성 능력이 높아짐을 확인하였다. 따라서 본 연구결과, S. thermophilus KCTC14471BP는 발효 및 기능 식품과 같은 식품 산업에서 프로바이오틱스로 매우 유용하게 활용될 수 있을 것으로 예상된다.







