Research Article
김치에서 분리한 유산균의 생리적 특성 및 지방축적억제 효과
최성원1,*
,
정은아1,2
In Vitro Probiotic Evaluation and Anti-Adipogenic Effect of Lactic Acid Bacteria Isolated from Kimchi
Sung-Won Choi1,*
,
Eun-Ah Jung1,2
Author Information & Copyright ▼
1Department of Food and Nutrition, Osan University, Chunghak-ro 45, Osan 18119, Republic of Korea
2JHL Innovation, Sungbok-ro 17, Suji-gu, Yongin 16860, Republic of Korea
*Corresponding author : Sung-Won Choi, Department of Food and Nutrition, Osan University, Chunghak-ro 45, Osan-si, Gyeonggi-do 18119, Korea. Tel: +82-31-370-2755, Fax: +82-31-370-2759, E-mail:
csw0365@osan.ac.kr
Copyright © Korean Society for Lactic Acid Bacteria and Probiotics. This is an Open-Access article distributed under the terms of the
Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0/) which permits
unrestricted non-commercial use, distribution, and reproduction in any
medium, provided the original work is properly cited.
Received: Oct 24, 2022; Revised: Dec 21, 2022; Accepted: Dec 23, 2022
Published Online: Dec 31, 2022
Abstract
In this study, probiotic properties such as acid resistance, bile tolerance, intestinal adhesion and fat accumulation inhibition of lactic acid bacteria isolated from kimchi were investigated in order to develop probiotics effective anti-adipogenic effects. Among the 120 types of lactic acid bacteria isolated from kimchi, 42 types of lactic acid bacteria being to acid resistance, 35 types of lactic acid bacteria being to bile resistance, and 24 types of lactic acid bacteria being to both acid resistance and bile resistance were selected. These 24 types were tested for the intestinal adhesion ability which is an essential factor of probiotics’ function and L. rhamnosus GG was used as a positive control in this test. 10 types of lactic acid bacteria having the intestinal adhesion ability were selected. The selected 10 types of lactic acid bacteria were treated in 3T3-L1 cells and intracellular fat was stained with Oil Red O reagent to measure fat accumulation. As a result, in the group treated with lactic acid bacteria OS-15, 48, 102 and 120, fat accumulation was significantly decreased compared with the non-treated group. And the strain OS-48 showed the greatest inhibitory effect on fat accumulation. The lactic acid bacterium OS-48 was identified as Lactiplantibacillus plantarum by analysis based on 16S rRNA sequencing and was named Lactiplantibacillus plantarum OS-48. Therefore, based on the results of this study, L. plantarum OS-48 is expected to be very useful as probiotics with anti-obesity effect in the food industry such as fermented food and functional food.
Keywords: probiotic; Kimchi; anti-adipogenic effect; Lactiplantibacillus plantarum OS-48
서 론
김치는 장류, 식초 및 젓갈류 등의 발효식품과 함께 우리의 식사에 빼놓을 수 없는 기본적인 찬으로 이용되어온 매우 중요한 채소발효식품이다(Lee and Ahn, 1995). 김치의 발효에 관여하는 미생물은 토양, 공기, 물 등의 자연환경에서부터 유래된 것으로 이들 미생물은 채소에 부착되어 있다. 일반적으로 채소 원료의 미생물은 재배 환경, 계절, 저장유통과정 등 다양한 요인에 따라 다양하며 그 숫자 또한 크게 달라질 수 있다. 보편적으로 채소 원료에는 수만에서 수천만에 이르는 미생물이 부착되어 있고 위생적으로 문제가 될 수 있는 대장균군과 대장균을 포함하여 일반세균, 효모, 곰팡이, 유산균에 이르기까지 다양하게 존재한다. 이들 미생물들은 세척, 소금절임, 담금과정을 거치면서 대부분 미생물은 생육이 억제되거나 사멸하고 내염성을 가지는 유산균이 살아남아 김치의 발효 및 숙성을 주도하게 된다(Cho et al., 1998; Lee and Ahn, 1995; Lee and Lee, 2011; Park et al., 2012).
유산균이란 포도당 및 다른 6탄당들을 에너지원으로 하여 산소를 사용하지 않고 젖산을 생성하는 미생물 군을 말하며 젖산을 생성하는 형식에 따라 homo 형의 발효균과 hetero 형의 발효균으로 구분한다(Park, 2017). Homo 형의 젖산발효는 glucose, lactose와 같은 당이 분해되어 피르브산이 생성되고 이것은 다시 젖산탈수소효소(lactate dehydrogenase)에 의해서 젖산으로 환원하여 젖산을 생성하는 유산균으로 1분자의 포도당을 2분자의 젖산으로 전환하며 Lactiplantibacillus plantarum, L. casei, Streptococcus lactis, S. faecalis이 이에 속한다. Hetero 형의 발효는 glucose와 같은 6탄당에서 젖산, 에탄올, CO2 등을 생산하는데 이에 속하는 유산균은 Leuconostoc mesenteroides와 L. brevis 가 대표적이다. 이들 유산균 중 김치의 발효에 대표적인 균의 특성을 보면, L. mesenteroides 등과 같은 hetero 형 발효 유산균은 초기에 주동적인 역할을 하고 homo 형 발효 유산균인 L. plantarum의 증식은 김치의 과숙시 최고의 생육을 나타내고, 김치의 산패를 일으켜 김치의 품질을 저하시키는 것으로 보고되고 있다(Kang et al., 1995; Lee and Lee, 2011; Park et al., 2012; Park, 2017).
프로바이오틱스(Probiotics)는 체내에 들어가서 건강에 도움을 주는 살아있는 균을 지칭하며 (Marteau et al., 2002), 프로바이틱스의 과학적 효능은 러시아 미생물학자 메치니코프(Elie Metchnikoff, 1845-1916)에 의한 연구결과를 통해 처음으로 알려지게 되었다(Mercenier et al., 2003). 메치니코프는 1908년 그의 저서 “수명연장(The Prolongation of Life)”를 통해 사람이 발효유를 섭취하면 발효유에 포함되어 있는 유산균이 장내에 존재하고 있는 장내유해균의 생육을 억제하고 그 결과 장내유해균이 생산하는 독소로 인한 노화현상을 줄일 수 있다는 내용을 발표하여 프로바이오틱스의 효능을 과학적으로 입증하였다(Kang et al., 2012; Lim et al., 2019).
현재 식품의약품안전처에 고시형 건강기능식품으로 등록되어 있는 프로바이오틱스의 기능성은 “장내 유익균 증식, 유해균 억제 및 배변활동 원활에 도움”을 줄 수 있는 것으로, Lactiplantibacillus, Lactococcus, Enterococcus, Streptococcus 및 Bifidobacterium 속 등이 있다(Jung et al., 2020; Lee et al., 2016; Lim et al., 2019) . 프로바이오틱스는 식품섭취를 통해 유산균이 장내로 유입되어 장내 상피세포에 부착하여 장내 유해균의 생육 억제 및 장내 부패 억제, 설사 및 변비 개선, 비타민의 생성, 면역활성의 증진, 항암작용 등 인간의 건강에 도움을 주는 것으로 보고되고 있다(Bäckhed et al., 2007; Lee et al., 2006; Ley et al., 2006; Lee et al., 2021). 프로바이오틱스로 사용되는 유산균은 치즈, 발효유 및 유산균 음료 등의 발효 유제품을 비롯하여 육제품, 침채류 및 각종 젓갈류 등의 각종 발효 식품 제조에 광범위하게 활용되고 있는 산업적으로 중요한 미생물이다(Lee et al., 2016). 이러한 유산균을 이용한 발효물은 발효유나 치즈와 같은 형태로 발효식품으로 제품화가 되거나 김치나 장류 같은 전통발효식품에서 종균으로 사용되고 있지만, 유산균을 이용하여 식품을 발효할 경우 유산균 종류에 따라 생산성 및 제품 품질에 차이가 생기고 건강기능식품의 원료로써 활용되는 유산균 종류에 따라 생리활성이 다르기 때문에 생산성 및 기능성이 우수한 신규 유산균의 확보는 식품산업에 있어 중요한 영향을 끼칠 수 있다. 김치 속에 있는 유산균은 프로바이오틱스로서의 기능성을 가지고 있으며 우리 인체에 유리하게 작용하여 정장작용, 면역강화 및 항암작용 등에 관여하는 것으로 보고되고 있다. 또한 김치의 섭취를 통해 사람의 건강에 유익한 김치 유산균인 Lactobaillus 속 및 Leuconostoc 속의 미생물수가 유의적으로 증가하였고 대장균의 수는 다소 감소한 것으로 보고되고 있으며 최근 진행된 연구에서는 유산균의 콜레스테롤 강하작용 및 지방축적 억제효과가 보고되고 있다(Kim and Lim, 2017; Park et al., 2018; Yoon et al., 2021). 따라서 본 연구에서는 지방축적 억제효과를 나타내는 프로바이오틱스를 탐색하기 위하여 김치 유래 유산균으로부터 내산성, 내담즙성, 장 부착성 및 지방축적억제효능을 확인하고자 하였다.
재료 및 방법
유산균 분리 및 배양
120종의 유산균이 김치로부터 분리되었고, 분리된 김치유산균은 Lactobacilli MRS(De Man, Rogosa and Sharpe, BD Difco, MD, USA) 액체배지를 사용하여, 30°C의 배양기에서 24시간 정치배양하였다. 유산균 배양액은 30% glycerol로 stock을 제조하여 -80°C 초저온냉동고에서 보관하였으며 2회 계대하여 활성화한 후에 본 실험에 사용하였다.
유산균의 내산성 및 내담즙성 실험
분리한 김치유산균을 30°C에서 24시간 동안 정치배양한 후, 원심분리(500 ×g, 4°C, 10분)하여 phosphate buffer saline (PBS, pH 7)에 2번 세척하였고, 생균수를 측정하여 1×109 CFU/mL의 농도로 유산균 희석액을 제조하여 내산성 및 내담즙성 실험에 사용하였다. 산성에 대한 내성을 확인하기 위하여 1,000 unit/ml의 pepsin(Sigma-Aldrich, St. Louis, MO, USA)이 첨가되고 pH를 2.5로 조정한 MRS 배지에 유산균 희석액을 2% 접종하고 30°C에 3시간 정치한 후 생균 수를 확인하였다. 내담즙염 평가를 위해서 3% oxgall bile salt(Neogen, MI, USA)을 포함한 MRS 배지에 유산균 희석액을 2% 접종하고 30°C에 3시간 정치한 후 생균수를 확인하였다. 초기 생균 수와 비교하여 90% 이상의 생존율을 보이는 균주를 선발하였다(Kang et al., 2012; Lim et al., 2019; Park et al., 2012).
유산균의 장 부착능 측정
유산균의 장 부착능 측정은 프로바이오틱스로서 숙주의 장내 환경에 대한 정착력을 확인하는 대표적인 방법이며 인간의 장 상피세포와 유사한 HT-29 세포(Human intestinal epithelial cells)을 이용하여 유산균의 장 부착능을 확인하였다(O’Halloran et al., 1997). HT-29 세포는 10% fetal bovine serum(FBS, HyClone Laboratories Inc, UT, USA)과 1% penicillin-streptomycin이 함유된 Dulbecco’s modified eagle medium (DMEM, Gibco, MD, USA)를 사용하여 배양하였고 monolayer를 형성한 HT-29 세포를 0.1 M PBS buffer를 이용하여 세척하고 항생제를 첨가하지 않은 배지를 첨가하였다. 여기에 유산균을 1×108 CFU/mL의 농도가 되게 첨가하여, 37°C, 5% CO2 배양기에서 2시간 배양 후, 0.1 M PBS buffer를 이용하여 5회 세척을 실시하여 부착되지 않은 유산균을 제거하였다. Trypsin-EDTA(Hyclone, Logan, UT, USA)를 이용하여 탈착된 HT-29 세포를 적절히 희석하여 MRS 고체배지에 접종하였고 30°C에서 48시간 동안 배양 후 생균 수를 확인하였으며, 지시균으로 Lactobacillus rhamnosus GG를 사용하였다(Kang et al., 2012; Lim et al., 2019; Park et al., 2012).
유산균 사균체 제조
후보 유산균을 MRS 액체배지에서 30°C에서 24시간 동안 배양하고 배양액을 500 ×g에서 10분 동안 원심분리한 후 PBS로 세척하여 남아있는 배지 성분을 제거하고 균체를 회수하였다. 균체를 1×109 CFU/mL의 농도로 현탁한 후 95°C에서 30분간 열을 가하여 유산균사균체를 다음 실험에 사용하였다.
지방축적 억제 활성 균주 선발
지방전구세포주인 3T3-L1 세포(한국세포주은행)를 10% bovine calf serum (BCS, HyClone Laboratories Inc, UT, USA)과 1% Antibiotics/antimycotic solution (10,000 U/mL penicillin G, 10,000 μg/mL streptomycin, 25 μg/mL amphotericin B)이 첨가된 DMEM 배지에 접종한 후, 37°C, 5% CO2 배양기에서 2일 간격으로 배지를 교환하면서 포화도가 100%가 될 때까지 배양하였다. 세포가 confluent상태까지 자라면, 10 μg/mL Insulin, 20 mM Dexamethasone, 0.1 mM IBMX(3-isobutyl-1-methylxanthine)을 포함하는 10% FBS/DMEM 분화용 배지로 교환하고, 2일 동안 추가 배양하며 지방세포로의 분화를 유도하였다. 이때, 분화용 배지에는 유산균 사균체 1×107 CFU/mL를 추가하였다. 2일간의 배양이 끝나면 2일 간격으로 유산균 사균체 1×107 CFU/mL 및 10 μg/mL Insulin을 포함하는 10% FBS/DMEM 배지로 교환하여 6 일간 추가 배양하여 지방세포의 숙성을 유도하였다. 얻어진 지방세포는 10% 포르말린 수용액을 가해 고정시키고, Oil Red O 용액을 처리하여 1시간 동안 반응하여 세포 내 축적된 지방을 염색하였다. 염색 완료 후, 현미경으로 관찰한 다음 이소프로필 알코올로 Oil Red O 용액을 다시 녹여 518 nm의 파장에서 흡광도를 측정하여 지방축적도를 계산하였다(Kim and Lim, 2017; Park et al., 2018; Yoon et al., 2021).
선발유산균의 16S rRNA 분석
선발된 균주의 동정을 위하여 16S rRNA 염기서열분석을 실시하였다. 16S rRNA 염기서열분석은 선발된 균주를 MRS 액체배지에 배양하여 genomic DNA extraction kit(iNtRON Biotechnology, Korea)를 사용하여 DNA를 추출하였고, 추출된 DNA는 1% agarose gel을 이용하여 확인하였다. 16S rDNA를 증폭하기 위하여 추출된 genomic DNA를 template로 하여 27F(5'-AGAGTTTGATCCT GGCTCAG-3', forward), 1492R(5'-GGCTACCTTGTTACG ACTT-3', reverse) primer를 이용하여 PCR을 진행하였다. PCR조건은 95°C에서 1분간 denaturation, 45°C에서 1분간 annealing, 72°C에서 1분 30초간 extension으로 30 cycle을 수행하였으며, 얻어진 PCR product를 이용하여 염기서열을 결정하였고 이 서열을 기반으로 NCBI의 BLAST를 이용하여 GenBank database와 비교하여 분리균주를 동정하였다.
통계 분석
실험결과의 데이터 분석은 통계 프로그램인 SPSS(Statistics Package for the Social Science, Ver. 27.0 for Window) package를 이용하여 3회 반복한 값의 평균 및 표준편차를 구하고, 분산분석(ANOVA)과 Duncan의 다중범위 검정(Duncan's multiple range test)를 실시하여 통계적 유의성을 검증하였고, p<0.05인 경우 통계적으로 유의한 것으로 판정하였다.
결과 및 고찰
내산성 및 내담즙성 균주 선발
유산균이 장에 도달하여 건강에 도움을 줄 수 있는 프로바이오틱스로서의 역할을 하기 위해서는 위에서 분비하는 위산이나 십이지장에서 분비되는 담즙에 대한 내성을 가지고 있어야 한다(Lim et al., 2019). 즉 식품을 통해 섭취된 유산균이 위에서 분리되는 낮은 pH의 위산 및 소화효소와 십이지장에서 분비되는 담즙으로부터 살아남아 최종 목적 부위인 장에 도달하여야만 프로바이오틱스로서 작용할 수 있다. 김치로부터 분리한 120종의 유산균에 대해 내산성 및 내담즙성을 갖는 유산균을 선발한 결과, 초기 균수에 비하여 내산성의 경우 pH 2.5에 대해 높은 저항력을 보이는 김치 유산균은 42종, 내담즙성의 경우 3.0%에 대해 높은 저항력을 보인 김치 유산균은 35종이었다. 이 중 내산성과 내담즙성을 모두 갖고 있는 유산균 24종을 선발하였다(Table 1).
Table 1.
Assessment of viability of the isolated strains after exposure to low pH and bile salts
| Strains |
Acid resistance |
Bile tolerance |
Strains |
Acid resistance |
Bile tolerance |
| 1 |
+ |
- |
50 |
- |
+ |
| 4 |
+ |
- |
58 |
+ |
- |
| 5 |
+ |
+ |
59 |
+ |
- |
| 9 |
+ |
+ |
63 |
+ |
+ |
| 10 |
+ |
+ |
64 |
- |
+ |
| 12 |
- |
+ |
69 |
+ |
+ |
| 14 |
+ |
- |
72 |
- |
+ |
| 15 |
+ |
+ |
75 |
+ |
+ |
| 16 |
+ |
- |
80 |
+ |
- |
| 18 |
+ |
- |
86 |
+ |
+ |
| 20 |
+ |
- |
89 |
+ |
+ |
| 21 |
+ |
- |
93 |
+ |
+ |
| 24 |
+ |
+ |
96 |
- |
+ |
| 25 |
- |
+ |
97 |
+ |
+ |
| 27 |
+ |
- |
98 |
+ |
+ |
| 29 |
+ |
- |
100 |
+ |
+ |
| 30 |
- |
+ |
101 |
+ |
- |
| 32 |
+ |
+ |
102 |
+ |
+ |
| 34 |
- |
+ |
103 |
+ |
- |
| 35 |
+ |
+ |
105 |
+ |
+ |
| 36 |
+ |
+ |
109 |
+ |
- |
| 38 |
+ |
- |
110 |
+ |
+ |
| 42 |
- |
+ |
112 |
+ |
+ |
| 43 |
+ |
- |
113 |
+ |
- |
| 44 |
+ |
+ |
115 |
- |
+ |
| 45 |
- |
+ |
120 |
+ |
+ |
| 48 |
+ |
+ |
|
|
|
Download Excel Table
장 부착능 균주 선발
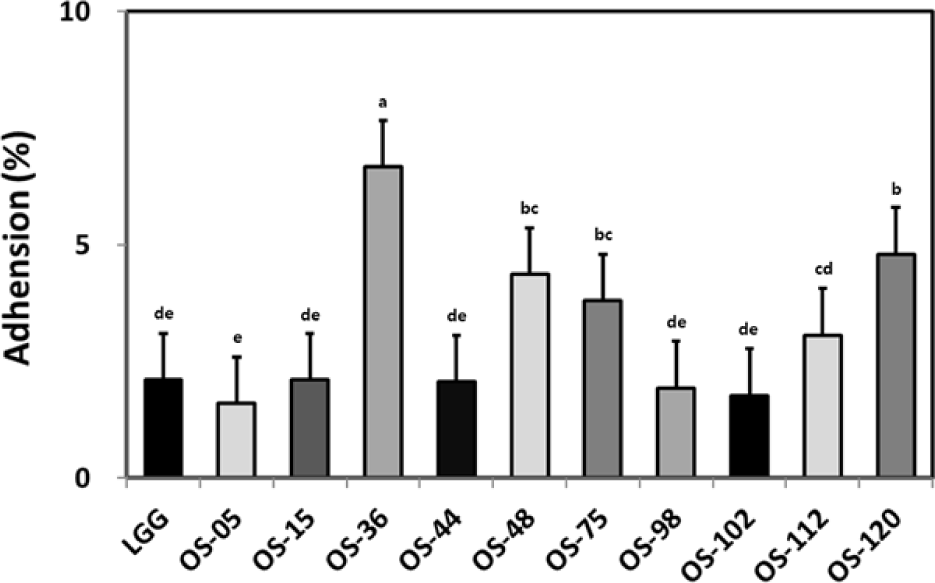
유산균이 인체와 같은 숙주에 도움이 되기 위해서는 장관에서 정상적으로 생존하고 대사할 수 있어야 한다. 즉, 위산과 담즙산과 같은 열악한 환경에 살아 남아 소장까지 도달하여 장에서 증식하고 정착하여야 하며 장관 내에서 유효한 효과를 나타내어야 한다(Ouwehand et al., 1999). 내산성이 높고 장 부착능이 우수한 것으로 알려진 대표적인 유산균에는 L. rhamnosus GG(LGG)가 보고되고 있으며 이 유산균은 성인의 분변에서 분리되었고, 핀란드에서 프로바이오틱스로 개발되어 많은 제품에 이용되고 있다(Lim et al., 2013). L. rhamnosus GG는 다른 유산균에 비해 장내 부착능이 뛰어난 것으로 알려져 양성대조군으로 사용하였으며, 내산성 및 내담즙산성을 동시에 갖는 유산균 24종에 대하여 장 부착능을 확인한 결과, 10종의 유산균에서 장 부착능을 보였다(Fig. 1).
Fig. 1.
Adhesion ability of the isolated lactic acid bacteria to HT-29 cells. L. rhamnosus GG (LGG) was used as a positive control in the experiment. The data was analyzed using SPSS 27.0. Different letters indicate significant difference (p<0.05).
Download Original Figure
지방축적 억제 활성 균주 선발
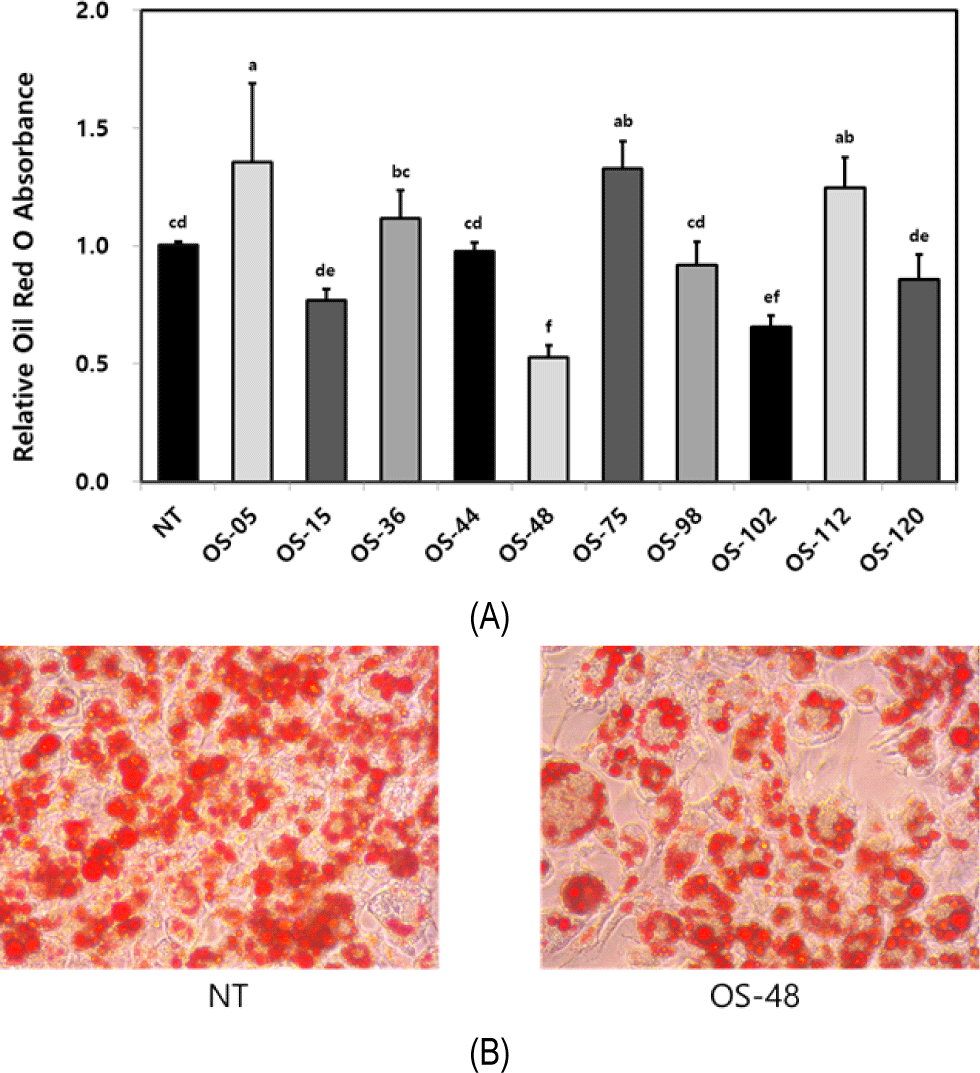
비만은 다양한 질병의 원인이기도 하며, 미용을 중시하는 여성들의 최대 관심사이기 때문에 다양한 질병의 원인인 비만을 관리하고 예방하는 것이 사회적으로 매우 중요한 실정이다(Leung et al., 2003). 최근 들어 비만이 고지혈증, 당뇨, 고혈압, 심혈관계 질환과 같은 성인병뿐만 아니라 암을 일으키는 가장 큰 원인 중 하나로 밝혀지고 있다. 따라서 비만의 원인적 대처는 다양한 성인병의 주요 원인에 대한 근본적 대처를 하는 효과적 방법이라고 할 수 있다 (Kahan and Manson, 2019). 비만은 대사하고 남은 에너지가 지방세포의 증식 및 분화와 함께 지방세포에 체지방의 형태로 축적됨으로써 체중이 증가된 상태를 말하며 장내 미생물 균총의 변화를 초래하여 장내 미생물 불균형을 초래할 수 있다고 보고되고 있다(Cuevas-Sierra et al., 2019; Sommer et al., 2013). 비만을 예방하고 치료하기 위한 다양한 연구들이 보고되고 있으며, 일부 유산균은 지방세포의 수를 조절하고 지방 분화를 억제하여 체지방 감소 및 비만억제 효과가 있는 것으로 보고되고 있다(Kim and Lim, 2017). 3T3-L1 지방전구세포를 dexamethasone, IBMX 및 insulin을 이용하여 지방세포로 분화시킬 때 지방구의 축적을 광학현미경으로 관찰하고 Oil Red O 시약을 이용하여 세포내 지방을 염색하여 흡광도를 측정하여 지방세포로의 분화가 정상적으로 일어남을 확인하였다. 10종의 유산균을 107 CFU/mL 농도로 분화과정간 3T3-L1 세포 배양액에 첨가한 후, 생성된 지방구를 염색한 Oil Red O 시약의 흡광도를 측정하여 지방축적도를 측정한 결과, 비처리군(non-treated)과 비교하여 OS-15, 48, 102, 120 유산균 처리시 지방축적도가 유의적으로 감소함을 보였고 김치 유산균 OS-48에서 지방축적 억제효과가 가장 큰 것으로 나타났다(Fig. 2). 지방세포 분화는 유전자 발현, 단백질 발현, 호르몬 민감성 등의 인자에 의해 영향을 받고 지방형성에 관여하는 인자에는 peroxisome proliferator-activator recepter gamma (PPARγ)와 CCAAT-enhancer-binding protein alpha(C/EBPα)가 있다고 보고되고 있으며(Koutnikova and Auwerx, 2001), 비만억제효과를 나타내는 유산균을 3T3-L1 세포에 처리하였을 때 PPARγ, C/EBPα의 발현 수준이 감소하는 경향을 보이는 것으로 보고되고 있다(Kim et al., 2020).
Fig. 2.
Effects of the isolated lactic acid bacteria on intercellular lipid accumulation in 3T3-L1 adipocytes (A) Quantifcation of the stained lipids with Oil red O in the differentiated 3T3-L1 adipocytes, (B) Microscopic images of the differentiated 3T3-L1 adipocytes stained by Oil red O. The data was analyzed using SPSS 27.0. Different letters indicate significant difference (p<0.05).
Download Original Figure
지방축적 억제 활성 미생물의 동정
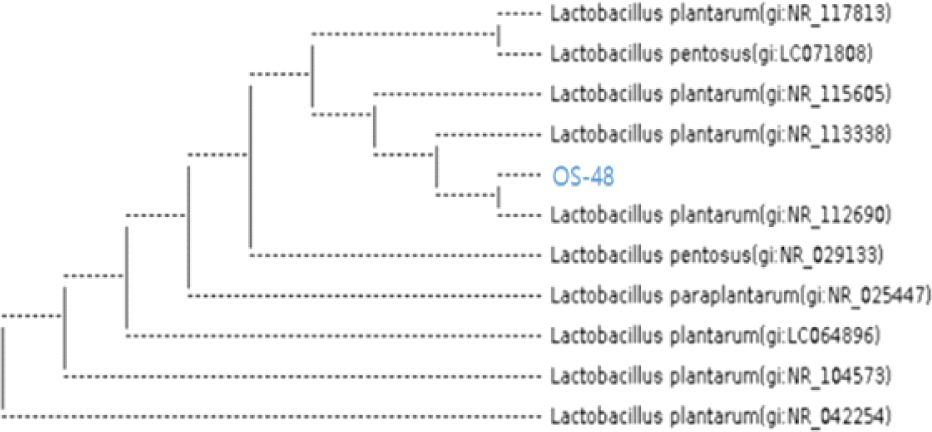
내산성, 내담즙성 및 장 부착능을 나타내며, 지방축적 억제효과가 우수한 김치유산균 OS-48에 대한 미생물 동정을 수행하기 위하여 16S rRNA 염기서열분석에 기반하여 분자생물학적 동정을 진행하였다. 김치유산균 OS-48 균주의 genomic DNA를 추출하고 PCR로 16S rRNA를 증폭하여 염기서열을 결정하였다. 이 서열을 기반으로 NCBI의 BLAST program으로 유사성이 높은 Lactobacillus 균주들과의 상동성을 비교한 결과, 99.93%의 신뢰도로 Lactiplantibacillus plantarum으로 동정되었다(Fig. 3). 따라서 본 연구에서 선발한 OS-48 균주를 Lactiplantibacillus plantarum OS-48로 명명하였다.
Fig. 3.
Phylogenetic tree of the lactic acid bacteria OS-48 isolated from kimchi by 16S rDNA sequencing. Sequences for 16S rDNA phylogenetic analysis were obtained from the GenBank database.
Download Original Figure
요 약
본 연구에서는 항비만 효과를 나타내는 프로바이오틱스를 탐색하기 위해 김치로부터 분리한 유산균으로부터 내산성, 내답즙성, 장 부착능 및 지방 축적억제 효과를 알아보고자 하였다. 김치에서 분리한 120여종의 유산균 중 내산성을 보이는 유산균 42종과 내담즙성을 나타내는 유산균 35종, 그리고 내산성과 내담즙성을 동시에 나타내는 24종의 유산균을 선발하였다. 또한 프로바이오틱스로 작용하기 위한 필수적인 요소인 장부착능을 검토한 결과, 양성대조군으로 사용한 L. rhamnosus GG과 비교하여 장부착능을 보이는 10종의 유산균을 선발하였다. 선발된 10종의 유산균을 3T3-L1 세포에 처리하고 Oil Red O 시약으로 세포내 지방을 염색하여 지방축적도를 측정한 결과, 비처리군(non-treated)과 비교하여 OS-15, 48, 102, 120 유산균을 처리하였을 때 지방축적도가 유의적으로 감소함을 보였고 OS-48 유산균에서 지방축적 억제효과가 가장 큰 것으로 나타났다. 내산성, 내담즙성 및 장 부착능을 나타내며 지방축적 억제효과를 나타내는 김치유산균 OS-48에 대해 16S rRNA 염기서열분석에 기반하여 미생물동정을 수행하였을 때 99.93%의 신뢰도로 Lactiplantibacillus plantarum으로 동정되어 선발된 OS-48 균주를 Lactiplantibacillus plantarum OS-48로 명명하였다. 따라서 본 연구결과를 토대로 L. plantarum OS-48은 항비만 효과를 나타내는 프로바이오틱스로서 발효식품 및 기능성식품과 같은 식품 산업에서 매우 유용하게 활용될 수 있을 것으로 기대된다.
감사의 글
본 연구는 2020년도 오산대학교 교내 학술연구 조성비에 의해 수행되었으며 이에 감사드립니다.
References
Cho EJ, Rhee SH, and Park KY (1998) Standarization of kinds of ingredient in Chinese cabbage kimchi.
Korean J. Food Sci. Technol.
30, 1456-1463.

Jung CL, Shin HW, Yang JW, and Kim SJ (2020) Analysis of the current status of domestic probiotic products and future development plans.
J. Food Process Preserv.19, 120-133.

Kahan S and Manson JE (2019) Obesity treatment, beyond the guidelines: Practical suggestions for clinical practice.
Jama.321, 1349-1350.



Kang MR, Kim DR, Kim TW, Park SH, Kim HJ, Jang JY, and Han ES (2012) Selection of probiotic bacteria from yulmoo kimchi using a stimulated human intestinal model system.
Korean J. Food Nutr.
41, 396-401.


Kang SM, Yang WS, Kim YC, Joung EY, and Han YG(1995) Strain improvement of
Leuconostoc mesenteroides for kimchi fermentation and effect of starter
. Microbiol Biotechnol Lett.23, 461-471.

Kim SJ, Choi SO, Jang MR, Jeong YL, Kang CH, and Kim GH (2020) Anti-adipogenic effect of
Lactobacillus fermentum MG4231 and MG4244 through AMPK pathway in 3T3-L1 preadipocytes.
Food Sci. Biotechnol. 29(11), 1541-1551.




Kim SK and Lim SD (2017) Physiological characteristics and anti-obesity effect of
Lactobacillus plantarum K6 isolated from kimchi.
J. Dairy Sci. Biotechnol.35, 221-231.


Koutnikova H and Auwerx J (2001) Regulation of adipocyte differentiation.
Ann Med.
33, 556-561.



Lee CH and Ahn BS (1995) Literature review on kimchi, Korean fermented vegetable foods.
Korean J. Dietary Culture.10, 311-319.

Lee GH and Lee JH (2011) Isolation of
Leuconostoc and
Weissella species inhibiting the growth of
Lactobacillus sakei from kimchi.
J. Microbiol. Biotechnol.39, 175-181.

Lee HY, Park JH, Seok SH, Baek MW, Kim DJ, and Lee KE (2006) Human originated bacteria,
Lactobacillus rhamnosus PL60, produce conjugated linoleic acid and show anti-obesity effects in diet-induced obese mice.
Biochim. Biophys. Acta.176, 736-744.



Lee JY, Bae ES, Kim HY, Lee KM, Yoon SS, and Lee DC (2021) High-fat-diet-induced oxidative stress linked to the increased colonization of
Lactobacillus sakei in an obese population.
Microbiol. Spectr.9, 1-13.




Lee KH, Bong YJ, Lee HA, Kim HY, and Park KY (2016) Probiotic effects of
Lactobacillus plantarum and
Leuconostoc mesenteroides isolated from kimchi.
J. Korean Soc. Food Sci Nutr.45, 12-19.


Leung WY, Thomas GN, Chan JC, and Tomlinson B (2003) Weight management and current options in pharmacotherapy: Orlistat and sibutramine.
Clin. Ther.25: 58-80.



Ley RE, Turnbaugh PJ, Klein S, and Gordon JI (2006) Microbial ecology: Human gut microbes associated with obesity.
Nature.
444, 1022-1023.



Lim KS, Kim JY, Yea HS, and Kim CM (2013) Health effects of
Lactobacillus rhamnosus GG.
Curr. Top LAB Probiotics.
1(1), 55-64.


Lim YS, Kim JY, and Kang HC (2019) Isolation and identification of lactic acid bacteria with probiotic activities from kimchi and their fermentation properties in milk.
J Dairy Sci. Biotechnol.37, 115-128.


Marteau P, Cuillerier E, Meance S, Gerhardt MF, Myara A, Bouvier M, Bouley C, Tondu F, Bommelaer G, and Grimaud JC (2002)
Bifidobacterium animalis strain DN-173 010 shortens the colonic transit time in healthy women: A double-blind, randomized, controlled study.
Aliment Pharmacol. Ther.16, 587-593.



Mercenier A, Pavan S, and Pot B(2003) Probiotics as biotherapeutic agents: Present knowledge and future prospects.
Curr. Pharm. Des.9, 175-191.



O'Halloran S, Feeney M, Morrissey D, Murphy L, Thornton G, Shanahan F, O'Sullivan GC, and Collins JK (1997) Adhesion of potential probiotic bacteria to human epithelial cell lines. Poster in Conference: Functional Foods: Designer Foods for the Future, Cork, Ireland.

Ouwehand, AC, Kirjavainen PV, Shortt C, and Salminen S (1999) Probiotics: mechanisms and established effects.
Int. Dairy J.9, 43-52.


Park JH, Oh DH, and Chung HY (2012) Antimicrobial activity of
Lactobacillus sakei J4 isolated from Korean dongchimi and its probiotic properties.
Food Eng. Prog.16, 122-128.

Park HE, Do KH, J JW, J YH, and L WK (2018) Cholesterol and visceral fat lowering effects of combined lactic acid bacteria (
Lactobacillus casei WK3,
Enterococcus faecium WK5,
Bifidobacterium longum WK9, and
Lactobacillus plantarum K-1) in high fat diet-fed C57BL/6J mice.
J. Korean Soc. Food Sci. Nutr.
47(12), 1210-1216.


Park YJ (2017) Isolation and characterization of kimchi lactic acid showing antibacterial activity.
Microbiol. Biotechnol. Lett.26, 547-558.


Sommer F and Bäckhed F (2013) The gut microbiota-masters of host development and physiology.
Nat. Rev. Microbiol.
11, 227-238.



Yoon JA, Lee YJ, Park EH, Chung BH and Lim MD (2021) Health-promoting properties of lactic acid bacteria isolated from kimchi: A review.
J. Agri. Life Environ. Sciences.
33(3), 237-249.