서 론
코로나 19와 같은 감염병과 최근에는 원숭이 두창 등 감염병의 확산으로 면역력에 대한 관심과 이에 따른 기능성 식품의 소비는 증가되고 있는 실정이다. 면역 자극을 유도하는 물질로는 천연물(Shin et al., 2021), 포스트바이오틱스(Suh et al., 2022) 및 프로바이오틱스(Kim et al., 2016) 등의 물질이 대두되고 있다. 이 중 포스트바이오틱스는 숙주에게 건강상 이점을 제공하는 살아있지 않는 미생물의 형태로 대사산물을 포함하며(Zakrzewska et al., 2022), 명확히 정의되지는 않았으나 유산균에 의한 프로바이오틱스 뿐만 아니라, 숙주에 유익한 영향을 미치는 박테리아/진균 기원의 모든 물질을 포함한다고 알려져 있다(Scarpellini et al., 2021). 포스트바이오틱스는 생균인 프리바이오틱스에 비해 위산 및 담즙산에 영향을 덜 받는다는 장점이 있으며, 단쇄지방산(SCFA), 항균 펩타이드(AMPs), 세포 외 다당류(exopolysaccharide, EPS) 및 효소 등을 포함하여 항염증, 면역조절, 항균 및 항산화 작용 등 다양한 기능성을 가진다고 보고되고 있다(Kim and Park, 2021). Moradi et al.(2020)의 연구에서 포스트바이오틱스는 대부분 유산균에 의해 생성된 대사산물이 주를 이룬다고 보고하고 있으며, 진균(fungi) 기원의 대사산물에 의한 포스트바이오틱스의 개발은 상대적으로 미비한 실정이다.
버섯은 항균 및 면역조절 등의 다양한 치료 및 예방 효과가 있으며, 예로부터 약용식품으로 사용되어 왔다(Rathor et al., 2017). 현재, 버섯은 주로 열매부위인 자실체로 주로 섭취하였으나, 자실체는 높은 생산비용에 비해 낮은 생산력으로 산업적인 활용에는 어려움이 있는 것으로 알려져 있다(Park et al., 2012). 반면, 균사체를 통한 액체배양 포스트바이오틱스는 적절한 조건 선별 시 낮은 가격과 지속적인 생산력 등의 이점이 있어, 최근 버섯 균사체를 통한 포스트바이오틱스에 대한 많은 연구들이 보고되고 있다(Park et al., 2021; Suh et al., 2022; Shin et al., 2021a; Shin et al., 2022b). 상황버섯은 주로 뽕나무 줄기에 자생하고 갓 표면을 제외하고 황색을 띄는 진흙버섯속에 속하는 백색부후균으로, Phellinus 속인 P. linteus, P. ignarius 및 P. baumiiet al., 약 220종의 다양한 종이 보고되고 있으며, 국내에서는 주로 P. linteus와 P. baumii를 통해 재배와 유통이 이루어지고 있다(Sohn et al., 2020). 상황버섯은 항염증(Shin et al., 2021a), 항당뇨(Choi et al., 2012), 항산화(Kim et al., 2008) 및 면역증진(Lee et al., 2012) 등의 다양한 기능성이 보고되고 있다. 또한 유효물질로는 다당류, 플라보노이드, 폴리페놀 및 터르페노이드 등의 물질이 존재하며 우수한 약리활성을 가지고 있어, 다양한 질병을 예방 및 치료할 수 있다고 알려져 있다(Zhang et al., 2022). 이러한 상황버섯은 국내 재배농가의 98%가 P. baumii를 재배하고 있지만, P. linteus가 대표적으로 보고되어 왔으며, P. baumii의 효능 및 기전에 대한 연구는 미비한 실정이다(Kim et al., 2010).
따라서, 본 연구에서는 상황버섯(P. baumii) 균사체의 액체배양물로부터 균체와 배양액이 모두 포함되었거나 대사산물의 포스트바이오틱스 3개 획분 및 균사체만의 2개 획분으로 분획하고, 마우스 유래 대식세포주인 RAW 264.7 세포와 C3H/HeN 마우스로부터 분리된 비장과 Peyer’s patch를 통한 면역자극 활성을 평가하여, 균사체를 활용한 포스트바이오틱스의 면역자극 기능성 소재의 활용성을 검토하기 위한 기초자료를 제공하고자 하였다.
재료 및 방법
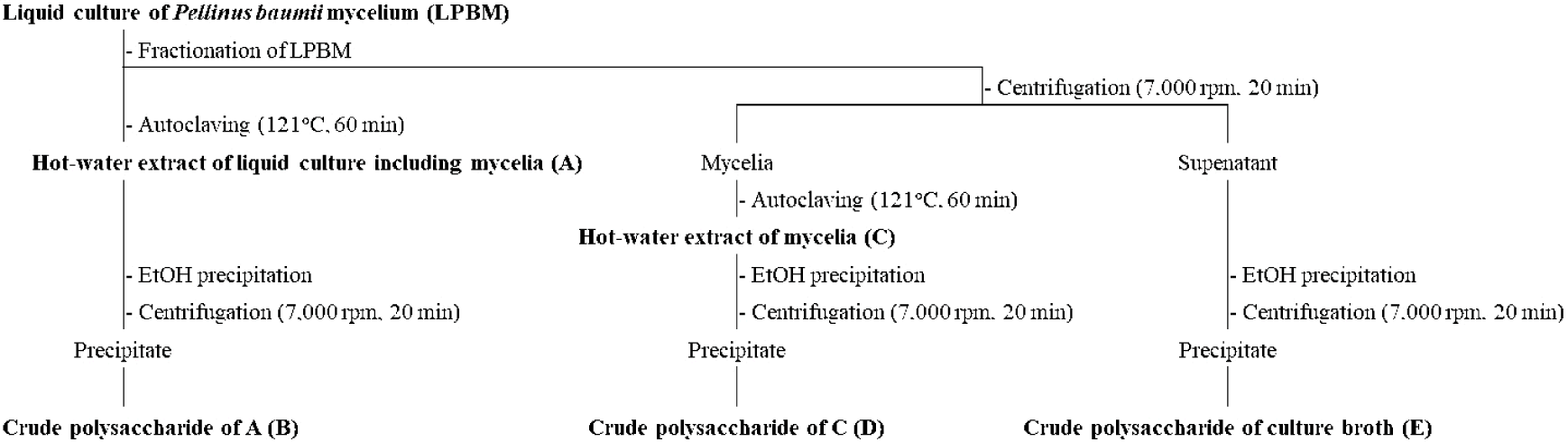
본 연구에서 사용된 상황버섯 균사체(P. baumii)는 한국미생물보존센터(KCCM; Seoul, Korea)에서 분양 받아 이용하였다. 상황버섯 균사체의 배양을 위해 Sigma-Aldrich(St. Louis, MO, USA)에서 구입한 potato dextrose agar(PDA), potato dextrose broth (PDB), calcium carbonate, magnesium sulfate, monosodium glutamate, corn starch 및 α-amylase 등을 이용하였으며, ㈜ 네오크레마(Neo Cremar Co., Ltd, Seoul, Korea)에서 Shin et al. (2022)의 연구와 동일한 방법을 이용하여 상황버섯 균사체의 1차 배양을 진행하였다. 배양한 균주는 초저온냉동고(Ilshin Biobase, Dong-ducheon, Korea)에서 freeze-drying vegetative mycelium으로 보관하여 실험에 이용되었다. 이후 2차 배양은 1차 배양배지와 동일한 배지를 이용하여 28°C, 150 rpm의 조건에서 5일간 배양하였으며, 최종적으로 본배양은 5 L 발효기(Fermentec, Cheongju, Korea)에 37°C, 500 rpm의 조건에서 10일간 배양되었다. 한편, 상황버섯 균사체 액체발효물(liquid culture of Phellinus baumii, LPBM)은 Fig. 1과 같이 분획되었다. 먼저, 균사체가 포함된 액체발효물인 LPBM은 121°C에서 60분간 고압멸균하에 추출하여 포스트바이오틱스 열수추출물(hot-water extract of liquid culture including mycelia; A)로 조제하였다. 또한, 액체배양액을 원심분리(7000 rpm, 20 min)하여 배양액과 균사체로 분리하였으며 분리된 균사체는 앞선 과정과 동일하게 열수추출물(hot-water extract of mycelia; C)로 조제되었다. 포스트바이오틱스 열수추출물(A)과 균사체 유래 열수추출물(C)은 소량의 증류수에 용해하여 3배량(v/v)의 95% 주정을 첨가한 후 침전물만을 선택적으로 회수하여 농축 및 동결건조하여 A와 C 획분의 조다당 획분(B 및 D)으로 조제하였다. 한편, LPBM으로부터 원심분리를 통해 균사체와 분리된 배양상등액도 동일한 방법으로 처리하여 대사산물의 포스트바이오틱스인 조다당 획분(crude polysaccharide of culture broth; E)으로 분획하였다.
동물실험은 경기대학교 동물실험윤리위원회 심의(승인번호: 2021-001)를 거친 후 진행하였으며, 생후 6주령의 C3H/HeN 마우스(♀)를 새론바이오(Uiwang, Gyeonggi, Korea)로부터 구입하였다. 실험동물의 사료와 물은 자유롭게 섭취할 수 있도록 하였으며 항온 및 항습 조건(온도 25±1°C, 55±5%)을 유지하고 인공조명에서 명암교대를 1일 12시간을 유지하였다. 실험동물은 1주일간 적응기간을 거쳤으며, 비장과 Peyer’s patch를 통한 면역자극 활성 평가에 이용되었다.
마우스 유래 RAW 264.7 세포주는 한국세포주은행(Korean Cell Line Bank; KCLB, Seoul, Korea)에서 입수하였으며, Dulbecco’s Modified Eagle Medium(DMEM; Hyclone, San Angelo, TX, USA) 배지에 10% fetal bovine serum(FBS; Gibco, Waltham, Massachusetts, USA)과 1% penicillin-streptomycin(P/S; GenDEPOT, Katy, TX, USA)을 첨가한 배지에서 배양되었다. 세포주는 37°C, 5% CO2가 유지되는 배양기(Thermo Fisher Scientific, Waltham, MA, USA)에서 계대배양을 진행하여 연구에 이용되었다. 상황버섯 균사체 유래 포스트바이오틱스와 균사체 획분의 대식세포 자극활성을 평가하기 위해 RAW 264.7 세포주를 1.6 × 105 cells/well로 96 well plate에 분주하여 배양기에서 세포주가 monolayer를 형성할 때까지 배양하였다. 이후 배양 상등액을 제거하고 serum-free DMEM(SFM)을 180 μL를 분주하고 5개 획분을 각각 20 μL를 첨가하여 24시간 동안 재배양하였다. 시료에 의한 세포독성 평가는 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide(MTT; Invitrogen, Eugene, OR, USA) 시약을 통해 분석하였으며, 시료 무처리군에 대한 세포 생존율(cell viability; %)로 나타냈다. 시료 처리에 의해 생성된 산화질소(nitric oxide; NO)의 함량은 griess reagent를 통해 측정하였으며 sodium nitrate를 이용하여 표준곡선을 작성하고 함량을 μM로 나타냈다. 대식세포 자극 인자인 interleukin-12(IL-12)는 BD Bioscience(San Diego, CA, USA)에서 구입한 enzyme-linkage immunosorbent assay(ELISA kit)를 이용하여 측정되었으며, 각 제조사에서 제공된 recombinant protein을 이용하여 표준곡선을 작성한 후 함량을 pg/mL로 나타냈다.
1주일간의 적응기간을 거친 마우스를 경추탈구시킨 후 멸균적으로 비장을 적출하고 금속망(100 mesh)에 여과하여 세포를 회수하였다. 이후 적혈구를 제거하기 위해 0.2% NaCl을 처리하여 적혈구를 제거했으며 회수한 비장세포는 4.5×105 cells/well로 96 well plate에 분주하고 포스트바이오틱스와 균사체 획분을 첨가하여 48시간 동안 배양하였다. 이후 배양 상등액을 회수하고, Ez- cytox(DoGenBio, Seoul, Korea)를 처리하여 시료 무처리군 대비 마이토젠 활성(mitogenic activity; %)을 나타냈다. 한편, 비장세포 배양액에 존재하는 tumor necrosis factor-α(TNF-α)는 Invitrogen에서 구입한 ELISA kit를 통해 분석하였으며, interferon-γ(IFN-γ)는 BD Bioscience에서 구입한 ELISA kit를 이용하여 제조사에서 제공된 recombinant protein을 이용하여 표준곡선을 작성한 후 함량을 pg/mL로 나타냈다.
1주일간 적응기간을 거친 마우스를 경추탈구를 시킨 후 Yang et al.(2004)의 방법에 따라 Peyer’s patch를 경유한 장관면역 활성을 측정하였다. 요약하면 C3H/HeN 마우스의 소장에 존재하는 Peyer’s patch를 잘라내어 조직을 금속망에 여과하여 Peyer’s patch 세포를 회수하였다. Peyer’s patch 세포 현탁액을 3.5× 105 cells/well로 96 well plate에 분주하고 포스트바이오틱스와 균사체 획분을 첨가하여 5일간 배양하였다. 이후 배양 상등액을 회수하고 배양액에 존재하는 granulocyte-macrophage colony- stimulating factor(GM-CSF)는 BD Bioscience에서 구입한 ELISA kit를 이용하여 제조사에서 제공된 recombinant protein을 이용하여 표준곡선을 작성한 후 함량을 pg/mL로 나타냈다. 한편, 골수세포 증식능을 측정하기 위해 동일종의 마우스의 대퇴부 뼈를 이용하여 회수하였으며, 주사기를 이용하여 뼈속으로 SFM을 주입하여 골수세포를 채취한 후 여과하여 상기 제시된 방법과 같이 적혈구를 제거하였다. 이후 골수세포액을 1.3×105 cells/well로 96 well plate에 분주하고 Peyer’s patch 배양액을 첨가하여 6일간 배양하였다. 배양 후 Peyer’s patch를 경유한 골수세포 증식능을 분석하기 위해 Ez-cytox를 처리하여 시료 무처리군 대비 골수세포 증식능(BMC proliferation through PP; %)을 분석하였다.
상황버섯 균사체 액체발효물로부터 분획된 포스트바이오틱스와 균사체 획분의 구성분을 평가하기 위해 중성당, 산성당, 단백질 및 폴리페놀 함량을 분석하였다. 중성당의 경우, 표준물질로 glucose를 이용하여 phenol-sulfuric acid법(Dubois et al., 1956)을 통해 분석하였으며, 산성당의 경우 표준물질 glucuronic acid를 이용하여 m-hydroxybiphenyl법(Blumenkrantz and Asboe- Hansen, 1973)을 통해 분석하였다. 단백질 함량은 bovine serum albumin(BSA)를 표준물질로 하여 Bradford(1973)의 방법에 따라 측정하였으며, 총 폴리페놀 함량은 Kim et al.(2021)의 법을 변형하여 표준물질로 gallic acid를 이용하여 측정하였다. 각각 중성당, 산성당, 단백질 및 총 폴리페놀 함량은 %(w/w)로 나타내었다. 구성당 분석의 경우, Honda et al.(1989) 및 Shin et al.(2022)의 방법을 참고하여 HPLC-UV를 이용하여 분석하였다. 포스트바이오틱스와 균사체 획분을 trifluoroacetic acid를 이용하여 가수분해를 진행하고, 단당류 단위로 분해하였다. 이후 NaOH와 1-phenyl-3-methyl-5-pyrazoline(PMP)를 반응하여 단당류에 PMP를 결합시킨 후 HCl을 첨가하여 중화하고 물과 클로로포름을 이용하여 분리 및 추출을 진행한 후 물 층만을 선택적으로 분리하고 PVDF membrane filter(0.45 μm, Jaema Trade Inc., Gangwon-do, Korea)로 여과한 후 Table 1과 같은 조건으로 분석하였다. 분석결과는 peak area와 response factor를 고려하여 mole%로 나타냈다.
모든 시험은 3번 반복하여 분석하였으며, 결과는 평균±표준편차(standard deviation; SD)로 나타냈다. 분석 결과는 Statistical Package for the Social Science(SPSS V26, SPSS Inc., Chicago, IL, USA)를 이용하여 분산의 동질성을 비교하기 위해 Levene’s test를 실시한 후, 동질성을 갖는 경우 분산분석(analysis of variance; ANOVA)을 실시한 후 분석 값 간의 유의성을 사후분석 Duncan’s multiple range test로 p<0.05 수준에서 검증하였다.
결과 및 고찰
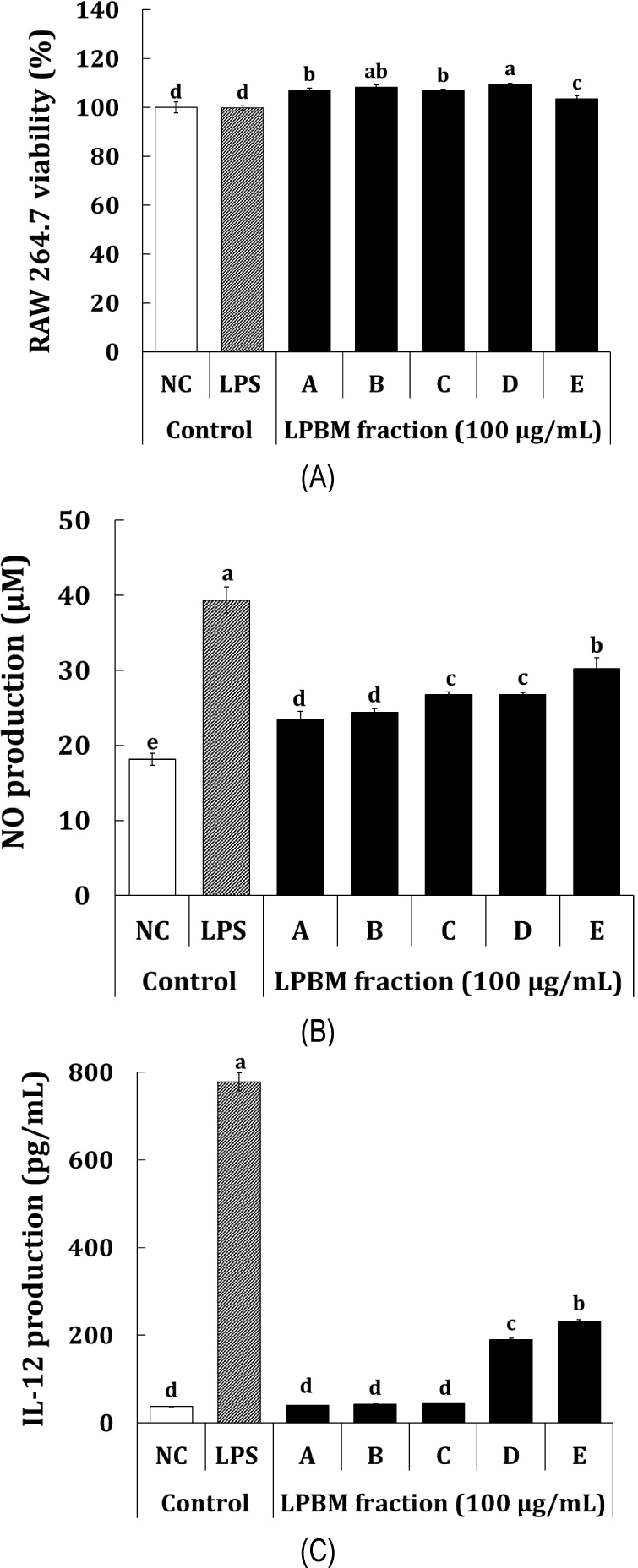
본 연구에서 이용된 마우스 유래 대식세포주인 RAW 264.7 세포는 선천면역계를 대표하는 세포로 적응면역이 작용하기 이전에 일차적으로 신속하게 숙주의 방어 역할을 하는 것으로 알려져 있다(Shin et al., 2021; Yu et al.,. 2012). 또한, 대식세포는 선천면역뿐만 아니라, 적응면역에도 관여하며, 사이토카인(케모카인)의 분비, 식세포 작용 등의 작용을 통해 외부의 물질들에 대해 숙주를 보호하고 항상성을 유지한다(Son et al., 2022). 따라서, 본 연구에서는 선천면역계를 대표하는 RAW 264.7 세포주를 통해 대식세포 자극 활성에 관여하는 인자를 확인함으로써, 상황버섯 균사체 액체발효물 유래 포스트바이오틱스의 면역활성 관련 기능성 소재로서의 활용가능성을 확인하였다. 먼저, Fig. 2A에는 시료 처리에 따른 RAW 264.7 세포주의 세포독성 평가를 나타냈다. LPBM 유래 획분 5종은 100 μg/mL의 농도에서 무처리군(negative control, NC) 대비 90% 이상의 세포 생존율을 확인하였는데, Lopez-Garcia et al.(2014)에 따르면 무처리군 대비 세포생존율이 80% 이상이면 세포독성이 없다고 평가하기 때문에 위 농도범위에서 LPBM 유래 모든 획분은 유의적으로 세포독성을 나타내지 않는 것으로 확인되었다. 산화질소(NO)는 세포 내 감염을 일으키는 미생물, 암세포 등 외부물질로부터 숙주를 보호하는 방어기전에 중요한 역할을 하는 질소 중간체로 알려져 있으며(Yoo et al., 2022), 시료 처리에 따른 NO의 생성능은 Fig. 2B에 나타냈다. 양성대조군으로 이용된 lipopolysaccharide(LPS; 1 μg/mL)는 NC 대조군(18.1 μM) 대비 39.3 μM(2.2배)의 통계적으로 유의한 NO 생성능을 나타냈으며, 포스트바이오틱스와 균사체 획분 중에서는 NC 대조군 대비 배양상등액을 주정 침전한 E획분이 30.3 μM(1.7배)의 통계적으로 가장 우수한 NO 생성능이 확인되었다. 또한, 균사체의 C 획분 및 D 획분은 NC 대조군 대비 각각 26.8 μM(1.5배) 및 26.7 μM(1.5배)의 유사한 NO 생성능이 확인되었으며, 균사체와 배양액의 포스트바이오틱스인 A획분(23.5 μM; 1.3배)과 B획분은 24.4 μM(1.3배)의 NO 생성능이 확인되었다. T-helper type 1(Th1)의 면역반응을 유도하며 NK 세포의 활성화를 통해 암세포와 같은 외부물질에 면역반응을 유도하는 것으로 알려진 IL-12 생성능은 Fig. 2C에 나타냈다(Kim DS 와 Shin KS, 2014). 양성대조군인 LPS의 경우, NC 대조군(37.6 pg/mL) 대비 778.2 pg/mL(20.7배)의 통계적으로 유의한 IL-12 생성능을 나타냈으며, NO 생성능 결과와 유사한 경향으로 배양상등액을 주정 침전한 E획분이 230.4 pg/mL(6.1배)의 IL-12 생성량을 나타내어 통계적으로 가장 우수한 것으로 확인되었다. D 획분은 NC 대조군 대비 190.2 pg/mL(5.1배)의 IL-12 생성능을 나타냈으며, A, B 및 C 획분은 통계적으로 유의한 IL-12 생성능은 확인되지 않았다. Kim et al.(2009)의 연구에서 따르면, 주정 침전을 통해 조제된 조다당 획분은 다당류 및 단백 다당 등 고분자 물질을 포함하는 것으로 알려져 있는데, 포스트바이오틱스 획분의 대식세포 분석 결과를 통해 대식세포 자극 활성에 다당류 혹은 단백 다당 등이 관여하는 것으로 추정되었다. 또한, Shin et al.(2022)은 P. linteus 상황버섯 균사체로 조제된 액체발효물 중 균사체를 제거하고, 주정 침전을 통해 조제된 배양액 대사물의 포스트바이오틱스 조다당 획분이 우수한 대식세포 자극 활성을 가진다고 보고하였는데, 이는 본 연구결과와 유사한 것으로 판단되며, 주정 침전을 통해 분획된 대사산물 포스트바이오틱스 유래 다당류가 대식세포를 자극하는 것으로 판단되었다. 종합적으로, 상황버섯 균사체 액체발효물로부터 분획된 포스트바이오틱스와 균사체 획분은 위 농도범위에서 통계적으로 유의한 세포독성은 확인되지 않았고 대식세포 자극 활성분석결과, 배양상등액을 주정 침전으로 분획한 조다당획분인 포스트바이오틱스 E가 가장 우수한 활성을 나타내는 것으로 확인되어 면역관련 기능성 소재로서의 활용이 가능할 것으로 사료되었다.
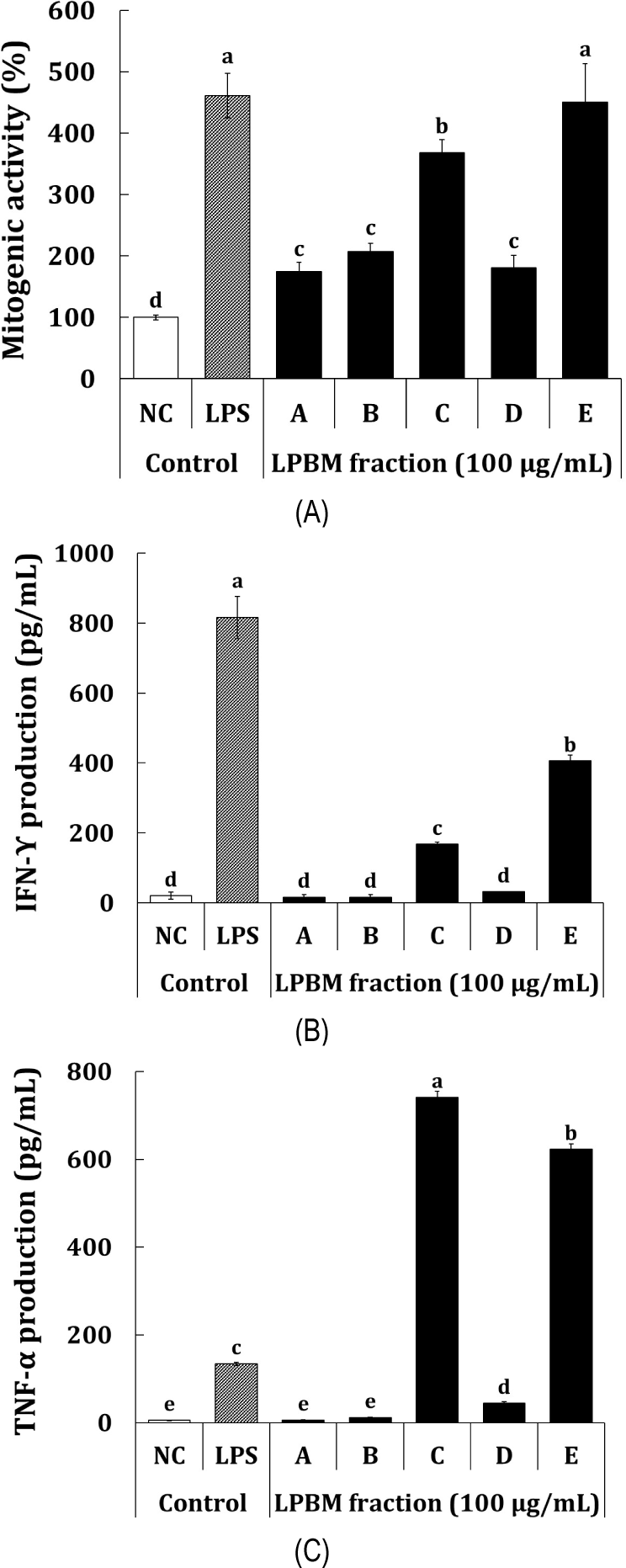
비장(spleen)은 체내 들어온 항원으로부터 B cell 및 T cell의 성숙과 항원에 의해 림프구의 분화가 이루어지는 주요 림프기관으로서 비장의 림프구 증식은 면역활성에 주요한 역할을 가진다(Son 과 Shin, 2021). 따라서, 림프구 증식을 유도하는 물질의 처리, 림프구의 자극, 분열 유도를 확인하는 마이토젠 활성은 면역 활성에 중추적인 역할을 한다. 마이토젠 활성을 분석하기 위해 C3H/HeN 마우스로부터 비장을 채취하고 비장세포에 포스트바이오틱스와 균사체 획분을 처리하여 primary culture 후 세포 증식능을 통해 마이토젠 활성을 분석하였다(Fig. 3A). 양성 대조군으로 이용된 LPS는 B cell 마이토젠으로 알려져 있으며(Coutinho et al., 1977), 1 μg/mL의 농도에서 NC 대조군 대비 431.7 %의 마이토젠 활성을 나타냈다. 시료의 경우에는 상황버섯 균사체 배양상등액을 주정 침전한 포스트바이오틱스인 조다당 획분 E가 NC 대조군 대비 460.5%의 통계적으로 유의한 마이토젠 활성을 나타냈으며, 양성대조군으로 이용된 LPS와 유사한 수준으로 확인되었다. 한편, 균사체 획분 C는 NC 대조군 대비 368.3%의 통계적으로 유의한 마이토젠 활성을 나타냈으며, 균사체가 포함된 포스트바이오틱스인 획분 A, B와 균사체 획분인 D는 각각 174.5%, 207.2% 및 180.6%의 통계적으로 유사한 마이토젠 활성을 나타냈다. 비장세포의 세포배양액을 회수하여 비장세포 마이토젠 활성과 관련된 사이토카인 IFN-Υ 및 TNF-α를 ELISA 법을 이용하여 분석하였다. IFN-Υ 및 TNF-α는 대표적인 Th 1 세포-매개 면역 반응 활성화는 알아볼 수 있는 사이토카인으로 T 림프구의 CD4+ 수용체가 면역반응에 의해 활성화되는 것으로 알려져 있다(Seo et al., 2013). 먼저, IFN-Υ의 분석결과는 Fig. 3B에 나타냈다. 양성대조군으로 이용된 LPS는 NC 대조군(20.5 pg/mL) 대비 816.4 pg/mL(39.8배)의 생성량을 나타냈다. 시료에서는 배양상등액을 주정 침전한 E 획분이 NC 대조군 대비 405.9 pg/mL(19.8배)의 가장 우수한 IFN-γ 생성능을 나타냈으며, 균사체 획분 C는 NC 대조군 대비 167.7 pg/mL(8.2배)의 IFN-γ 생성능을 나타냈다. 반면, 획분 A, B 및 D는 NC 대조군 대비 통계적으로 유의한 IFN-γ 생성능은 나타나지 않았다. TNF-α 생성능 결과는 Fig. 3C에 나타냈다. 양성대조군으로 이용된 LPS는 1 μg/mL의 농도에서 NC 대조군(5.5 pg/mL) 대비 134.2 pg/mL(24.6배)의 통계적으로 유의한 TNF-α 생성능을 나타냈다. 포스트바이오틱스와 균사체 획분의 경우, IFN-γ 생성능과는 조금 다른 경향이 나타나 균사체 획분 C가 NC 대조군 대비 741.3 pg/mL(135.6배)의 통계적으로 가장 우수한 TNF-α 생성능을 나타낸 반면, 대사물 포스트바이오틱스 획분 E는 NC 대조군 대비 622.8 pg/mL(114.0배)의 통계적으로 유의한 TNF-α 생성능을 나타내었다. 균사체가 포함된 포스트바이오틱스인 획분 A 및 B는 통계적으로 유의한 TNF-α 생성능은 확인되지 않았다. 본 연구에서는 Th-1 관련 세포성 면역에 대해 사이토카인을 분석하였으며, 추가적으로 Th-2 관련 체액성 면역과 관련된 사이토카인의 분석 또한 필요할 것으로 판단된다(Kang et al., 2014). 종합적으로, 대식세포를 통한 면역자극 활성 및 마이토젠을 포함한 비장세포의 면역활성 평가결과, 상황버섯 균사체의 액체발효물로부터 배양상등액을 주정 침전한 포스트바이오틱스 E 획분이 가장 우수한 것으로 판단되며, 포스트바이오틱스에 EPS가 많이 함유되어 있을 것으로 추정되는 조다당획분이 대식세포를 통한 선천면역과 비장세포를 통한 적응면역을 관여하는 것으로 사료된다.
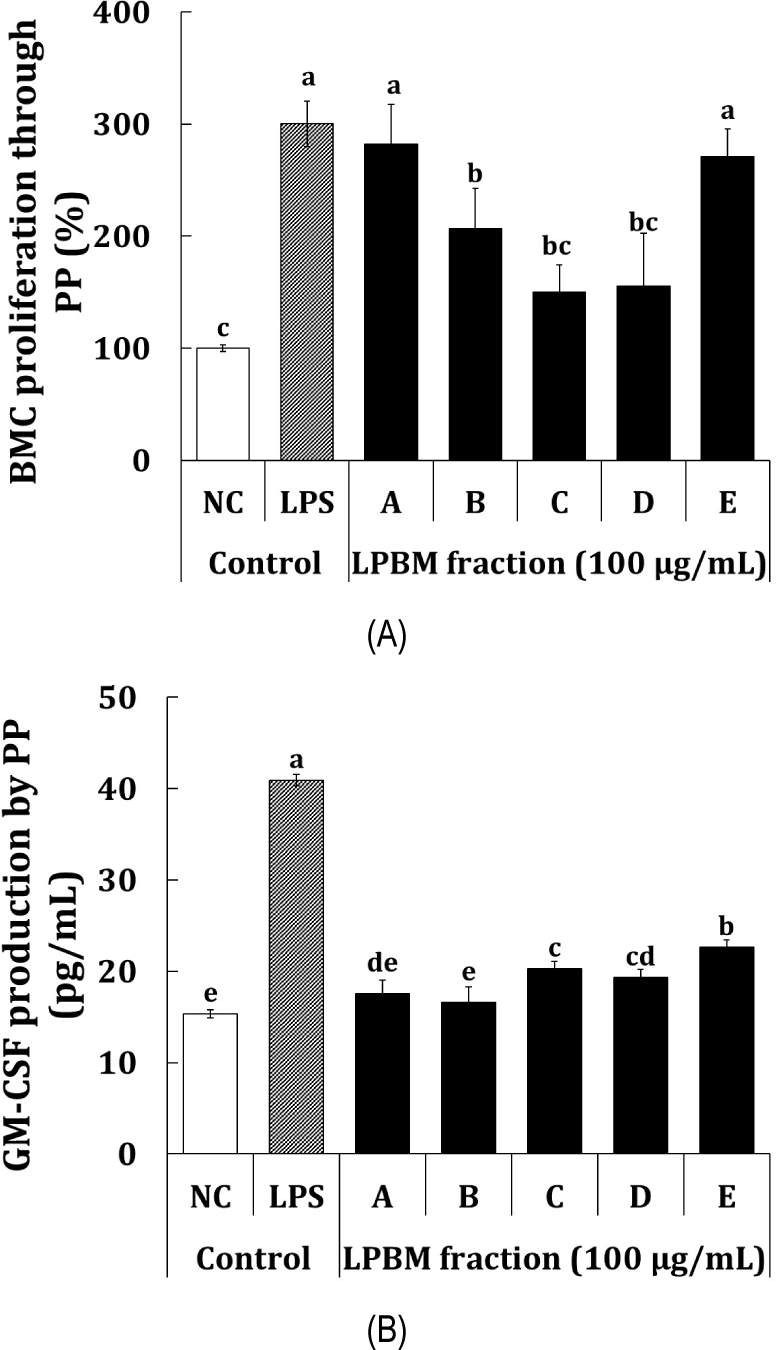
점막림프기관(mucosa-associated lymphatic tissue, MALT)는 생체 림프조직의 1/3을 차지하고 있으며, 영양소들의 소화와 흡수의 중추적인 작용을 하며 외부물질로부터 방어장벽 역할을 수행할 뿐만 아니라, 면역학적인 방어기관을 담당하고 있다(Yu KW and Shin KS, 2001). Peyer’s patch는 점막 림프기관 중 장관림프상 조직(gut associated lymphoid tissue, GALT)에 존재하며, 장내 및 외부 항원의 수송과정을 담당하는 microflora 세포가 존재하고 각종 면역세포(B cell, T cell, 대식세포 및 수지상세포)가 집합하여 Peyer’s patch 내 세포들의 활성화를 통해 cytokine의 생성과 면역글로블린의 생성을 유도하는 것으로 알려져 있다(Lee MS and Shin KS, 2014). 또한, 골수세포는 다양한 면역세포들이 생성되고 성숙하며 조혈모세포라는 동일한 전구세포에서 생성되어 전신을 순환하기 때문에 면역학적으로 매우 중요하다(Mohamed et al., 2021). 따라서, 상황버섯 균사체 액체발효물 유래의 포스트바이오틱스와 균사체 획분의 처리에 따른 Peyer’s patch를 경유한 골수세포 증식능을 분석하였다(Fig. 4A). 양성대조군으로 이용된 LPS는 1 μg/mL의 농도에서 NC 대조군 대비 300.3%의 통계적으로 유의한 골수세포 증식능이 확인되었다. 5종 획분의 골수세포 증식능 분석결과, 균사체 포함 또는 배양상등액을 주정 침전한 포스트바이오틱스 획분 A 및 E가 NC 대조군 대비 각각 281.9% 및 271.0%의 통계적으로 가장 우수한 골수세포 증식능이 확인되었고, 조다당 획분인 B 획분의 경우, NC 대조군 대비 206.9%의 통계적으로 유의한 골수세포 증식능이 확인되었으며, 균사체의 C 및 D 획분은 통계적으로 유의한 골수세포 증식능이 확인되지 않았다. Peyer’s patch는 주로 T 세포 및 B 세포와 구성되어 있는데 T 세포는 대식세포와 함께 다양한 cytokine과 GSF를 생성하며, 이는 골수세포 증식에 관여하는 것으로 알려져 있다(Mosmann 과 Coffman, 1989). 따라서, 골수세포와 관련된 증식인자를 확인하기 위해 Peyer’s patch 배양액에 존재하는 GM-CSF를 분석하였으며, 분석결과는 Fig. 4B에 나타냈다. 양성대조군으로 이용된 LPS는 1 μg/mL의 농도에서 NC 대조군(15.3 pg/mL) 대비 40.9 pg/mL(2.7배)의 통계적으로 유의한 GM-CSF 생성능이 확인되었다. 시료에서는 배양상등액을 주정 침전한 포스트바이오틱스 획분 E가 NC 대조군 대비 22.6 pg/mL(1.5배)의 통계적으로 가장 우수한 GM-CSF 생성능이 나타났다. 획분 C는 NC 대조군 대비 20.3 pg/mL(1.3배)의 통계적으로 유의한 GM-CSF 생성능을 나타냈으며, A 및 D는 각각 17.6 pg/mL(1.1배 및 19.3 pg/mL(1.3배)의 유의한 GM-CSF 생성능이 확인되었다. 반면, B 획분의 경우, NC 대조군과 통계적인 유의한 골수세포 증식능은 확인되지 않았다. Ketley와 Newland(1997)의 연구에서 GM-CSF외에 interleukin-6, IL-3 및 IL-1 등이 조혈모세포 증식인자로 보고되고 있으며, GM-CSF외에 추가적으로 골수세포 증식에 관여하는 사이토카인의 분석이 필요할 것으로 판단된다.
종합적으로 상황버섯 균사체 액체발효물 유래 배양상등액을 주정 침전한 포스트바이오틱스 E가 대식세포 자극활성, 비장세포를 통한 마이토젠 활성과 사이토카인 생성능 및 Peyer’s patch를 경유한 장관면역 활성에 우수한 것으로 보여, 균사체를 활용한 포스트바이오틱스의 면역 관련 기능성 소재로서 활용이 가능할 것으로 제시되었다. 또한, Suh et al.(2022) 및 Shin et al.(2022)은 상황버섯 균사체(P. linteus) 액체배양물을 포스트바이오틱스로 활용하기 위해 대식세포, 비장세포 및 장관면역 등의 면역활성에 대한 연구를 보고하였으며, 본 연구에서는 상황버섯 균사체이지만, 다른 균종인 P. baumii의 연구결과를 제시함으로써 향후 상황버섯 균사체 액체발효물 유래의 포스트바이오틱스를 활용한 면역 관련 기능성 소재의 활용가능성이 제시될 수 있을 것으로 판단된다.
최근, 상황버섯 균사체(P. linteus) 유래 포스트바이오틱스는 높은 함량의 EPS를 포함하는 것으로 보고되었다(Shin et al., 2021, Shin et al., 2022). 특히, 중성당인 glucose를 약 90% 이상 주로 함유하며, 활성/지표물질로서 β-1,3:1,6 glucan을 제시하고 있다(Suh et al., 2022). 따라서, 상황버섯 균사체 P. baumii 유래 면역활성 포스트바이오틱스의 구성분 분석을 진행하였으며, 결과는 Table 2에 나타냈다. 포스트바이오틱스와 균사체 획분은 모두 중성당(A; 78.4%, B; 78.1%, C; 80.5%, D; 74.0%, E; 73.8%)을 가장 높은 함량을 나타냈으며, 산성당은 7.3~15.4%를 함유하는 것으로 나타났다. 단백질과 폴리페놀은 각각 2.7~7.8% 및 3.8~7.8%를 함유하여 비교적 소량 함유하는 것으로 나타났다. Suh et al.(2022)과 Shin et al.(2022)의 P. linteus 유래 포스트바이오틱스 구성분과 비교해 보았을 때, P. baumii는 유래 5종 획분은 중성당 함량은 비교적 적었으며, 산성당의 함량이 높아진 것에 따라 균사체의 종에 따라 서로 다른 다당류를 생산하는 것으로 추정되었다. 한편, 활성 조다당 획분인 포스트바이오틱스(E)의 PMP 유도체의 HPLC-UV를 이용한 구성당 분석결과(Table 3), 면역자극 활성획분인 E는 glucose(39.1%), galactose(21.7%), mannose(11.1%), galacturonic acid(9.3%) 및 arabinose(8.9%)를 함유했으며, 소량의 glucuronic acid(2.6%), xylose(2.3%), fucose(2.0%) 및 rhamnose(1.5%)를 함유하는 것으로 확인되었다. 결론적으로 높은 함량의 glucose와 P. linteus 균사체에서 생성된 EPS 안에 β-glucan을 함유한다는 보고(Shin et al., 2021) 및 galactose와 mannose를 통해 면역활성 포스트바이오틱스인 E 획분은 β-glucan, galactomannan 및 mannan 등의 fungi 세포벽 유래 다당류로 추정할 수 있었다(Baker et al., 2008). 추가적으로 galacturonic acid가 P. baumii 균주 유래 EPS에서 특이적으로 분석되는 것으로, 향후 면역활성 포스트바이오틱스인 E 획분의 정확한 구조를 규명하기 위해 anion exchange, size-exclusion chromatography, partially methylated alditol acetate(PMAA) 및 mass spectrometry를 통한 구조적 특성에 대한 연구가 필요할 것으로 사료된다.
| E fraction | |
|---|---|
| Sugar | mol % |
| Mannose | 11.1±0.1 |
| Rhamnose | 1.5±0.2 |
| Glucuronic acid | 2.6±0.1 |
| Galacturonic acid | 9.9±0.5 |
| Glucose | 39.1±0.6 |
| Galactose | 21.7±0.3 |
| Xylose | 2.3±0.0 |
| Arabinose | 8.9±0.2 |
| Fucose | 2.0±0.2 |
요 약
상황버섯(P. baumii) 균사체의 액체배양을 준비한 후, 면역자극 활성이 있는 기능성 물질로서의 가능성을 평가하기 위해 5종의 획분(A~E)으로 분리하였다. 대식세포 자극 활성 결과, 포스트바이오틱스 E 획분은 RAW 264.7 세포에서 NO와 IL-12의 분비를 유의미하게 증가시켰으며, C3H/HeN 마우스의 비장세포를 통해 초대배양을 진행하였을 때 E 획분이 비장세포로부터 사이토카인의 생성과 마이토젠 활성에 유의한 자극을 나타냈다. 또한, Peyer’s patch 매개 골수세포 증식과 Peyer’s patch 세포로부터 GM-CSF 생성을 유도하였다. 면역 자극 획분 E의 구성분 분석결과, 중성당(73.8%), 산성당(10.6%), 단백질(7.8%) 및 폴리페놀(7.5%)를 함유하였으며, 구성당 분석결과, glucose(39.1%), galactose(21.7%), mannose(11.1%), galacturonic acid(9.9%) 및 arabinose(8.9%) 등이 분포하였다. 결론적으로, P. baumii 액체배양에서 분리된 포스트바이오틱스로부터 EPS가 포함된 다당류가 면역자극 활성을 향상시키는 것으로 사료된다.







