서 론
프로바이오틱스는 적절한 양을 섭취했을 때 숙주에게 건강상의 이점을 주는 살아있는 미생물이다(Hotel et al., 2001). 이런 프로바이오틱스 시장은 면역 강화, 장 건강, 체중관리 등의 기능성과 예방적 건강 관리 전략에 대한 소비자 인식 확대 및 이에 도움을 줄 수 있는 유익한 제품에 대한 선호도 증가에 따라 커지고 있다. 글로벌 프로바이오틱스 시장은 2021년 631억 1천만 달러의 시장 규모였으며, 2030년까지 연 평균 성장률(CAGR)이 8.7%로 지속적인 성장이 예상된다(Gundogdu et al., 2023).
상업적으로 사용되고 있는 프로바이오틱스는 다양한 종류의 유산균과 Bifidobacterium, Streptococcus의 일부 균주로 구성된다(Zheng et al., 2020). 그리고 Bacillus spp. 균주의 일부는 체내의 위장 조건을 견딜 수 있는 능력을 기반으로 프로바이오틱스로 사용되었다 (Lee et al., 2019). 그 외에도 Saccharomyces cerevisiae, Akkermansia muciniphila 등의 미생물들도 프로바이오틱스로 사용되거나 제안되었다(Zhai et al., 2019; Sen & Mansell, 2020). 위와 같은 다양한 프로바이오틱스는 캡슐, 액상, 분말 등의 다양한 형태로 제공되기 위해 동결건조 방법을 통해 분말 제형으로 가공되고 있으며, 이 과정 중 균체의 손상을 방지하기 위해 trehalose, skim milk 등을 동결보호소재로 사용한다(Borchers & Pieler, 2010; Kang et al., 2017).
프로바이오틱스의 개발 및 산업화에 있어서 주요한 공정은 각각 균주에 적합한 배지 조성 선정, 대량 배양, 제형 공정으로 구분된다. 여기서 배지는 미생물을 발육시키는 영양소, 염류, 미량원소 등을 포함하여 조성된다. 이는 균주의 특성에 따라 필요한 영양 요구성과 생육 특성의 차이가 크기 때문에, 각각의 특성에 따라 배지 조성 및 배양 조건을 최적화하고, 스케일 업 공정을 통해 생산성을 증대하였다(Park et al., 2019). 일반적으로 사용되는 유산균 배지인 MRS 배지는 최적화되어 있지 않고, 가격이 높아서 프로바이오틱스의 대량생산을 위한 배지로 이용되기에 많은 제한이 따른다(Moon et al., 2013).
본 실험에서는 김치에서 분리한 균주인 Lactiplantibacillusplantarum WiKim0125를 프로바이오틱스 산업화에 응용할 수 있도록 생산성 증대 및 가격 경쟁력 강화를 위해 배지 조건 탐색을 통해 새로운 배지를 개발하였고, 5 L 규모의 배양기를 통해 최적의 배양 조건을 선정한 후 50 L 규모의 대량배양에 적용하였다. 그리고 최적화 배지 및 MRS 배지에서 배양한 Lactiplantibacillus plantarum WiKim0125를 동결건조하여 그 생존율을 확인하였다.
재료 및 방법
본 실험에 사용한 균주는 광주광역시 전통시장에서 구매한 배추김치에서 분리한 Lactiplantibacillusplantarum WiKim0125를 사용하였다. 균체 배양을 위해 MRS agar와 broth(Difco, Detroit, MI, USA)를 사용하였고, 균주 보존을 위해 균 배양액에 glycerol이 17%(v/v)가 되도록 조성하여 -70°C 에서 보관하며 실험에 사용하였다. L. plantarum WiKim0125 배양액은 1%(v/v) 농도로 멸균된 MRS broth에 접종하여 30°C, 24시간 배양하였다. 본 배양은 멸균된 각각의 배지에 동일 조건으로 배양하였다. 각 단계별 생균수는 배양액이나 분말을 희석한 후 MRS agar plate에 도말하고, 48시간 배양하여 측정하였다.
균체 수율 및 대사산물 생산량 최적화를 위한 지표로 배양액의 당 및 유기산 성분을 분석하였다. 배양액은 0.22 μm filter를 사용하여 여과한 후 기질 소비량 및 대사산물 생산량 측정에 사용하였다. 기질 소비량 측정은 high-performance liquid chromatography(HPLC)와 RI detector(2414; Waters, Milford, MA, USA), Shodex NH2P-50 4E 컬럼을 사용하였으며, 컬럼 온도는 80°C, 이동상으로는 70% aceotonitrile, 용매 유속는 1 mL/min을 적용하였다(Kim et al., 2023). 유기산 생성량 측정은 HPLC와 UV-vis detector(2414; Waters, Milford, MA, USA), Aminex HPX-87H(Bio-Rad, Hercules, CA, US) 컬럼을 사용하였으며, 컬럼 온도는 50°C, 이동상으로는 0.6 N sulfuric acid를 포함한 water, 용매 유속는 0.6 mL/min을 적용하여 분석하였다(Kim et al., 2018).
균체 수율 및 젖산 생산 최적화를 위해 탄소원, 질소원의 종류에 따른 배양 특성을 비교하였다. 기본 배지성분(sodium acetate 0.5%, K2HPO4 0.2%, MgSO4 0.01%, MnSO4 0.005%) 탄소원으로는 단당류(glucose, fructose, galactose), 이당류(sucrose, lactose), 당알코올류(sorbitol, xylitol, mannitol), 전분류(soluble starch, corn starch, potato starch)를 사용하였으며, 질소원으로는 soybean meal, soy powder, soy peptone, bacto peptone, beef extract, malt extract, yeast extract, corn steep liquor, ammonium sulfate를 사용하였다. 최적 탄소원 및 질소원을 선정한 후 기본배지 성분에 선정된 탄소원과 질소원을 각각 1~5%, 0.5~10%로 첨가한 배지를 제조하여 탄소원과 질소원 비율을 선정하였다. 제조된 배지는 121°C에서 15분간 멸균하여 사용하였다. 배지 조성 탐색 과정의 대조군 배지는 MRS broth를 사용하였다. 본 배양은 전 배양된 L. plantarum WiKim0125 균 배양액을 1% (v/v)로 접종하여 진행하였다.
배양 조건 최적화는 배양 과정 중 유산균의 생육에 영향을 미칠 수 있는 유입공기 종류와 배양 온도를 선정하기 위해 5 L 배양기에 3 L의 최적 배지를 적용하였다. 3 L의 최적배지는 앞선 배지 조성 탐색에서 선정된 배지 조성인 glucose 2%, yeast extract 3%와 기본 배지성분을 혼합하여 121°C에서 25분간 멸균 처리하였다. 유입 공기 종류에 따른 생육차이를 확인하기 위해 산소와 질소가 사용되었고, 배양 온도 조건은 27, 30, 33, 36°C가 적용되었다. 본 배양은 전 배양된 L. plantarum WiKim0125 균 배양액을 1% (v/v)로 접종하여 진행하였다.
균체 및 젖산 생산 최적화 공정을 통해 선정된 조건을 기반으로 50 L 규모의 대량배양을 진행하였다. 대량배양은 50 L 배양기에 동일 조성의 배지 30 L를 제조하여 동일한 조건으로 배양하고, 5 L 배양을 비교군으로 사용하였다. 50, 5 L 배양은 각각 300, 30 mL의 멸균된 MRS broth에 전 배양된 L. plantarum WiKim0125를 접종하여 진행하였다.
L. plantarum WiKim0125의 대량생산 후 동결건조 분말 제형 생존율을 비교하기 위해 멸균 증류수, 10% trehalose, 10% skim milk를 보호제로 사용하여 생존율을 평가하였다(Choi et al., 2019). L. plantarum WiKim0125 배양액을 원심분리(9,000 RPM, 10 min, 20°C)하여 균체를 분리하였다. 수득된 균체는 멸균 증류수를 사용해 5×1010 CFU/mL의 농도로 현탁하여 동결 보호제와 1:1로 혼합하고, -80°C에 4시간 이상 냉동시킨 후 72시간 동결 건조하여 생존율을 비교하였다.
결과 및 고찰
배지 조성 성분 탐색을 위해 각 배지에 L. plantarum을 배양하여 균체 수율 및 젖산 생산량을 확인한 결과, 탄소원으로 glucose, galactose, mannitol을 사용한 배지에서 3.2×109 CFU/mL의 균체 수율이 확인되었고, 이 중 가장 많은 양의 젖산을 생산한 glucose를 최적 탄소원으로 선정하였다(Fig. 1). 앞선 연구들의 경우, Leuconostoccitreum의 성장에 당 성분이 가장 영향력이 높다고 확인되었으며, 김치로부터 분리된 유산균에 대한 API test를 진행한 결과, glucose, fructose, maltose 등의 당에 대한 높은 대사능을 확인할 수 있었다(Hwang et al., 2014, Lee et al., 2017).
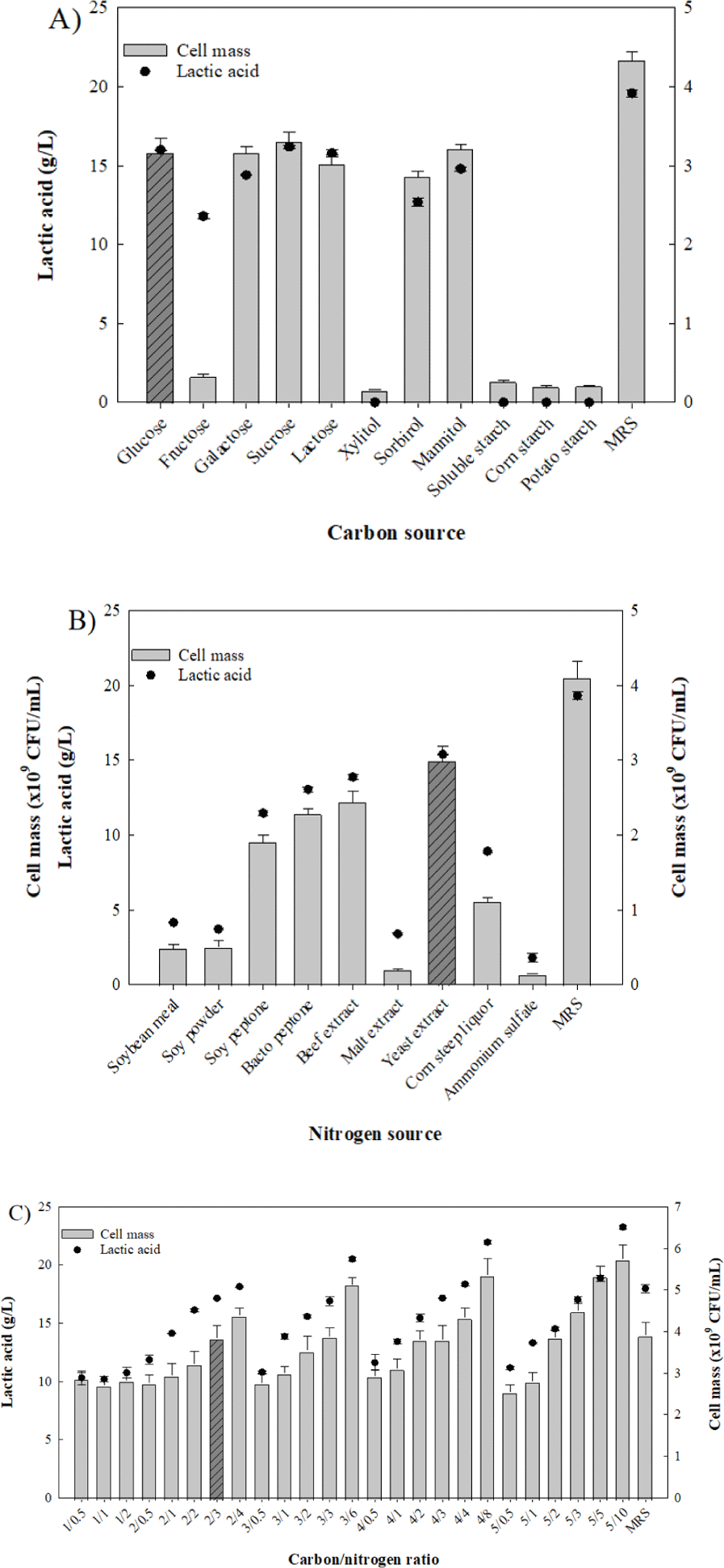
이어 최적 배지 조성에 사용된 질소원을 선정하기 위해 9종의 질소원을 사용하여 배지를 조성하였다. 질소원을 제외한 탄소원으로는 2% glucose와 기본배지성분을 사용하였다. 각 배지에 L. plantarum WiKim0125을 배양한 결과 질소원으로 yeast extract를 사용한 경우 3.0×109 CFU/mL의 가장 우수한 균체 수율이 확인되었다(Fig. 1). 질소원 종류에 따른 Leuconostocmesenteroides의 생산 최적화의 경우 peptone, yeast extract, whey 중 yeast extract를 사용할 때 가장 높은 효율을 보였는데, 본 연구에서도 같은 결과를 나타내었다 (Lee, 2007).
앞서 선정된 탄소원과 질소원을 기반으로 최적 비율을 선정하기 위해 glucose 1~5%, yeast extract 0.5~10%의 배지를 조성하였다. 배지에 사용되는 미량원소는 위와 동일하게 적용되었다. L. plantarum WiKim0125의 배양 결과, 균체 수율 및 젖산 생성량은 질소원 농도가 증가함에 따라 증가하는 경향이 확인되었으나, 배지의 가격경쟁력을 고려하여 탄소원 glucose 2%, 질소원 yeast extract 3%의 배지 조성 조건이 선정되었다 (Fig. 1).
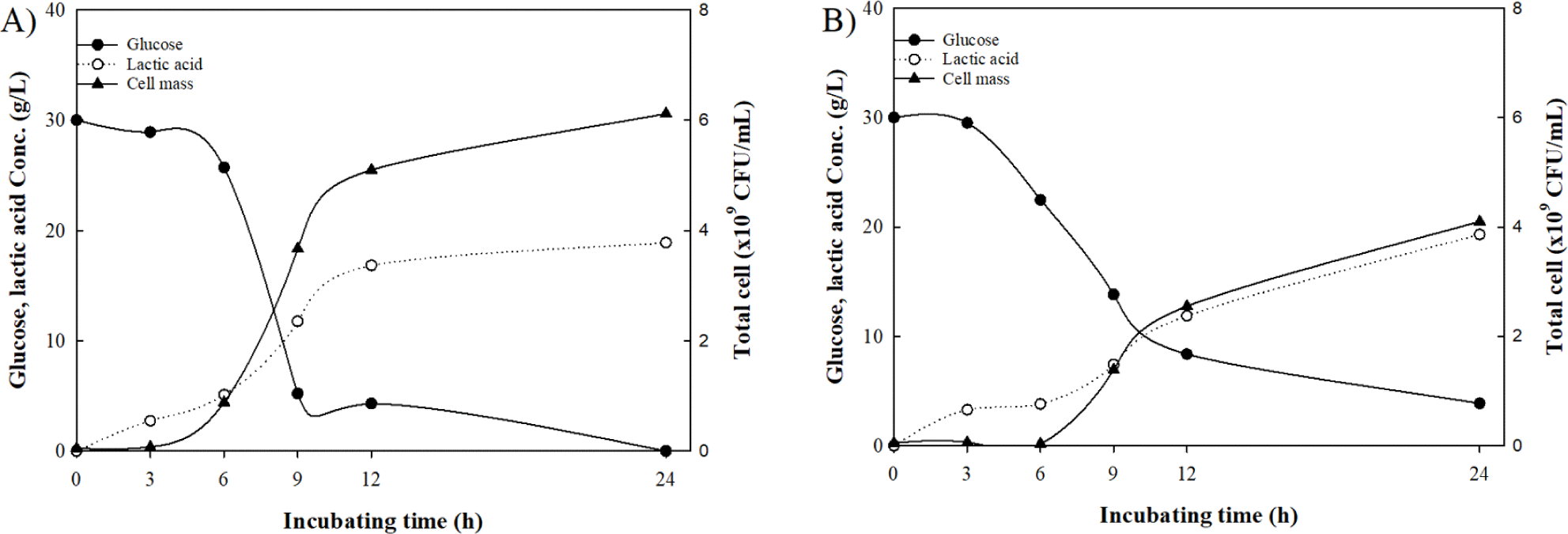
앞서 선정된 최적 배지조성을 기반으로 5 L 배양기에 3 L의 배양액을 제조하여 L. plantarum WiKim0125를 배양하며, 0, 3, 6, 9, 12, 그리고 24시간 배양액을 수득하여 균체 수율과 젖산 생산량을 확인한 결과, L. plantarum WiKim0125는 혐기 환경에서 24시간 기준 6.1×109 CFU/mL의 균체 수율과 18.9 g/L의 젖산 생산량이 확인되었고, 호기조건은 균체 수율인 4.1×109 CFU/mL와 19.3 g/L의 젖산 생산량이 확인되었다(Fig. 2). 본 실험에선 균체 수율의 증진을 일차적 목표로 선정하기에 혐기 조건을 선정하였다. 이 중 가장 균체 수율이 높았던 30°C 조건을 최적 배양 조건으로 선정하였다. 이는 일반적으로 유산균의 혐기 배양이 호기 배양에 비해 더 빠른 성장을 하는 것과 일치하는 경향을 확인할 수 있었다(Kim et al., 2002).
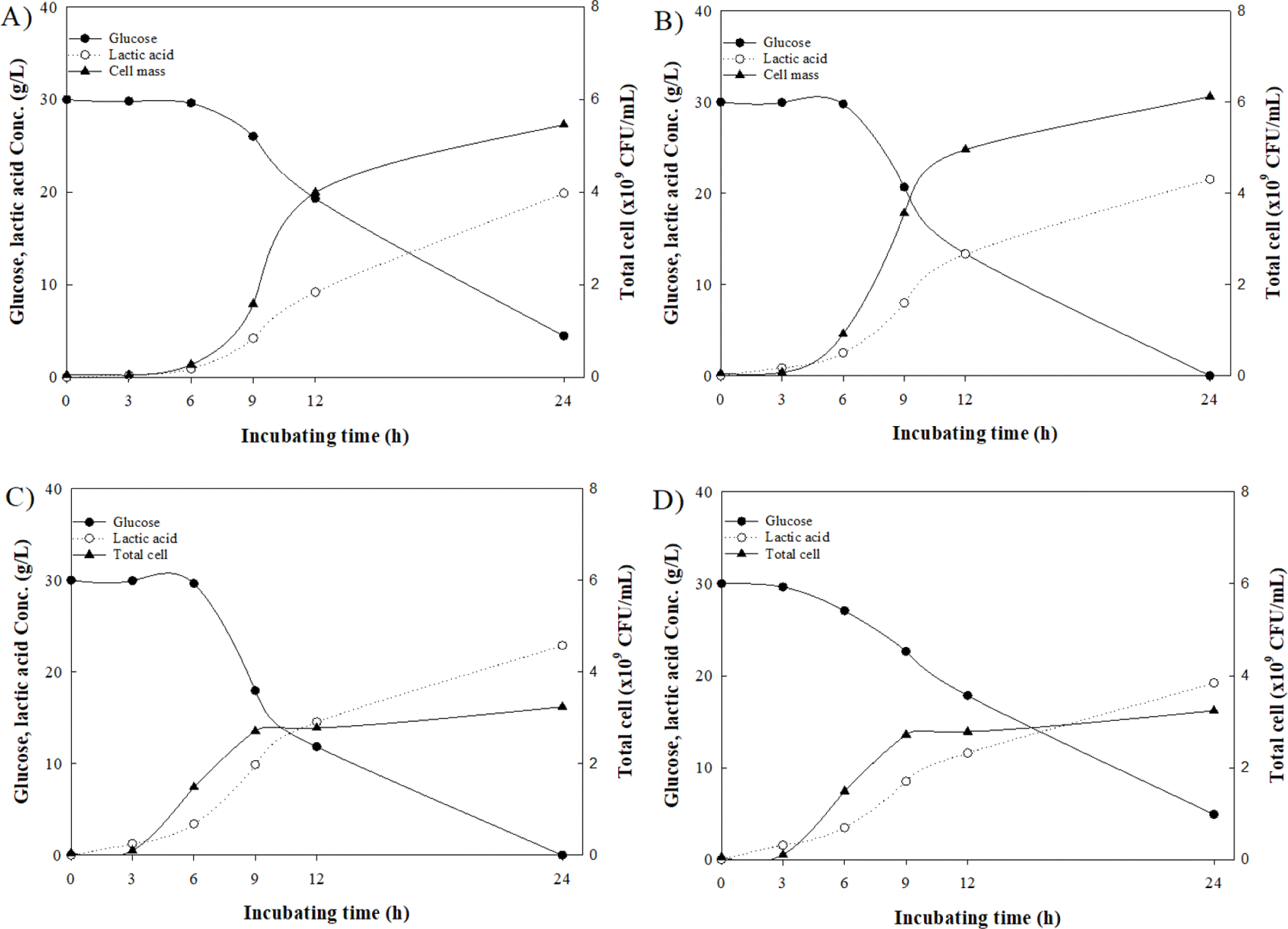
앞서 선정된 혐기 조건을 기반으로 최적 배양 온도를 탐색하기 위해 27, 30, 33, 그리고 36°C의 환경에서 L. plantarum WiKim0125를 배양하였다. 각 조건에서 24시간 배양한 결과, 27, 36°C의 환경에서 L. plantarum WiKim0125는 배지 내의 당을 전부 소모하지 못한 것이 확인되었으며, 27, 30, 33, 그리고 36°C 환경에서 배양된 L. plantarum WiKim0125의 균체 수율은 각각 5.5, 6.1, 5.3, 그리고 3.2×109 CFU/mL, 젖산 생산량은 각각 19.9, 21.5, 22.9, 그리고 19.2 g/L가 확인되었다 (Fig. 3). 이는 앞선 선행연구에서 L. plantarum 을 25, 30, 37, 40, 50°C에서 배양한 결과, 30°C의 배양 조건이 가장 높은 균체 생육을 보였던 것과 일치하는 조건이다 (Kim et al., 2010). 따라서 본 연구에서는 가장 높은 균체 수율을 수득할 수 있는 최적 배양 온도로 30°C를 선정하였다.
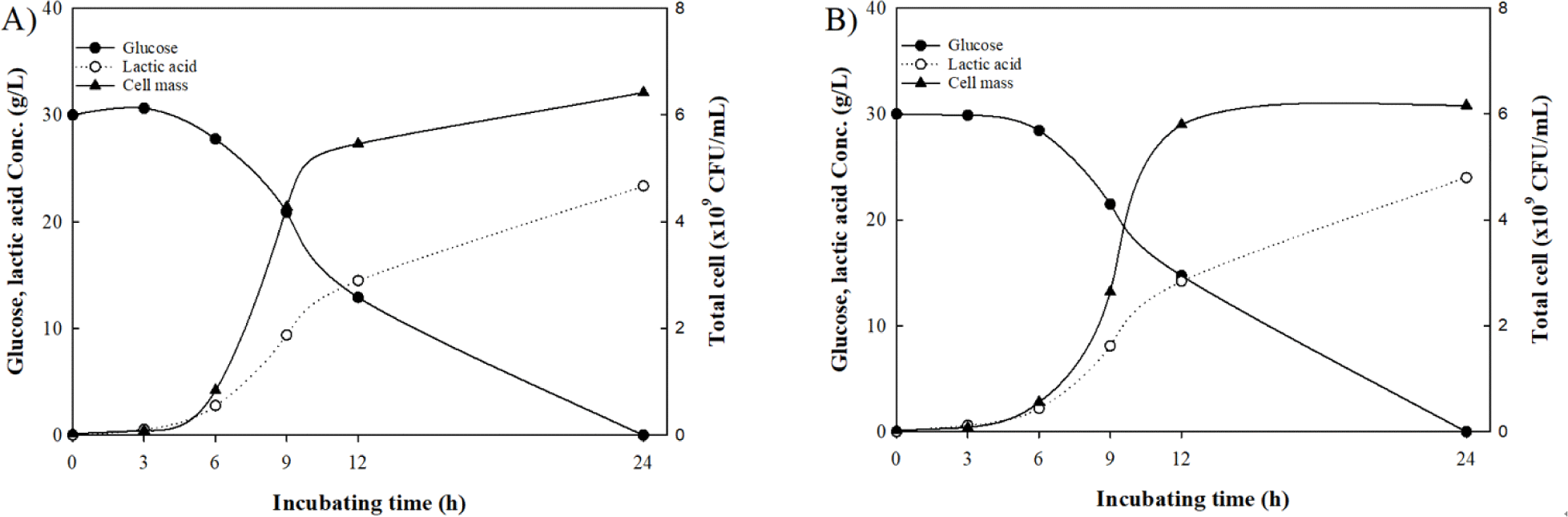
최적 배지 조성과 배양 조건을 선정한 후 MRS broth와의 비교를 위하여 5 L 배양기에 3 L의 최적배지와 MRS broth를 각각 제조 후 혐기 조건, 30°C에서 배양하여 결과를 비교하였다. 최적배지와 MRS broth의 24시간 배양 후 균체 수율은 각각 6.1, 4.4×109 CFU/mL로 확인되었고, 젖산 생산량은 각각 21.5, 18.0 g/L로 확인되어 기존 MRS broth와 비교하여 38.6% 높은 균체 수율과 19.4%의 높은 젖산 생성이 가능한 산업화 배지 조성 및 배양 조건을 정하였다.
L. plantarum WiKim0125의 대량생산을 위해 50 L 규모의 배양기에 30 L의 배지를 제조하고, 기존 5 L 배양 결과와 비교하였다. 배양 결과, 50 L 규모의 배양은 5 L규모의 배양에 비해 기질 소모 속도, 젖산 생성, 균체 증식에서 더 늦은 경향을 확인할 수 있었지만, 24시간 배양 결과에선 각각 6.2, 6.4×109 CFU/mL의 균체 수 율과 24.0, 23.3 g/L의 젖산 생산량을 보여 5 L 규모와 유사한 배양 결과를 획득할 수 있었다(Fig. 4).
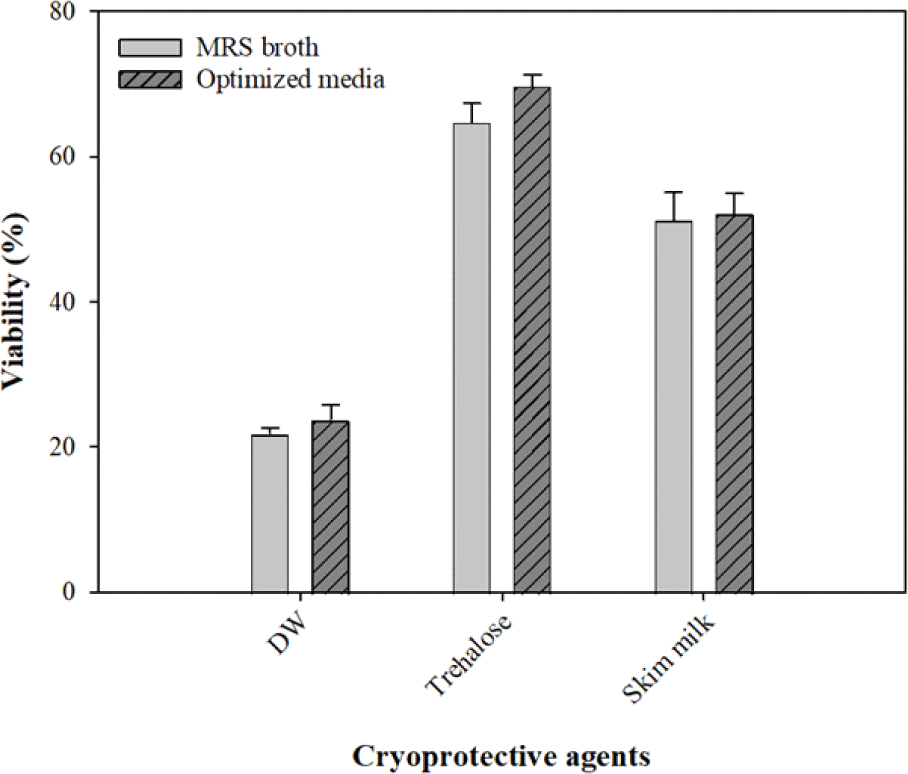
배지 조성에 따른 L. plantarum WiKim0125의 생존율을 비교한 실험의 결과는 Fig. 5와 같다. MRS broth에서 배양한 L. plantarum WiKim0125 균주의 경우, 보호제를 첨가하지 않은 경우(멸균 증류수) 21.8%, 보호제로 10%의 trehalose 혹은 skim milk를 사용한 경우 64.6%와 51.1%의 생존율을 확인할 수 있었다. 그리고 최적화 배지에서 배양한 L. plantarum WiKim0125 균주의 경우 보호제를 첨가하지 않았을 경우 23.8%, 보호제로 10% trehalose 혹은 skim milk를 사용한 경우 69.5%와 52.1%의 생존율을 보였다(Fig. 5). 이 수치는 앞선 Leuconostocmesenteroides를 대상으로 진행한 유산균 분말 제형 후 생존율과 비슷한 수준임을 확인하였다(Choi et al., 2020). 위의 실험을 기반으로 최적 배지 조성에 따른 유산균 동결건조 분말 제형의 생존율 차이는 확인되지 않았으나, 배지 원가 절감에 따른 생산성의 증진을 기대할 수 있다.
요약
본 연구에서는 김치에서 분리한 유산균 L. plantarum WiKim0125의 산업화 적용을 위한 최적 배지 조성 및 배양 조건을 탐색하고, 50 L 규모로 scale-up 공정을 진행하였다. 그 결과, 배지 조성 및 배양 조건 탐색 단계에서 선정된 glucose 2%, yeast extract 3%로 조성된 배지를 혐기 환경에서 30°C로 배양하였을 시 MRS broth를 이용한 배양 결과보다 균체 수율과 젖산 생성이 각각 38.6%, 19.4% 증진되었다. 50 L 규모의 대량배양에서 5 L 배양과 유사한 수준인 6.2×109 CFU/mL의 균체 및 24.0 g/L의 젖산 수율을 수득할 수 있었다. 본 실험을 기반으로 선정된 배양조건은 L. plantarum WiKim0125의 산업화 적용에 매우 유용하게 활용될 수 있을 것으로 기대된다.







