서 론
최근 산업의 성장과 현대인들의 빠르고 편리한 생활로 식습관이 인스턴트 식품, 밀키트, 패스트푸드 등으로 빠르게 변화하고 있다(Choi et al., 2019). 이러한 변화는 빠르고 불규칙한 식사 습관을 유발하고 있으며, 이는 소화효소 분비를 억제하고 소화불량을 초래할 수 있다(Kim and Kim, 2006; Shin and Je, 2018).
특히, 고연령층은 노화로 인해 소화능력이 저하되고 amylase 및 protease와 같은 소화효소의 활성 및 분비가 원활하지 않아 음식물 소화가 어려워지며, 불규칙한 식습관까지 동반하게 된다면 이를 악화시킬 수 있다(Kim and Kim, 2006; Lee, 2015). 이러한 소화작용을 개선하기 위한 방법으로 소화효소제가 일반적으로 사용되지만, 최근 마이크로바이옴에 대한 연구가 활발히 진행되면서 장내 미생물에 의한 소화 효소 생산에도 관심이 증대되고 있다(Bhattacharya et al., 2015; Jia et al., 2022).
효소식품은 식품에 효소를 첨가하거나 미생물의 발효를 통하여 효소활성을 강화함으로써 음식물의 분해를 도우며, 소화능력을 개선하여 영양성분의 흡수를 촉진하는 건강기능식품으로 개발될 수 있다(Lee et al., 2015; Martinez-Villaluenga et al., 2017). 현재는 Bacillus 속을 포함한 다양한 미생물을 활용한 효소식품 개발 연구가 진행 중이며, 효소 생산 고초균(Bacillus subtilis)을 활용한 프로바이오틱스 균주 개발 연구도 활발하게 진행되고 있다(Kwon et al., 2023; Maske et al., 2021; Sharma et al., 2020).
그럼에도 불구하고, 판매되는 효소식품의 효소 활성은 제각각이며 이는 소비자들의 불만요소이기도 하다 (Lee et al., 2015). 따라서 효소활성이 우수한 균주를 발굴하고 이를 활용하여 장내 건강기능성이 우수한 소재를 개발한다면 소비자들의 건강 증진에 도움이 될 것으로 판단된다. 이런 관점에서 본 연구에서는 선행연구에서 분리된 B. subtilis MGE 2012 균주를 활용하여 효소활성을 위한 기질 최적화시험을 진행하였고, 최종발효물의 항산화능과 비피도박테리아 증식능을 검증하여 장 건강을 위한 건강기능식품으로서의 가능성을 살펴보고자 하였다.
재료 및 방법
B. subtilis MGE 2012 균주는 선행연구에서 메주로부터 분리되었으며 이를 효소활성 발효물 제조를 위한 종균으로 사용하였다. 비피도박테리아 증식능 확인을 위하여 Bifidobacterium lactis BL750 균주(Culture Systems Inc., Mishawaka, IN, USA)와 Bifidobacterium breve KCTC 3220 균주를 사용하였다. B. subtilis MGE 2012 균주는 Nutrient 배지(BD, Sparks, MD, USA)를 이용하여 배양하였고, 비피도박테리아 균주들은 Reinforced Clostridial Medium (RCM) 배지(BD, Sparks, MD, USA)를 사용하여 혐기 챔버 (DG250; Don Whitley Scientific Ltd., Bingley, UK)에서 배양하였다.
효소활성 측정을 위하여 Nutrient agar (BD, Sparks, MD, USA)에 starch (Showa Chemicals Inc., Osaka, Japan)와 skim milk (BD, Sparks, MD, USA)를 첨가하여 배지를 제조하였다.즉, Nutrient agar에 starch (1%, w/v)와 skim milk (10%, w/v)를 각각 첨가한 후 α-amylase와 protease 활성 측정을 위한 배지로 사용하였다. 제조된 고체배지에 하룻밤 배양한 B. subtilis MGE 2012 균주 배양액 1 uL를 점적한 후 37℃에서 7시간 동안 배양한 후, 균체 주변의 환을 통해 protease 활성을 측정하였고 α-amylase 활성의 경우 배지 위에 iodine 용액((주)동성상사, 서울, 대한민국) 2 mL를 골고루 뿌려 염색되지 않는 투명환 생성 여부로 판단하였다.
현미 분말, 대두 분말, 쌀 단백 분말은 ㈜제이케이뉴트라(수원, 대한민국)에서 제공받아 사용하였다. 세 가지의 곡물을 단독 혹은 복합[현미와 대두 분말(1:1), 현미와 쌀 단백 분말(1:1)]으로 사용하여 곡물 기질을 조제하였으며 기질 총 중량 5g에 최종 수분 함량이 60%가 되도록 멸균수를 첨가한 후 증숙(121℃, 15분)하였다. 이후 멸균수로 2회 세척한 B. subtilis MGE 2012 균주(약 109 CFU/mL)를 0.5% 접종한 후 37℃에서 24시간 배양하였다. 0시간과 24시간째에 0.4g의 시료를 취해 멸균수 1.2 mL에 현탁하여 원심분리(14,000rpm, 4분) 후 상등액을 멤브레인 필터(AnyLab Co., Seoul, Korea)로 2회 여과(0.45um 필터 1회, 0.22 um 필터 1회)하였다. 여과액 1uL를 상기의 효소활성 측정을 위한 배지에 점적하여 활성 유무를 판단하였다.
항산화능 측정은 2,2-azino-bis-3-ethylbenzothiazoline-6-sulfonic acid (ABTS) (Roche, Mannheim, Germany) 라디칼을 이용한 분석법으로 실시하였다. 즉, 7 mM의 ABTS와 2.45 mM potassium persulfate (Daejung chemicals, Siheung, Korea)를 1:1 비율로 혼합한 다음 24시간 암반응시켜 반응액을 제조하였으며, 제조된 반응액은 OD734 에서 흡광도가 0.7±0.02 부근이 되도록 희석하였다. 이후 상기의 방법으로 제조된 여과된 복합기질(현미 분말과 대두 분말) 발효물(4 uL)과 희석 반응액(196 uL)을 혼합하여 암반응 20분 진행 후 OD734에서 흡광도를 측정하여 항산화 활성 유무를 판단하였다. 항산화 활성의 정량적 분석을 위하여 (+)-sodium L-ascorbate (Sigma-Aldrich, St. Louis, MO, USA)를 표준곡선 작성을 위한 표준물질로 사용하였고 정량값은 Ascorbic acid Equivalent Antioxidant Capacity (AEAC; mg eq. AA / 100 mg) 값으로 나타내었다.
결과 및 고찰
실험방법에서 언급한 α-amylase 및 protease 활성 확인용 고체배지에 B. subtilis MGE 2012 균주 배양액 1 uL 점적한 후 배양한 결과, 균체 주변에서 효소 활성 투명환이 관찰되었다 (Fig. 1). 이는 B. subtilis MGE 2012 균주가 α-amylase 및 protease를 동시에 효율적으로 생산하고 있음을 의미한다. 일반적으로 B. subtilis 균종은 α-amylase (glycogenase; EC 3.2.1.1)를 생산하는데 이는 전분의 한 종류인 amylose를 가수분해하여 maltotriose와 maltose를 생성하며 전분의 또 다른 종류인 amylopectin을 가수분해하여 glucose와 dextrin을 생성한다(Raul et al., 2014). 또한, protease는 단백질의 펩타이드 결합을 가수분해하여 아미노산을 생성한다(Harwood and Kikuchi, 2022).

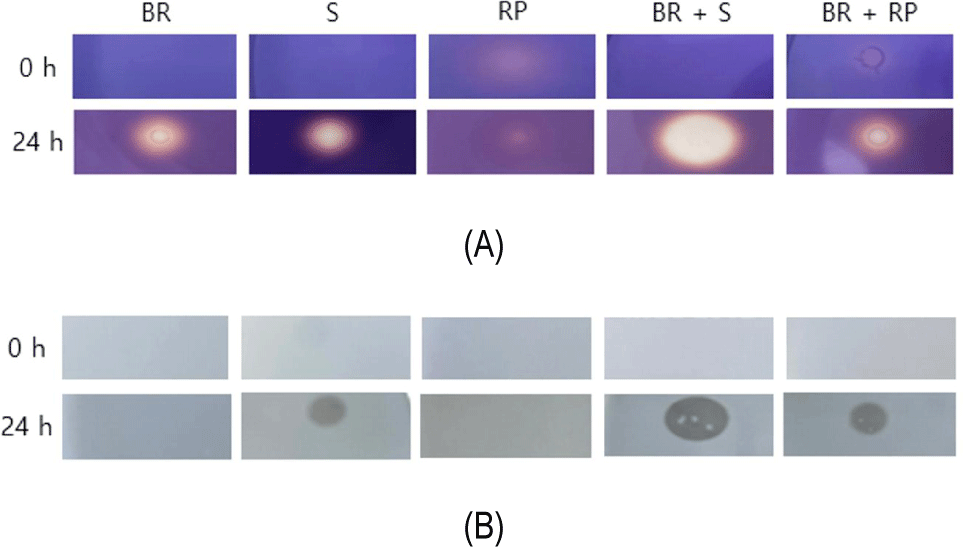
B. subtilis MGE 2012 균주의 곡물 기질에 따른 효소활성을 비교하기 위하여 현미 분말, 대두 분말, 쌀 단백 분말을 단독 혹은 복합(현미와 대두 분말, 현미와 쌀 단백 분말)으로 사용한 결과, α-amylase의 경우 현미 분말과 대두 분말 복합기질에서 24시간 배양 후 가장 높은 효소활성을 나타냈고(Fig. 2A), protease의 경우에도 24시간 배양 후 현미 분말과 대두 분말 복합기질에서 가장 높은 효소활성이 확인되었다(Fig. 2B). 이는 상대적으로 전분질이 풍부한 현미 분말과 단백질이 풍부한 대두 분말의 조합이 B. subtilis MGE 2012 균주의 α-amylase 및 protease 유전자의 발현을 유도한 것으로 추론되었다. 본 연구그룹에서 수행한 선행연구에서 Bacillus licheniformis 1-B-12 균주의 경우 현미 분말(50%), 미강 분말(30%) 및 대두 분말(20%) 복합기질에서 가장 우수한 효소활성이 관찰되었다(Kang and Moon, 2016). 따라서 사용하는 균주에 따라 최적의 기질 조합을 선정함으로써 효율적인 효소식품의 소재 생산이 가능할 것으로 판단된다.
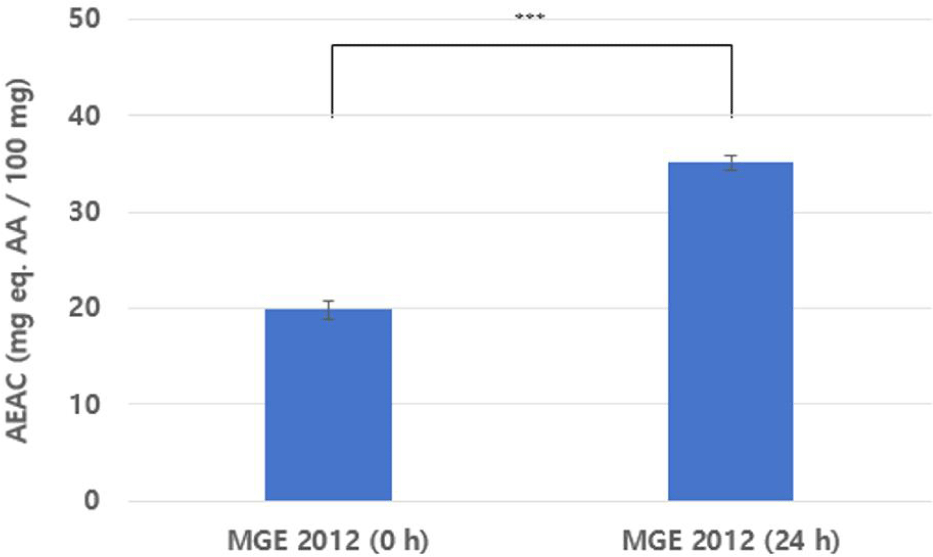
B. subtilis MGE 2012 균주를 적용한 복합기질(현미 분말과 대두 분말) 발효물의 ABTS radical 소거능을 확인한 결과, 0시간째 시료의 경우 19.82 AEAC (mg eq. AA / 100 mg)를 나타낸 반면, 24 시간 발효 후에는 35.08 AEAC (mg eq. AA / 100 mg)로 나타나 발효 전·후 항산화능이 약 1.77배 증가하였다 (Fig. 3). 이는 복합기질에 적용된 B. subtilis MGE 2012 균주의 발효과정에서 단백질 분해 산물 및 다양한 대사산물이 생산되어 항산화 활성에 기여했을 것으로 추론된다.
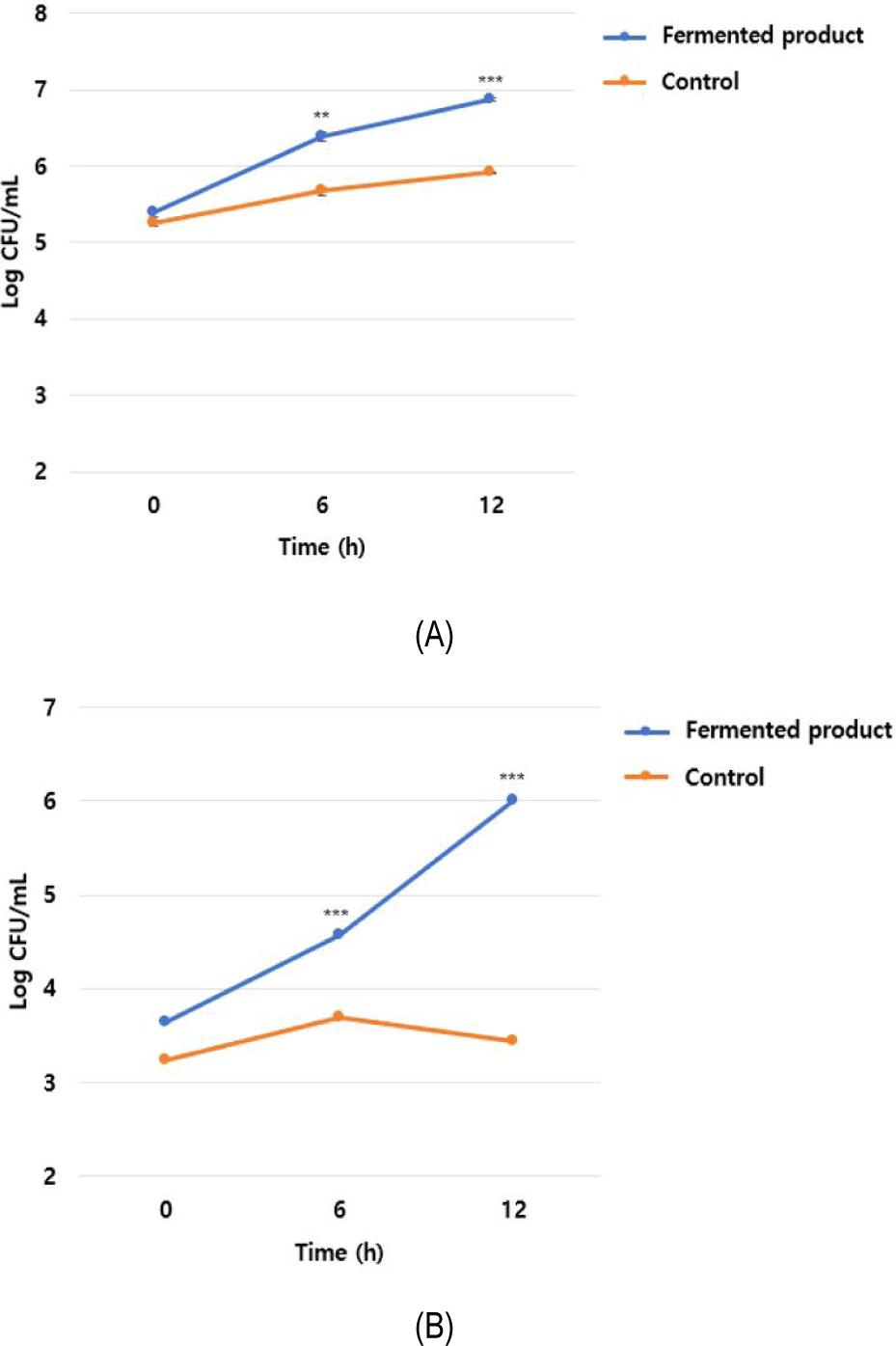
효소활성 발효물의 비피도박테리아 증식능을 확인하기 위하여 B. lactis BL750과 B. breve KCTC 3220 균주를 대상으로 시험한 결과, B. lactis BL750 균주의 경우 대조군은 5.25 log CFU/mL로 시작해 6, 12시간째 각각 5.67, 5.91 log CFU/mL로 증가한 반면 효소활성 발효물은 5.38 log CFU/mL로 시작해 6, 12시간째 각각 6.38, 6.87 log CFU/mL로 증가하여 대조군 대비 6, 12시간째 각각 0.71, 0.96 log CFU/mL의 차이를 보였다(Fig. 4A). B. breve KCTC 3220 균주의 경우 대조군은 3.23 log CFU/mL로 시작해 6, 12시간째 각각 3.69, 3.43 log CFU/mL로 증가한 반면 효소활성 발효물 첨가군은 3.64 log CFU/mL로 시작해 6, 12시간째 각각 4.57, 6.00 log CFU/mL로 증가하여 대조군 대비 6, 12시간째 각각 0.88, 2.57 log CFU/mL의 차이를 보였다 (Fig. 4B). 이는 B. subtilis MGE 2012 균주가 적용된 복합기질(현미 분말, 대두 분말)의 발효과정에서 생산되는 분해산물과 대사산물이 비피도박테리아의 증식에 기여한 것으로 추론되며 이는 소화효소 활성과 함께 장내 유익균의 증식에도 도움을 줄 수 있는 소재의 개발에 관한 것이어서 그 의의가 크다. 향후 본 연구에서 개발된 소재를 활용한 장 건강 기능성 검증 임상시험이 이루어진다면 건강기능성 소재로서 각광을 받을 수 있을 것으로 판단된다.
현대인들의 식습관 및 생활환경의 변화는 건강상 부정적인 영향을 초래하고 이는 사회적 부담으로 작용한다. 이러한 건강상의 문제를 해결하기 위하여 다양한 방법이 고려될 수 있겠지만 평소 건강기능성 식품을 꾸준히 섭취하는 것도 한 방법일 것이다. 특히, 중·장년층의 경우 소화효소 활성 저하 및 장내 마이크로바이옴의 변화로 인한 장내 건강이 나빠지는 것이 일반적이며 이를 개선하기 위한 많은 소재들이 연구 개발되고 있다(Eun, 2013; Jeong et al., 2022). 본 연구에서 개발된 소재 또한 동일한 목적에 활용될 수 있을 것이다.
요 약
본 연구에서는 α-amylase 및 protease의 동시 생산을 위해 Bacillus subtilis MGE 2012 균주를 선발하였고 이를 현미 분말, 대두 분말 및 쌀 단백 분말의 조합에 적용하여 효소활성을 위한 최적 기질 조합을 선정한 결과, 현미 분말과 대두 분말의 복합물 기질에서 가장 우수한 효소활성을 나타냈다. 또한 효소활성 최적조건으로 생산된 발효산물에 대한 항산화 활성 및 비피도박테리아 증식능을 확인한 결과, 발효 후 항산화 활성이 발효 전에 비해 약 1.77배 증가하였고 최종 발효산물의 비피도박테리아(Bifidobacterium lactis, Bifidobacterium breve 균주) 증식능도 확인되었다. 이는 B. subtilis MGE 2012 균주의 적용과 발효과정에서 효소활성뿐만 아니라 장내 건강기능성을 향상시킬 수 있는 주요 인자의 변화에도 긍정적 영향을 미친 것으로 향후 장 건강 기능성 소재로서 각광을 받을 것으로 판단된다.







