Research Article
유산균 발효에 의한 인삼열매 추출물의 유효성분 변화
이정선1,2
,
최성원1,*
Changes in Effective Components of the Fermented Ginseng Berry Extract Using Lactic Acid Bacteria
Jeong-Sun Lee1,2
,
Sung-Won Choi1,*
Author Information & Copyright ▼
1Department of Food and Nutrition, Osan University, Chunghak-ro 45, Osan-si, Gyeonggi-do 18119, Republic of Korea
2Yujung Food Safety Lab, Busanjungang-ro 12, Osan-si, Gyeonggi-do 18148, Republic of Korea
*Corresponding author : Sung-Won Choi, Department of Food and Nutrition, Osan University, Chunghak-ro 45, Osan-si, Gyeonggi-do 18119, Korea. Tel: +82-31-370-2755, Fax: +82-31-370-2759, E-mail:
csw0365@osan.ac.kr
Copyright © Korean Society for Lactic Acid Bacteria and Probiotics. This is an Open-Access article distributed under the terms of the
Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0/) which permits
unrestricted non-commercial use, distribution, and reproduction in any
medium, provided the original work is properly cited.
Received: Nov 29, 2023; Revised: Dec 18, 2023; Accepted: Dec 26, 2023
Published Online: Dec 31, 2023
Abstract
In this study, lactic acid bacteria showing high specific β-glucosidase activity were isolated from kimchi to convert the high molecular weight ginsenosides into low molecular weight ginsenosides in ginseng berry. Among the 120 strains of lactic acid bacteria isolated from kimchi, 42 strains of lactic acid bacteria showing β-glucosidase activity were isolated using the esculin agar method. And as a result of measuring the β-glucosidase activity of the intracellular enzyme fraction, the lactic acid bacterium OG-05 showing high β-glucosidase activity(198.60±20.87 AU/mL) and specific β-glucosidase activity(21.52±2.37 AU/Log CFU) was selected. The selected lactic acid bacterium OG-05 was identified as Lactiplantibacillus plantarum by bacterial identification based on 16S rRNA sequencing analysis and was named Lactiplantibacillus plantarum OG-05. When ginseng berry extract was fermented using Lactiplantibacillus plantarum OG-05, the ginsenosides Re, Rg1 and Rb1 which are abundant in ginseng berry extract were not detected. The contents of Rc, Rf and F1 decreased, while the contents of Rg2 and Rd increased. In addition, F2, Rg3, CK, and Rh2, which did not exist before fermentation, were produced at significant levels. These results indicate that the fermentation of ginseng berry extract using Lactiplantibacillus plantarum OG-05 could influence the ginsenoside composition.
Keywords: lactic acid bacteria; kimch; ginseng berry; fermentation; Lactiplantibacillus plantarum OG-05
서 론
고려인삼(Panax ginseng C. A. Meyer)은 두릅나무과에 속하는 다년생초로서, 한국을 비롯한 동아시아에서 예로부터 널리 사용되는 약초 중 하나이며 면역기능 증진, 피로 개선, 혈행 개선, 기억력 및 인지능력 개선, 항산화, 항암 및 간기능 개선 효과 등이 있는 것으로 알려져 있다(Choi, 2008; Deng and Zhang, 1991; Ma et al., 2014; Quan et al., 2012; Yun, 2001; Zhao et al., 2009). 진세노사이드(ginsenoside)는 고려인삼의 약리학적 효과에 기여하는 대표적인 화합물로 다른 식물에 존재하는 사포닌과는 다른 독특한 구조 및 기능성을 보이는 것으로 알려져 있고 스테로이드 계열에 속하는 스테로이드 배당체 (steroid glycosides) 및 트리테르펜 사포닌(triterpene saponin)을 말하는 것으로 인삼에서 확인된 약 50개 이상의 진세노사이드 중에서 6가지 주요 진세노사이드(Rb1, Rb2, Rc, Rd, Re, Rg1)가 인삼의 총 진세노사이드 함량의 약 90%를 차지하고 있는 것으로 알려져 있다. 진세노사이드는 인삼의 뿌리뿐 아니라 줄기, 잎, 열매에도 함유되어 있고 특히 인삼열매에는 다양한 사포닌, 폴리페놀 및 플라보노이드 색소 등의 여러 기능성 성분이 많이 함유되어 있다고 보고되고 있다(Attele et al., 1999; Choi, 2008; Kim et al. 2009; Kim et al. 2012; Li et al., 2000; Lu et al., 2009).
인삼열매는 7월 중순경 인삼종자를 채취하기 위하여 수확하는 과정에서 일주간 정도 볼 수 있는 것으로, 보통 인삼뿌리의 생장에 영향을 미치기 때문에 일찍 폐기되어 사용되지 않았다. 인삼열매의 진세노사이드 함량은 인삼뿌리와 다르게 나타나며, 특히 진세노사이드 Re, Rd 함량이 뿌리보다 더 풍부하게 함유되어 있는 것이 보고되었고 최근에는 인삼열매의 항비만, 항암, 미백 효능들이 보고되었으며 항당뇨 효과에 있어서는 인삼뿌리보다 더 우수한 효과를 나타내었다고 보고되고 있다(Kim et al., 2008, Ko et al., 2009). 인삼뿌리 및 인삼열매에 함유되어 있는 진세노사이드들은 섭취 후 체내에 흡수되는 과정에서 사람의 장내에 서식을 하고 있는 장내세균에 의하여 당 부분이 잘려나가 흡수되기 쉬운 구조로 분해되는 것으로 알려져 있으나 진세노사이드를 분해하는 장내 미생물군들은 사람마다 다르며 분해가 되지 않는 경우 체내 흡수율이 현저하게 줄어드는 것으로 알려져 있다. 따라서 최근 생물전환이나 초음파처리 등을 통하여 체내흡수율을 높이고 기능성 성분 및 생리활성의 증가를 위한 연구들이 보고되고 있으며 특히 유산균을 이용한 생물전환은 유산균이 생산하는 β-glucosidase를 비롯한 다양한 효소들의 작용으로 세포조직에 결합되어 있던 기능성 성분들이 가수분해되어 유리되기 때문에 체내흡수율 및 생체이용률이 높아질 수 있고 구조변화에 따라 기능성도 증가하는 것으로 알려져 있다(Ako, et al., 1998, Ha et al., 2016, Kim, 2012, Kim, 2018, Kim et al., 2013).
이러한 배경 하에서 인삼열매의 효능을 더욱 증진시키고자 전통발효식품인 김치로부터 인삼열매의 진세노사이드를 분해할 수 있는 β-glucosidase 활성이 우수한 식물성 유산균을 탐색, 분리하고 이를 이용하여 인삼열매를 발효시킴으로써 인삼열매에 다량 존재하는 진세노사이드를 생물전환하여 당부위를 제거하여 흡수 및 효능이 우수한 저분자 진세노사이드로 전환하고자 하였다.
재료 및 방법
식물성 유산균의 분리 및 배양
120종의 식물성 유산균이 전통발효식품인 김치로부터 분리되었고 분리된 식물성 김치유산균은 Lactobacilli MRS (Difco Co., Detroit, MI, USA)액체배지를 사용하여 30℃에서 24시간 동안 정치배양하였다. 유산균 배양액은 glycerol을 이용하여 cell stock을 만들어 -80℃ 급속 냉동고에서 보관하였으며 2계대하여 활성화한 후에 본 실험에 사용하였다.
Esculin agar법을 이용한 생물전환 식물성유산균의 분리
β-Glucosidase 활성을 나타내는 식물성 유산균을 분리하기 위하여 esculin agar법을 이용하였다(Coulon et al, 1998; Shim et al., 2014; Gueguen et al., 1997). MRS 배지로 부터 분리된 식물성 유산균들을 MRS 배지가 첨가된 esculin iron agar 배지(Sigma-Aldrich Co., St. Louis, MO, USA)에 배양하여 균주 생육에 따른 배지의 색 변화를 조사하였다. β-Glucosidase의 활성에 의해 esculin으로부터 β-glucose가 분해되어 생성된 esculetin은 배지성분으로 존재하고 있는 ferric ammonium citrate와 반응하여 검은색을 띠게 된다. 따라서 colony 주위의 배지상에 검은 색을 형성하는 균주들은 β-glucosidase 활성을 나타내는 것으로 판단하였으며 β-glucosidase 활성을 나타내는 균주들은 esculin agar plate에 다시 배양하여 유산균을 순수분리하고 또한 β-glucosidase 생산 여부를 재확인하였다.
비색법을 이용한 생물전환 식물성유산균의 분리
Esculin agar법을 이용하여 선발된 균주에 대하여 정량적인 방법으로 β-glucosidase 활성을 측정하기 위하여 p-nitrophenyl-β-D-glucopyranoside(pNPG, Sigma-Aldrich Co., St. Louis, MO, USA)를 기질로 사용하는 비색법으로 활성을 측정하였다(Coulon et al, 1998; Shim et al., 2014; Zhang et al., 2001). Esculin agar법을 이용하여 선발된 균주들을 10% 인삼열매 추출물(w/v)을 함유하고 있는 MRS 배지에 접종한 후 30℃의 배양기에서 24 시간 배양하였다. 배양액을 12,000 × g에서 10분간 원심분리한 다음 침전된 세포는 50 mM sodium phosphate 완충용액(pH 7.0)으로 세척한 후 0.5 mL의 50 mM sodium phosphate 완충용액(pH 7.0)으로 현탁하였다. 그리고 5분간 초음파 처리(sonication)하여 세포를 파쇄시키고, 세포 파쇄액을 원심분리 (12,000 × g, 10 min, 4℃)하여 효소액을 분리하였다. 효소활성 측정은 효소액 100 µL와 1 mM pNPG 용액(in 50 mM sodium phosphate, pH 7.0) 100 µL를 혼합하여 37℃에서 20분간 반응시키고 2 mL의 0.4 M Na2CO3 용액을 첨가하여 반응을 정지시킨 후, 분광광도계(405 ㎚)를 이용하여 시료의 흡광도를 측정하였다. β-Glucosidase 1 unit은 반응시간 분당 1 mM의 p-nitophenol을 생성하는 효소의 양으로 정의하였다.
선발유산균의 16S rRNA 분석
16S rRNA 염기서열분석을 통하여 최종 선발된 균주의 동정을 실시하였다. 16S rRNA 염기서열분석은 ㈜마크로젠에 의뢰하여 Applied Biosystems사의 ABI PRISM Big Dye Terminator Cycle Sequencing Kits를 이용하여 진행하였으며 16S rRNA 염기서열의 유사성 분석은 ㈜천랩의 EzBioCloud (https://www.ezbiocloud.net)을 이용하였고 계통학적 분석은 Clustal W 및 MEGA 11.0 프로그램을 이용하여 수행하였다(Tamura et al., 2021).
인삼열매 추출물의 제조
인삼열매 100g과 에탄올 2,000mL (1:20 w/w)를 혼합하고 상온에서 3시간 동안 교반하면서 추출하였다. 인삼열매 추출물은 Kimble-filtering flask를 이용하여 Whatman grade 2 여과지로 여과하였고 이를 회전 진공농축기를 사용하여 감압농축하여 인삼열매 추출물을 제조하였다.
식물성 유산균을 이용한 인삼열매 발효추출물의 제조
삼각플라스크에 10% 인삼열매 추출물(w/v)을 함유하고 있는 MRS 배지를 제조한 후 autoclave에서 고압멸균하였다. 후보 유산균은 Lactobacilli MRS 액체배지를 사용하여 30℃ incubator에서 24시간 정치배양하고 10% 인삼열매 추출물(w/v)을 함유하고 있는 MRS 배지에 2% 되게 접종한 후 30℃ shaking incubator에서 48 시간 진탕배양하였다. 식물성 유산균 인삼열매 발효물을 95℃에서 30분간 열처리한 후 원심분리(12,000 × g, 4℃, 10min)하여 상등액을 취하고 이를 감압농축하여 인삼열매 발효추출물을 제조하였다.
조사포닌 분리
인삼열매 발효추출물 시료 0.5g를 증류수 20 mL에 녹인 후 분액 깔대기에 붓고 diethyl ether 20 mL를 가한 다음 시료를 잘 흔들어 골고루 섞이도록 하고 물 층과 ether 층으로 분리될 때까지 방치시켰다. 분리된 ether 층은 제거하고 물 층에 다시 수포화 butanol 20 mL를 가하여 다시 잘 섞어준 후 층 분리가 일어날 때까지 정치시켰다. 분리된 수포화 butanol 층은 별도로 보관하고 물 층에 있는 성분을 수포화 butanol을 이용하여 추출하는 과정을 3번 반복하였다. 분리된 수포화 butanol에 증류수 40 mL를 가하여 잘 섞어준 후 층 분리가 일어날 때까지 정치시킨 후 물 층을 제거하고 butanol 층을 회수하였다. 회수한 butanol 층을 회전 감압농축기를 이용하여 감압농축하여 조사포닌을 분리하였다.
진세노사이드 함량 측정
인삼열매 추출물의 유산균 발효에 따른 진세노사이드 함량 변화를 알아보기 위하여, 분리된 조사포닌을 methanol에 용해하여 Millipore filter(0.45 µm)로 여과한 후 HPLC를 이용하여 진세노사이드 함량을 분석하였다. 진세노사이드 함량 분석에 사용된 HPLC 장비 및 분석 조건은 Table 1과 같다.
Table 1.
HPLC conditions for the analysis of ginsenosides
| Instrument |
SCL-40 controller unit that includes SPD-M40 UV, LC-40D xs, SIL-40C xs, and CTO-40C (Shimadzu Scientific Company, Tokyo, Japan) |
| Column |
Agilent Eclipse Plus C18 (100 × 2.1 mm, 1.8 µm) |
| Detector |
UV detector (204nm) |
| Flow rate |
0.5 ml/min |
| Injection volume |
10 µL |
| Gradient elution |
Water (A), acetonitrile (B) |
| 0–7 min, 81% A, 19% B |
| 7–11 min, 80% A, 20% B |
| 11-14 min, 74% A, 26% B |
| 14–25 min, 67% A, 33% B |
| 25-35 min, 50% A, 50% B |
| 35-40 min, 40% A, 60% B |
| 40-42 min, 81% A, 19% B |
| 42-45 min, 81% A, 19% B |
Download Excel Table
통계 분석
실험에서 얻어진 결과의 데이터 분석은 통계 프로그램인 SPSS (Statistics Package for the Social Science, Ver. 27.0) package를 이용하여 평균과 표준편차를 구하고, 일원배치 분산분석(One-way/ANOVA)과 p<0.05 수준에서 Duncan의 다중 범위 검정(Duncan's multiple range test)을 실시하여 시료 간의 통계적 유의성을 검증하였다.
결과 및 고찰
Esculin agar법을 이용한 생물전환 식물성유산균의 분리
인삼열매에 존재하는 진세노사이드를 생물전환할 수 있는 식물성 유산균을 분리하기 위하여 대표적인 생물전환효소인 β-glucosidase를 생산하는 균주를 김치에서 분리한 120종의 유산균으로부터 탐색하였다. 제조된 Esculin agar 배지에 김치로부터 분리된 유산균 균주의 single colony를 streaking하여 colony 주위의 배지에 검은색을 형성하는 균주를 1차 선발하였다. Esculin은 균주의 β-glucosidase의 활성에 의해 분해가 이루어지며 이때 생성된 esculetin은 배지성분인 ferric ammonium citrate와 반응하여 배지 주위에 black complex을 형성하게 된다(Fig. 1). 따라서 colony 주위에 black zone을 형성하는 균주를 β-glucosidase 활성을 가지는 균주로 판단하였으며 120종의 유산균 중 42종의 유산균에서 β-glucosidase 활성을 나타내는 것을 확인하였다(결과 미제시).
Fig. 1.
β-Glucosidase activity test of lactic acid bacteria in esculin agar (A) the strain not showing β-glucosidase activity (B) the strain (OG-05) showing β-glucosidase activity.
Download Original Figure
비색법을 이용한 생물전환 식물성유산균의 분리
Esculin agar 배지에서 black zone을 형성한 42균주를 분리하여 식물성 유산균의 β-glucosidase 활성을 조사한 결과 β-glucosidase 활성이 높게 나타난 식물성 유산균 9균주를 1차 선발하였다(결과 미제시). β-Glucosidase 활성이 우수한 균주 중 9 균주를 10% 인삼열매 추출물(w/v)을 함유하고 있는 MRS 배지에 접종한 후 30℃에서 24시간 배양한 후 각 발효균주의 생균수, β-glucosidase 활성 및 비활성을 측정하였을 때 β-glucosidase 활성은 OG-05가 198.60±20.87 AU/mL로 가장 높았으며 그 다음으로 OG-07과 OG-1의 순으로 높았다. 생균수의 경우 OG-07이 9.46±0.05 Log CFU/mL로 가장 높았고 그 다음으로 OG-06, OG-05의 순으로 높았다. 효소의 비활성을 검토한 결과 OG-05가 21.52±2.37 AU/Log CFU로 가장 높았고 그 다음으로 OG-01와 OG-7, OG-06이 각각 20.37±1.28, 19.92±1.81, 19.86±1.17 AU/Log CFU으로 높았다. β-Glucosidase 효소활성 및 β-glucosidase 효소 비활성 모두에서 OG-05가 가장 높게 나타났다(Table 2).
Table 2.
β-Glucosidase activity and viable cell number of lactic acid bacteria cultured with ginseng berry extracts.
| Strain |
β-Glucosidase activity (AU/mL) |
Viable cell number (Log CFU/mL) |
Specific β-glucosidase activity (AU/Log CFU) |
| OG-01 |
186.65±10.44ab |
9.16±0.08c |
20.37±1.28ab |
| OG-02 |
163.68±9.88bc |
9.00±0.09d |
18.18±2.33bc |
| OG-03 |
148.06±14.15cd |
8.89±0.05d |
16.60±1.50cd |
| OG-04 |
145.30±13.88cd |
9.08±0.08c |
15.88±1.60cd |
| OG-05 |
198.60±20.87a |
9.18±0.05c |
21.52±2.37a |
| OG-06 |
185.73±12/02ab |
9.28±0.08b |
19.86±1.17ab |
| OG-07 |
188.49±18.08ab |
9.46±0.05a |
19.92±1.81ab |
| OG-08 |
147.14±9.94cd |
8.82±0.04d |
16.71±1.09cd |
| OG-09 |
124.16±15.68d |
8.86±0.03d |
14.03±1.75d |
Download Excel Table
인삼열매 생물전환 활성 유산균의 동정
16S rRNA 염기서열분석에 기반하여 β-glucosidase 효소 활성이 우수한 김치유산균 OG-05의 분자유전학적 특성에 의한 미생물 동정을 진행하였다. 김치유산균 OG-05 균주의 genomic DNA를 추출하고, PCR로 16S rRNA를 증폭하여 염기서열을 결정하였으며, 이 서열을 바탕으로 EzBioCloud program을 이용하여 Lactiplantibacillus 균주들과의 유사성을 검토한 결과, 100%의 신뢰도로 Lactiplantibacillus plantarum과 유사성이 가장 높은 것으로 확인되었다(Fig. 2). 따라서 본 연구에서 선발한 OG-05 균주를 Lactiplantibacillus plantarum OG-05로 명명하였다.
Fig. 2.
Phylogenetic tree of the lactic acid bacteria OG-05 and closely related type strains. The phylogenetic tree was constructed based on 16S rRNA gene sequence alignments. The numbers near the nodes indicate the bootstrap values (>50%) based on 1,000 replicates calculated using the Neighbor-Joining (NJ) algorithm probabilities in MEGA 11.0. The scale bar indicates a branch length equivalent to 0.01 changes per nucleotide. Amylolactobacillus amylophilus NBRC 15881T served as the outgroup.
Download Original Figure
식물성 유산균을 이용한 인삼열매 발효물의 대사산물 확인
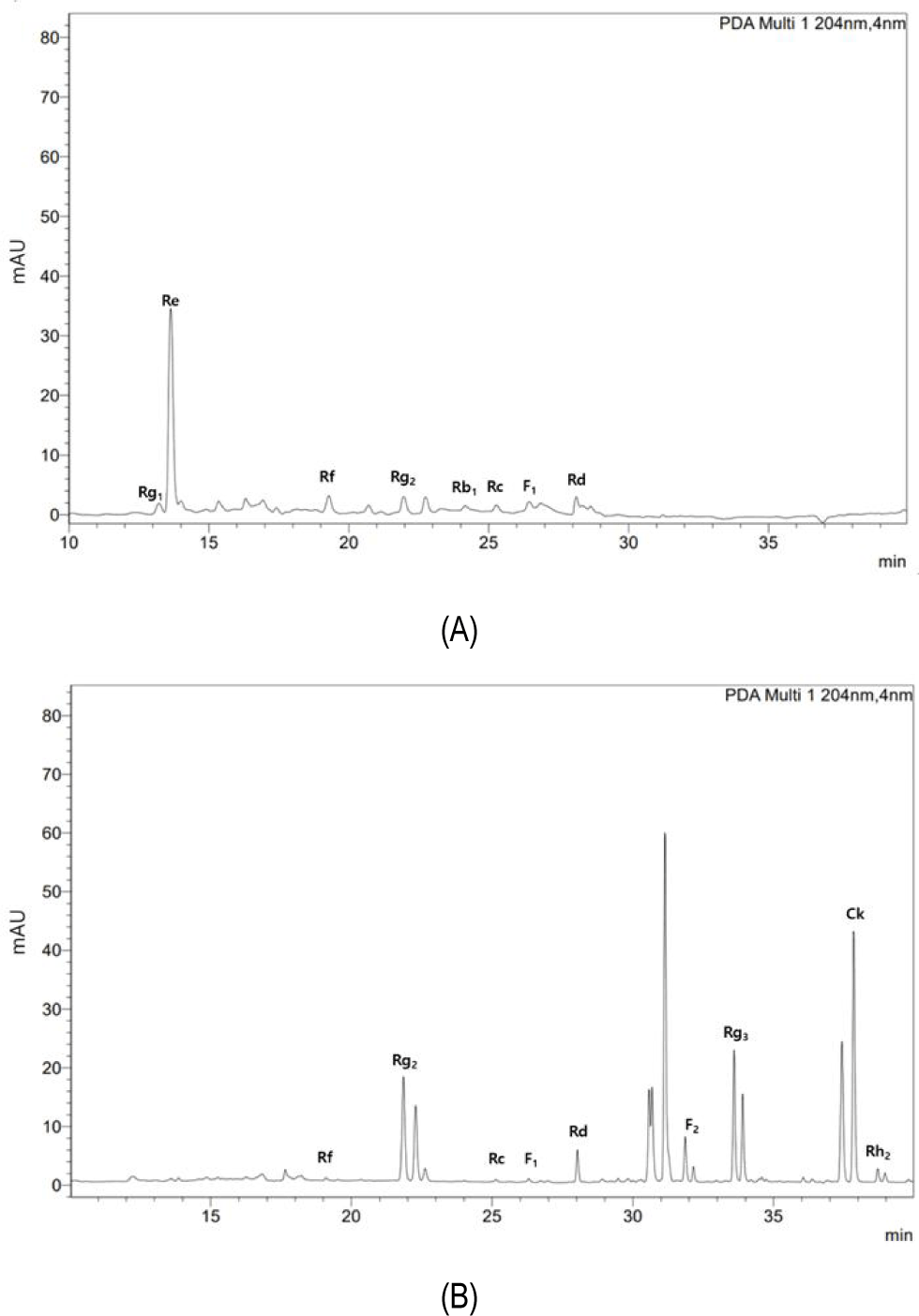
Lactiplantibacillus plantarum OG-05을 이용하여 얻어진 인삼열매 발효물에 존재하는 진세노사이드의 생물전환 산물을 HPLC를 사용하여 확인하였다. 10% 인삼열매 추출물(w/v)을 함유하고 있는 MRS 배지에서 24시간 배양한 후 조사포닌을 분리하여 HPLC 분석을 실시한 결과(Fig. 3), 생물전환에 의해 인삼열매 추출물에 가장 많이 존재하는 Re를 비롯한 Rg1, Rb1는 검출되지 않 았고 Rc와 F1는 약간 감소하였으며 Rf가 상당한 수준으로 감소한 반면, Rg2, Rd의 함량이 증가함을 알 수 있었다. 또한 생물전환하기 전에는 존재하지 않았던 F2, Rg3, CK, Rh2의 경우 상당 수준 생성된 것을 확인할 수 있었다(Table 3). 본 연구결과에 의하면, 인삼열매 추출물을 Lactiplantibacillus plantarum OG-05로 발효하였을 경우 PPD (protopanaxadiol) 타입의 진세노사이드 Rb1은 β-glucosidase 등의 효소작용에 의해 당이 제거되어 Rd로 전환되고 Rd를 경유하여 Rg3와 Rh2 또는 F2와 CK로 전환된 것으로 추정되었다(Kim et al., 2008, Shim et al., 2014). 또한 진세노사이드 Re는 PPT(protopanaxatriol)타입으로 C-6위치에 glucose 한 분자와 rhamnose 한 분자가 결합되어 있으며 C-20 위치에 glucose 한 분자가 결합되어 있는 구조를 가지고 있어 가수분해되어 Rg2로 전환된 것으로 판단되었다(Shim et al., 2014). Rg2, Rg3, Rh2, CK와 같은 저분자 진세노사이드는 일반적으로 인삼에서는 거의 검출되지 않고 홍삼에 일부 함유되어 있기 때문에 이러한 저분자 진세노사이드가 함유되어 있는 제품을 생산하기 위해서는 고분자 진세노사이드로부터 당의 가수분해를 유도하거나 생물전환을 통하여 고분자 진세노사이드 내부에 있는 글라이코사이드 결합을 분해하여야 한다(Bae et al 2002; Chi et al., 2005) 진세노사이드 Rb1, Rb2 및 Rc로부터 생물전환하여 얻어진 CK는 항염증 및 항종양 효과가 향상된 것으로 보고되었고 탈당화를 통해 저분자화된 Rg3, Rh2, CK는 암세포 전이 억제작용, 혈소판 응집 억제 작용을 나타내는 기능성 식품소재로 사용하거나 기능성 화장품의 원료로도 사용되어지고 있다(Choi et al., 2012; Guo et al., 2007; Hu et al., 2012; Joh et al., 2011; Ko et al., 2009). 이러한 인삼 사포닌의 약리 활성 이외에 인삼 진세노사이드 분석기술과 함께 인삼 사포닌 성분이 체내에서 어떻게 흡수가 되는지에 대한 연구가 이루어지고 있다(Bae et al 2003; Hu et al., 2012; Kim, 2018; Kim et al 2013). 따라서 본 연구 결과 인삼열매의 고분자 진세노사이드가 Lactiplantibacillus plantarum OG-05에 의한 발효에 의해 저분자 진세노사이드로 전환된 것으로 추정되며 인삼열매 발효물에 대한 기능성 및 체내흡수율에 대한 더 많은 연구가 진행되어야 할 것으로 생각된다.
Fig. 3.
Ginsenosides chromatogram of the ginseng berry extracted or fermented by Lactiplantibacillus plantarum OG-05 (A) the ginseng berry extracted (B) the ginseng berry fermented by Lactiplantibacillus plantarum OG-05.
Download Original Figure
Table 3.
Ginsenosides composition of the ginseng berries extracted or fermented by Lactiplantibacillus plantarum OG-05
| Ginsenosides (mg/g ginseng berry extracted or fermented) |
|
|
Rg1 |
Re |
Rf |
Rg2 |
Rb1 |
Rc |
F1 |
Rd |
F2 |
Rg3 |
CK |
Rh2 |
| Extraction |
9.05±0.24 |
144.40±4.56 |
14.11±0.27 |
11.37±0.43 |
2.26±0.18 |
1.94±0.21 |
3.49±0.23 |
3.72±0.04 |
- |
- |
- |
- |
| Fermentation |
- |
- |
0.66±0.05 |
36.07±0.66 |
- |
0.75±0.04 |
1.12±0.09 |
8.08±0.10 |
3.62±0.26 |
31.90±0.87 |
64.58±0.57 |
2.85±0.06 |
Download Excel Table
요약
본 연구에서는 인삼열매 생물전환 활성을 나타내는 식물성 유산균을 탐색하기 위해 김치로부터 분리한 유산균으로부터 β-glucosidase 활성이 우수하고 인삼열매에 다량 존재하는 진세노사이드를 생물전환하여 당 부위를 제거하고 저분자 진세노사이드로 전환할 수 있는 균주를 분리하고자 하였다.
김치에서 분리한 120여 종의 유산균 중 esculin agar법을 이용하여 β-glucosidase활성을 나타내는 42종의 유산균을 분리하였고 세포 내 효소분획의 β-glucosidase 활성을 조사한 결과, glucosidase 효소활성 및 β-glucosidase 효소 비활성이 가장 우수한 OG-05를 선발하였다.
β-Glucosidase 활성을 우수한 김치유산균 OG-05에 대해 16S rRNA 염기서열분석에 기반하여 미생물동정을 수행하였을 때 100%의 신뢰도로 Lactiplantibacillus plantarum으로 동정되어 선발된 OG-5균주를 Lactiplantibacillus plantarum OG-05로 명명하였다.
선발된 유산균을 이용하여 인삼열매 발효물에 존재하는 진세노사이드의 생물전환 산물을 HPLC를 사용하여 확인하였을 때 생물전환에 의해 인삼열매 추출물에 가장 많이 존재하는 Re를 비롯한 Rg1, Rb1, Rb2는 검출되지 않았고 Rc와 F1는 약간 감소하였으며 Rf가 상당한 수준으로 감소한 반면, Rg2, Rd의 함량이 증가함을 알 수 있었다. 또한 생물전환하기 전에는 존재하지 않았던 F2, Rg3, CK, Rh2의 경우 상당 수준 생성된 것을 확인할 수 있었다. 따라서 본 연구 결과 인삼열매를 적절한 조건으로 발효하였을 때 일부 진세노사이드의 변형을 통해 고분자 진세노사이드가 저분자 진세노사이드로 전환된 것을 확인할 수 있었다.
감사의 글
본 과제는 교육부와 한국연구재단의 재원으로 지원을 받아 수행된 3단계 산학연협력 선도전문대학 육성사업(LINC 3.0)의 연구결과이며 이에 감사드립니다.
References
Akao T, Kida H, Kanaoka M, Hattori M and Kobashi K (1998) Intestinal bacterial hydrolysis is required for the appearance of compound K in rat plasma after oral administration of ginsenoside Rb
1 from
Panax ginseng.
J. Pharm. Pharmacol.50, 1155-1160.



Attele AS, Wu JA and Yuan AC (1999) Ginseng pharmacology: multiple constituents and multiple actions.
Biochem. Pharmacol.58, 1685-1693.



Bae EA, Kim NY, Han MJ, Choo MK and Kim DH (2003) Transformation of ginsenosides to compound K (IH-901) by lactic acid bacteria of human intestine.
J. Microbiol. Biotechnol.13, 9-14.

Bae EA, Han MJ, Choo MK, Park SY and Kim DH (2002) Metabolism of 20(S)-and 20(R)-ginsenoside Rg
3 by human intestinal bacteria and its relation to
in vitro biological activities.
Biol. Pharm. Bull.25, 58-63.



Chi H, Kim DH and Ji GE (2005) Transformation of ginsenosides Rb
2 and Rc from
Panax ginseng by food microorganisms.
Biol. Pharm. Bull.28(11), 2102-2105.



Choi KT (2008) Botanical characteristics, pharmacological effects and medicinal components of Korean
Panax ginseng CA Meyer.
Acta. Pharmacol. Sin.29, 1109-1118.



Choi WY, Lee CG, Song CH, Seo YV, Kim JS, Kim BH, Shin DH, Yoon CS, Lim HW and Lee HY (2012) Enhancement of low molecular ginsenoside contents in low quality fresh ginseng by fermentation process.
Korean J. Medicinal Crop Sci.20(2), 117-123.


Coulon S, Chemardin P, Gueguen Y, Arnaud A, and Galzy P (1998) Purification and characterization of an intracellular
β-glucosidase from
Lactobacillus casei ATCC 393.
Appl. Biochem. Biotechnol.74, 105-114.


Deng HL and Zhang JT (1991) Anti-lipid peroxilative effect of ginsenoside Rb
1 and Rg
1. Chin. Med. J.104, 395-398.

Gueguen Y, Chemardin P, Labrot P, Arnaud A and Galzy P (1997) Purification and characterization of an intracellular
β-glucosidase from a new strain of
Leuconostoc mesenteroides isolated from cassava.
J. Appl. Microbiol.82, 469-476.


Guo ZY, Yi PF, Wang L, Qing SH and Wei XB (2007) Effect of ginsenoside Rh
2 with molecular modification on immune function in mice.
Zhong Shou Yi Yi Yao Za Zhi.
1, 13-16

Ha YJ, Yoo SK and Kim MR (2016) Process optimization of ginseng berry extract fermentation by
Lactobacillus sp. strain KYH isolated from fermented kimchi and product analysis.
Journal of the East Asian Society of Dietary Life.
26(1), 88 98


Joh EH, Lee IA, Jung IH and Kim DH (2011) Ginsenoside Rb1 and its metabolite compound K inhibit IRAK-1 activation—the key step of inflammation.
Biochemical Pharmacology,
82(3), 278-286.



Kim DH (2012) Chemical diversity of
Panax ginseng, Panax quinquifolium, and
Panax notoginseng.
J. Ginseng Res.36(1), 1-15.




Kim KA, Jung IH, Park SH, Ahn YT, Huh CS and Kim DH (2013) Comparative analysis of the gut microbiota in people with different levels of ginsenoside Rb
1 degradation to compound K.
PLoS One.
8(4), e62409.




Kim JH, Ahn SC, Choi SW, Hur NY, Kim BY and Baik MY (2008) Changes in effective components of ginseng by puffing.
Korean Soc. Appl. Biol. Chem.51(3), 188-193.

Kim YK, Yoo DS, Xu H, Park NI, Kim HH, Choi JE and Park SU (2009) Ginsenoside content of berries and roots of three typical Korean ginseng (
Panax ginseng) cultivars.
Nat. Prod. Commun.
4, 903-906.


Ko H, Kim YJ, Park JS, Park JH and Yang HO (2009) Autophagy inhibition enhances apoptosis induced by ginsenoside Rk
1 in hepatocellular carcinoma cells.
Biosci. Biotechnol. Biochem.73, 2183-2189.



Li W, Gu C, Zhang H, Awang DV, Fitzloff JF, Fong HH and van Breemen RB (2000) Use of high-performance liquid chromatography tandem mass spectrometry to distinguish
Panax ginseng CA Meyer (Asian ginseng) and
Panax quinquefolius L. (North American ginseng).
Analytical Chemistry.72(21), 5417-5422



Lu JM, Yao Q and Chen C (2009) Ginseng compounds: An update on their molecular mechanisms and medical applications.
Curr. Vasc. Pharmacol.
7, 293-302




Ma L, Liu H, Xie Z, Yang S, Xu W, Hou J and Yu B (2014) Ginsenoside Rb
3 protects cardiomyocytes against ischemia-reperfusion injury via the inhibition of JNK-mediated NF-kappaB pathway: A mouse cardiomyocyte model.
PLoS One.9, e103628.




Quan HY, Yuan HD, Jung MS, Ko SK, Park YG and Chung SH (2012) Ginsenoside Re lowers blood glucose and lipid levels via activation of AMP-activated protein kinase in HepG2 cells and high-fat diet fed mice.
Int. J. Mol. Med.29, 73-80.

Shim KS, Park GG and Park YS (2014) Bioconversion of puffed red ginseng extract using
β-glucosidase-producing lactic acid bacteria.
Food Eng. Prog.18(4), 332-340.


Yun TK (2001)
Panax ginseng-a non organ specific cancer preventive?
Lancet Oncol.2, 49-55.



Zhang CZ, Yu HS, Bao YM, An LJ and Jin FX (2001) Purification and characterization of ginsenoside-beta-glucosidase from ginseng.
Chem. Pharm. Bull.49(7), 795-798.



Zhao H, Li Q, Pei X, Zhang Z, Yang R, Wang J and Li Y (2009) Long-term ginsenoside administration prevents memory impairment in aged C57BL/6J mice by up-regulating the synaptic plasticity-related proteins in hippocampus.
Behav. Brain Res.201, 311-317.