Research Article
김치 유래 유산균의 발효유 스타터로서의 가능성 평가
Evaluation of Lactic Acid Bacteria Isolated from Kimchi as Potential Starters for Fermented Milk
Du-Na Yu1
,
Jeong-Eun Lee2
,
Moochang Kook3,*
Author Information & Copyright ▼
1Department of Biotechnology, Kyunghee University, Gyeonggi 17104, Republic of Korea
2Industry Academic Cooperation Foundation, Baewha Women's University, Seoul 03039, Republic of Korea
3Department of Food & Nutrition, Baewha Women's University, Seoul 03039, Republic of Korea
*Corresponding author : Moochang Kook, Department of Food & Nutrition, Baewha Women’s University, 34, Pirundae-ro 1-gil, Jongno-gu, Seoul 03039, Korea. Tel: +82-2-399-0765, Fax: +82-2-737-6711, E-mail:
bmse153@gmail.com
Copyright © Korean Society for Lactic Acid Bacteria and Probiotics. This is an Open-Access article distributed under the terms of the
Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0/) which permits
unrestricted non-commercial use, distribution, and reproduction in any
medium, provided the original work is properly cited.
Received: Dec 11, 2023; Revised: Dec 29, 2023; Accepted: Dec 29, 2023
Published Online: Dec 31, 2023
Abstract
This study aimed to confirm the suitability of lactic acid bacteria isolated from Kimchi as starters for fermented milk by assessing their carbohydrate availability, enzyme activity, and growth characteristics. The isolates L. pentosus LK013 exhibited a 99.79% similarity to L. pentosus DSM 20314T, P. pentosaceus LK019 showed a 99.86% similarity to P. pentosaceus DSM 20336T, L. brevis LK030 displayed a 99.72% similarity to L. brevis ATCC 14869T, and L. brevis P215 demonstrated a 99.59% similarity to L. brevis ATCC 14869T. Regarding carbohydrate availability, P. pentosaceus LK019 exhibited higher availability of L-arabinose, L-rhamnose, N-acetylglucosamine, amygdalin, arbutin, esculin, salicin, and gentiobiose, as well as D-form carbohydrates compared to other strains. Meanwhile, L. brevis LK030 and L. brevis P215 were able to utilize pentoses such as L-arabinose and D-ribose, as well as hexoses such as D-galactose and D-glucose. On the other hand, L. pentosus LK013 demonstrated the ability to use L-arabinose, N-acetyl-glucosamine, esculin, D-ribose, D-glucose, D-fructose, D-cellobiose, and D-maltose. In addition, P. pentosaceus LK019 exhibited higher leucine arylamidase and valine arylamidase activities than others. L. pentosus LK013 was confirmed to have enzyme activities such as Lipase, Leucine arylamidase, valine arylamidase, β-glucuronidase, α-glucosidase, and β-glucosidase. L. brevis LK030 and L. brevis P215 demonstrated outstanding activity against lipid-hydrolyzing enzymes, specifically esterase and esterase lipase, which facilitate effective digestion in the human digestive system. Furthermore, they exhibited activity against α-galactosidase, which is responsible for decomposing non-absorbable raffinose and stachyose. The growth curve analysis of lactic acid bacteria revealed that all bacteria were capable of acid production, maintaining a low pH throughout proliferation. These results suggest that the isolates (L. pentosus LK013, P. pentosaceus LK019, L. brevis LK030, and L. brevis P215) can be used as starters in fermented milk.
Keywords: lactic acid bacteria; starter; fermented milk; carbohydrates availability; enzyme activity
서 론
우리나라의 전통 발효식품인 김치에는 주로 Lactobacillus, Lactococcus, Pediococcus 및 Weissella 등 다양한 속의 유산균이 존재한다고 보고되어 왔다(Choi et al., 2013; Ko et al., 2013). 김치의 발효과정에서 주된 역할을 하는 유산균(lactic acid bacteria, LAB)은 포도당 등의 당류를 이용하여 유산 및 초산과 같은 유기산, 과산화수소, 단쇄지방산 및 박테리오신과 같은 항균물질 등의 다양한 대사산물을 생산한다(Fijan, 2014; Reid et al., 2003). 이러한 대사산물은 식품의 부패를 억제함과 동시에, 섭취 시 장내 미생물 총의 균형을 유지하며, 항균 효과, 항암 효과, 고혈압 및 고지혈증 개선 효과, 면역력 증진과 같은 다양한 기능성을 나타내는 것으로 알려져 있다(Kim and Kim, 2006a; Lee et al., 2012a; Shon et al., 2007). 또한 유산균은 인삼의 ginsenoside 생물전환(Park et al., 2017a), GABA(γ-aminobutyric acid) 생산(Wu et al., 2018), riboflavin 생산(Thakur et al., 2016) 등 유용한 물질들을 생산하기 위한 starter 균주로서 연구된 바 있으며, 식품뿐만 아니라 화장품과 의약품 등의 다양한 분야에서도 유산균을 활용한 연구가 진행되고 있다(Ondee et al., 2021; Tsai et al., 2021; Si et al., 2022).
유산균은 그람 양성, 통성 혐기성 세균으로 그 형태가 간균 또는 구균으로 다양하고 포자를 형성하지 않으며, 일반적으로 위장의 낮은 pH와 소장의 담즙에 내성을 지니며 안전성이 확보된 GRAS(generally regarded as safe) 미생물로 분류되고 있다(Erika et al., 2004). 유산균은 포도당 대사에서 파생된 최종 산물에 따라 동형 발효(homo-fermentation) 유산균과 이형 발효(hetero-fermentation) 유산균으로 구분된다(Park, 2017b). 동형 발효 유산균은 주로 Embden-Meyerhof 경로에 의해 포도당을 젖산으로 전환시키며 Lactiplantibacillus plantarum, Lacticaseibacillus casei, Lactococcus lactis 및 Enterococcus faecalis 등이 이에 속하며, 이형 발효 유산균은 6-phosphogluconate 경로에 의해 포도당을 젖산, 초산, 이산화탄소 및 에탄올로 전환시키며 Leuconostoc mesenteroides와 Levilactobacillus brevis가 이에 대표적으로 속한다(Cho, 1991; Hofvendahl and Hagerdal, 2000). 이러한 다양한 효능 및 특징 덕분에 유산균은 오래 전부터 식품에 이용되어 왔다. 대표적인 유산균 이용 식품으로는 발효유, 치즈, 버터 등의 유제품과 간장, 된장 등의 양조식품이 있다. 그 중 발효유는 유산균 또는 효모를 이용하여 원유를 발효시켜 만든 제품으로, 이전에는 주로 칼슘 섭취를 목적으로 하였지만, 최근 프로바이오틱스의 효능과 기능성에 대한 관심이 급증함에 따라 기능성이 강조된 제품 시장이 확장되고 있다(Kim et al., 2019b). 프로바이오틱스란 세계보건기구(World Health Organization, WHO)에서 “적당량 섭취 시 숙주에게 건강상 유익한 효과를 주는 살아있는 미생물”이라고 정의하고 있다. 특히 발효유는 이러한 프로바이오틱스를 쉽게 섭취할 수 있는 공급원으로서, 매년 전 세계적으로 섭취율이 증가하고 있는 추세이다(Kim and Chung, 2017c). 하지만 국내에서 사용되고 있는 발효 종균의 대부분은 해외로부터 수입된 것으로, 한국인의 체질에 맞지 않거나, 설사를 유발하는 등의 부작용이 발생할 수 있어 한국인에 적합한 발효 종균의 개발이 요구되는 실정이다.
따라서, 본 연구에서는 국내 발효유 제조용 스타터 균주 개발의 기초자료로 사용하고자 전통발효식품인 김치로부터 유산균을 분리 및 선발하고, 탄수화물 이용성과 효소 활성 및 생육 특성을 조사하였다.
재료 및 방법
김치 유래 유산균의 분리 및 동정
김치 시료는 Lactobacilli MRS broth(Difco Co., Sparks, MD, USA) 1 mL에 1%(v/v)로 접종하여 30℃에서 24시간 종균 배양하였다. 이후 MRS broth 1mL에 1%(v/v)로 접종하여 30℃에서 24시간 본 배양하였다. 이후 유산균 감별 배지인 Bromo Cresol Purple(BCP) plate count agar(EIKEN chemical, Tokyo, Japan)에 획선도말하여 30℃에서 48시간 배양하였고, 산을 생성하여 colony 주위에 노란색 환을 형성한 것을 취해 순수 분리하였다. 이후 16S rRNA 염기서열을 분석하여 최종 동정하였다(BIOFACT Co., Daejeon, Korea). 염기서열 분석을 위해 사용한 pirmer는 27F(5'-AGAGTTTGATCMTGGCTCAG-3') 및 1492R(5'-TACGGTTACCTTGTTACGACTT-3')이며, 분석한 염기서열은 EZBioCloud website(www.ezbiocloud.net)의 16S database tool을 기반으로 표준 균주의 염기서열과 비교하였으며, 계통수(phylogenetic tree)는 MEGA11 프로그램의 neighbor-joining 방법을 사용하여 작성하였다.
API 50 CHL kit를 이용한 탄수화물 이용성 확인
분리한 균주들의 탄수화물 이용성을 확인하고자 API 50 CHL kit(50300, BioMérieux, France)를 사용하였다. MRS broth 1 mL에 1%(v/v)로 접종하여 30℃에서 24시간 동안 배양한 균 배양액을 12,000 rpm에서 5분간 원심분리한 후 phosphate buffer saline(PBS)로 3회 washing하였다. 이후 suspention medium(BioMérieux, France)에 2 McFarland standard solution의 농도로 현탁시켜 탁도를 맞춘 후, API 50 CHL kit의 각 tube에 상기 균주를 200µL씩 분주한 후 각 큐플에 mineral oil을 2방울 정도 떨어뜨렸다. 이후 30°C에서 24시간 동안 배양하였으며, API 웹사이트(http://apiweb.biomerieux.com)에서 제공하는 판독표를 기준으로 49가지의 탄수화물 발효 여부를 확인하였다. API 50 CHL 결과는, 유산균이 스트립 내의 탄수화물 기질을 이용하여 만들어내는 젖산에 의하여 bromocresol purple 지시약의 색이 보라색에서 노란색으로 바뀜에 따라 그 정도의 차이를 + (활성 있음), ++ 및 +++ (강한 활성), w (약한 활성) 과 – (활성 없음)로 표기하였다.
API ZYM kit를 이용한 효소 활성 확인
분리한 균주들의 효소 활성을 확인하고자 API ZYM kit(25200, BioMérieux, France)를 사용하였다. MRS broth 1mL에 1%(v/v)로 접종하여 30℃에서 24시간 동안 배양한 균 배양액을 12,000rpm에서 5분간 원심분리한 후 phosphate buffer saline(PBS)로 3회 washing 하였다. 이후 suspention medium(BioMérieux, France)에 5-6 McFarland standard solution의 농도로 현탁시켜 탁도를 맞춘 후, API ZYM kit의 각 tube에 상기 균주를 65 µL씩 분주하고 알루미늄 호일로 감싸 빛을 차단한 후 30°C에서 4시간 동안 배양하였다. 배양 후 ZYM A 시약과 ZYM B 시약을 각각 한 방울씩 떨어뜨린 후 5분간 반응시켰으며, API 웹사이트(http://apiweb.biomerieux.com)에서 제공하는 판독표를 기준으로 19가지의 기질 이용 여부에 따라 효소 활성을 확인하였다. API ZYM 결과는, ZYM A 시약과 ZYM B 시약 첨가 후 판독표를 기준으로 색의 정도의 차이에 따라서 + (활성 있음), ++ 및 +++ (강한 활성), w (약한 활성) 과 – (활성 없음)로 표기하였다.
분리한 균주의 생육특성 확인
각각의 분리 균주를 MRS broth 30 mL에 5%(v/v)로 접종한 후 30°C에서 배양하면서 3시간 간격으로 시료를 채취하였다. 채취한 시료는 UV-Vis Spectrophotometer(OPTIZEN POP, Mecasys, South Korea)를 사용하여 600 nm에서 흡광도를 측정하였으며, 동시에 pH meter(Seven Compact Duo S213, Mettler Toledo, Switzerland)를 사용하여 균 배양액의 pH를 측정하였다.
결과 및 고찰
김치 유래 유산균의 분리 및 동정
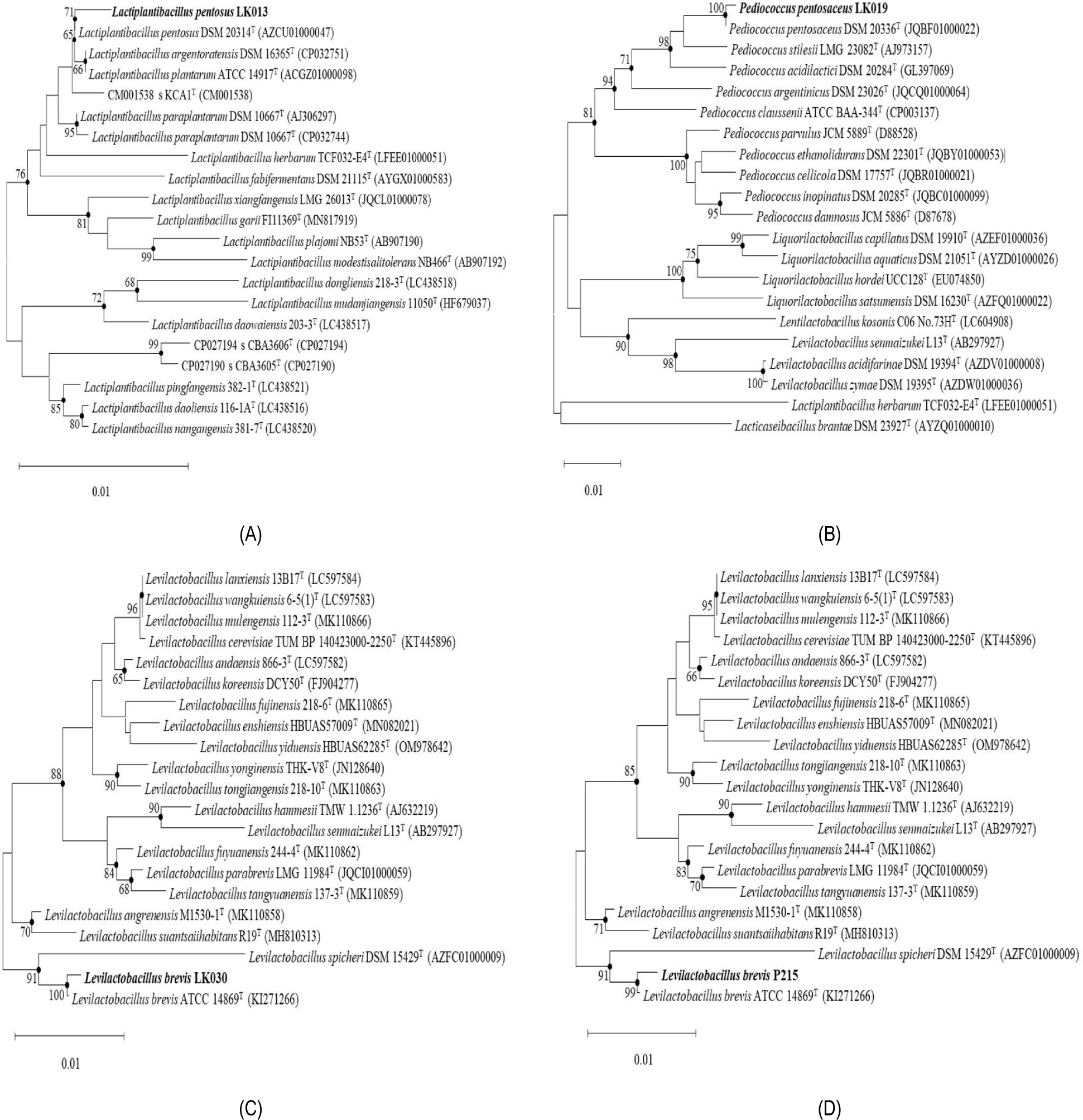
본 실험에서 분리한 균주인 LK013, LK019, LK030 및 P215의 16S rRNA 유전자 염기서열 분석 결과, LK013은 Lactiplantibacillus pentosus DSM 20314T와 99.79%, LK019는 Pediococcus pentosaceus DSM 20336T과 99.86%, LK030은 Levilactobacillus brevis ATCC 14869T와 99.72% 및 P215는 Levilactobacillus brevis ATCC 14869T와 99.59%의 유사도를 보이는 것으로 확인되어 각각 Lactiplantibacillus pentosus LK013, Pediococcus pentosaceus LK019, Levilactobacillus brevis LK030 및 Levilactobacillus brevis P215로 명명하였다(Fig. 1).
Fig. 1.
The neighbor-joining phylogenetic tree of strains (A) Lactiplantibacillus pentosus LK013, (B) Pediococcus pentosaceus LK019, (C) Levilactobacillus brevis LK030, and (D) Levilactobacillus brevis P215 from a comparative analysis of 16S rRNA gene sequences. Bootstrap values (expressed as a percentage of 1,000 replications) > 65% are shown at the branch points. Bar, 0.01 substitutions per nucleotide position).
Download Original Figure
탄수화물 이용성 확인
전통발효식품인 김치로부터 분리한 유산균의 발효유 스타터로서의 이용 가능성을 확인하기 위하여 각각의 분리 균주를 대상으로 49종의 탄수화물 이용성을 확인하였다. P. pentosaceus LK019는 본 연구에서 분리한 다른 균주에 비해 L-arabinose, L-rhamnose, N-acetylglucosamine, amygdalin, arbutin, esculin, salicin 및 gentiobiose와 D-ribose, D-xylose, D-galactose, D-glucose, D-fructose, D-mannose, D-cellobiose, D-maltose 및 D-trehalose와 같은 D-form 탄수화물의 이용성이 더 높았으며 Bajpai 등(2016)의 연구에 사용된 P. pentosaceus 4I1 및 Oh 등(2014)의 연구에 사용된 P. pentosaceus와 동일하게 L-arabinose, N-acetylglucosamine, amygdalin, arbutin, salicin, gentiobiose, D-ribose, D-galactose, D-glucose, D-fructose, D-cellobiose, D-maltose 및 D-trehalose를 이용하는 것으로 확인되었다. P. pentosaceus는 동형 발효균으로, 본 연구에서 분리한 P. pentosaceus LK019 또한 동형 발효균의 특징으로 인해, 기질로서 pentose인 L-arabinose, D-ribose를 이용할 수 있음을 확인하였다(Dobrogosz and Demoss, 1963). 반면에 L. brevis는 이형 발효균으로서 hexose 및 pentose을 대사하여 초산과 젖산을 생산할 수 있는 것으로 알려져 있으며(Kandler, 1983), 본 연구에서 분리한 L. brevis LK030과 L. brevis P215는 공통적으로 pentose인 L-arabinose, D-ribose 및 D-xylose와, hexose인 D-galactose, D-glucose 및 D-fructose를 이용할 수 있는 것으로 확인되었다. 하지만 두 균주는 같은 species임에도 불구하고 이용 가능한 탄수화물의 종류가 상이하였다. 이러한 결과는, 16S rRNA 유전자 염기서열 분석은 유전체 분석과 달리 유전자의 일부 구간만을 분석한 것이므로, 분석결과 100%의 유사도를 보이더라도 서로 다른 유전자를 갖고 있을 수 있기 때문으로 판단된다. 마지막으로 L. pentosus LK013은 Lee 등(2017b)의 연구결과와 유사하게 L-arabinose, D-ribose, D-glucose, D-fructose, N-acetyl-glucosamine, esculin, D-cellobiose, D-maltose, D-melibiose, D-trehalose, D-raffinose, gentiobiose 및 D-turanose를 이용하는 것으로 확인되었다(Table 1).
Table 1.
Carbohydrates availability of Lactiplantibacillus pentosus LK013, Pediococcus pentosaceus LK019, Levilactobacillus brevis LK030, and Levilactobacillus brevis P215 using API 50 CHL kit
| Carbohydrates |
LK013 |
LK019 |
LK030 |
P215 |
| Glycerol |
w3) |
- |
- |
- |
| L-Arabinose |
+2) |
+++1) |
+ |
+ |
| D-Ribose |
+ |
+++ |
+ |
+ |
| D-Xylose |
-4) |
+++ |
+ |
+ |
| Methyl-β D-xylopyranoside |
- |
- |
- |
+ |
| D-Galactose |
+ |
+++ |
+ |
+ |
| D-Glucose |
+ |
+++ |
+ |
+ |
| D-Fructose |
+ |
+++ |
+ |
+ |
| D-Mannose |
+ |
+++ |
+ |
- |
| L-Sorbose |
+ |
- |
+ |
- |
| L-Rhamnose |
w |
+ |
- |
- |
| D-Mannitol |
+ |
- |
+ |
- |
| D-Sorbitol |
+ |
- |
+ |
- |
| N-Acetylglucosamine |
+ |
+++ |
+ |
- |
| Amygdalin |
+ |
++1) |
+ |
- |
| Arbutin |
+ |
++ |
+ |
- |
| Esculin |
+ |
++ |
+ |
+ |
| Salicin |
+ |
++ |
+ |
- |
| D-Cellobiose |
+ |
+++ |
+ |
- |
| D-Maltose |
+ |
+++ |
+ |
+ |
| D-Lactose |
+ |
- |
+ |
- |
| D-Melibiose |
+ |
- |
+ |
+ |
| D-Saccharose |
+ |
- |
+ |
- |
| D-Trehalose |
+ |
+++ |
+ |
- |
| D-Melezitose |
+ |
- |
+ |
- |
| D-Raffinose |
+ |
- |
- |
- |
| Gentiobiose |
+ |
+ |
w |
- |
| D-Turanose |
+ |
- |
+ |
- |
| D-Arabitol |
w |
- |
- |
- |
| Potassium gluconate |
+ |
- |
- |
- |
Download Excel Table
효소활성 확인
본 연구에서는 API ZYM kit를 사용하여 탄수화물, 단백질, 지질 등의 대사에 관여하는 서로 다른 19가지 효소에 대하여 각각의 분리 균주들의 효소활성을 확인함으로써 발효유 스타터로서의 이용 가능성을 확인하였다. P. pentosaceus LK019는 Zommiti 등(2018)의 연구에서 발견된 균주인 P. pentosaceus MZF16과 동일하게 강력한 leucine arylamidase, valine arylamidase, N-acetyl-β-glucosaminidase 및 β-glucosidase 활성을 나타 내었으며, L. pentosus LK013 또한 상기 효소 활성이 있음을 확인하였다. 그 중 β-glucosidase는 배당체 형태의 화합물을 비배당체 형태의 화합물로 가수분해하는 특성을 가지고 있어, 소화 흡수율을 높여 식품 산업의 다양한 분야에서 활용되고 있다(Chun et al., 2008). 대표적으로 식품에 함유되어 있는 배당체 화합물의 예로는 이소플라본(isoflavone)과 사포닌(saponin) 등이 있다. 이소플라본은 콩에 존재하는 피토케미컬(phytochemical)로 식물성 에스트로겐(phytoestrogen)이며, 여성 호르몬인 에스트로겐과 구조 및 생리활성이 매우 유사하다(Vitale et al., 2013). 또한 이소플라본은 갱년기 여성의 골다공증과 고지혈증 개선뿐만 아니라, 항산화 및 항암 효과 등을 나타내는 것으로 보고된 바 있다(Ewies, 2002). 사포닌을 함유하고 있는 식품에는 콩, 더덕, 도라지 및 칡 등이 있지만, 가장 함유량이 많은 식품은 인삼이다. 인삼의 주요 약리성분으로 알려져 있으며, 인삼 사포닌인 진세노사이드(ginsenoside)는 면역 기능 조절, 항암 효과 및 항당뇨 효과 등 우수한 생리활성을 가진 것으로 보고되어 있다(Benishin et al., 1992; Mei et al., 1994; Saito et al., 1988). 하지만 이소플라본과 진세노사이드는 대부분 식품에 배당체 형태로 존재하기 때문에 체내 흡수율이 낮다는 단점이 있다. 이러한 단점을 극복하기 위하여 최근 들어 Pediococcus pentosaceus 균주를 이용하여 칡 추출물에 함유된 이소플라본을 저분자 물질인 다이하이드로다이드제인(dihydrodaidzein)으로 전환한 연구(Lee et al., 2013c), 대두의 이소플라본을 Lactobacillus plantarum과 Bifidobacterium longum 균주를 이용하여 비배당체로 전환한 연구(Kim et al., 2010d) 및 배당체 형태의 진세노사이드 Rb1과 Rb2를 Leuconostoc mesenteroides 균주를 이용하여 비배당체 형태의 진세노사이드 Rg3로 전환한 연구(Shim et al., 2014) 등 유산균을 이용하여 배당체를 비배당체로 전환하는 연구가 활발히 진행되고 있다. 따라서 유산균을 활용한 발효유 스타터의 개발은 스타터 자체로 이용할 수 있을 뿐만 아니라 유산균이 생산하는 생리활성 물질에 의한 기능성 효과를 기대할 수 있을 것이라 판단된다. L. brevis LK030과 L. brevis P215는 매우 유사한 효소 활성을 가진 것으로 확인되었으며 지질 가수분해 효소인 esterase 및 esterase lipase에 대한 활성과 인간의 위장과 소장에서 소화되고 흡수되지 않는 raffinose와 stachyose를 분해하는 α-galactosidase에 대한 활성을 가지고 있는 것으로 확인되었다(Table 2).
Table 2.
Enzyme activity of Lactiplantibacillus pentosus LK013, Pediococcus pentosaceus LK019, Levilactobacillus brevis LK030, and Levilactobacillus brevis P215 using API ZYM kit
| Substrats |
LK013 |
LK019 |
LK030 |
P215 |
| Esterase (C4) |
w3) |
- |
+ |
+ |
| Esterase lipase (C8) |
w |
- |
+ |
+ |
| Lipase (C14) |
+2) |
- |
- |
- |
| Leucine arylamidase |
+ |
+++1) |
+ |
+ |
| Valine arylamidase |
+ |
+++ |
+ |
+ |
| Cystine arylamidase |
w |
+ |
w |
+ |
| Acid phosphatase |
w |
+ |
+ |
w |
| Naphthol-AS-BI-phosphohydrolase |
+ |
++1) |
+ |
+ |
| α-Galactosidase |
w |
- |
+ |
+ |
| β-Glucuronidase |
+ |
- |
+ |
+ |
| β-Glucosidase |
-4) |
- |
+ |
w |
| α-Glucosidase |
+ |
- |
+ |
+ |
| β-Glucosidase |
+ |
++ |
+ |
+ |
| N-Acetyl-β-glucosaminidase |
+ |
++ |
- |
- |
Download Excel Table
분리한 균주의 생육특성
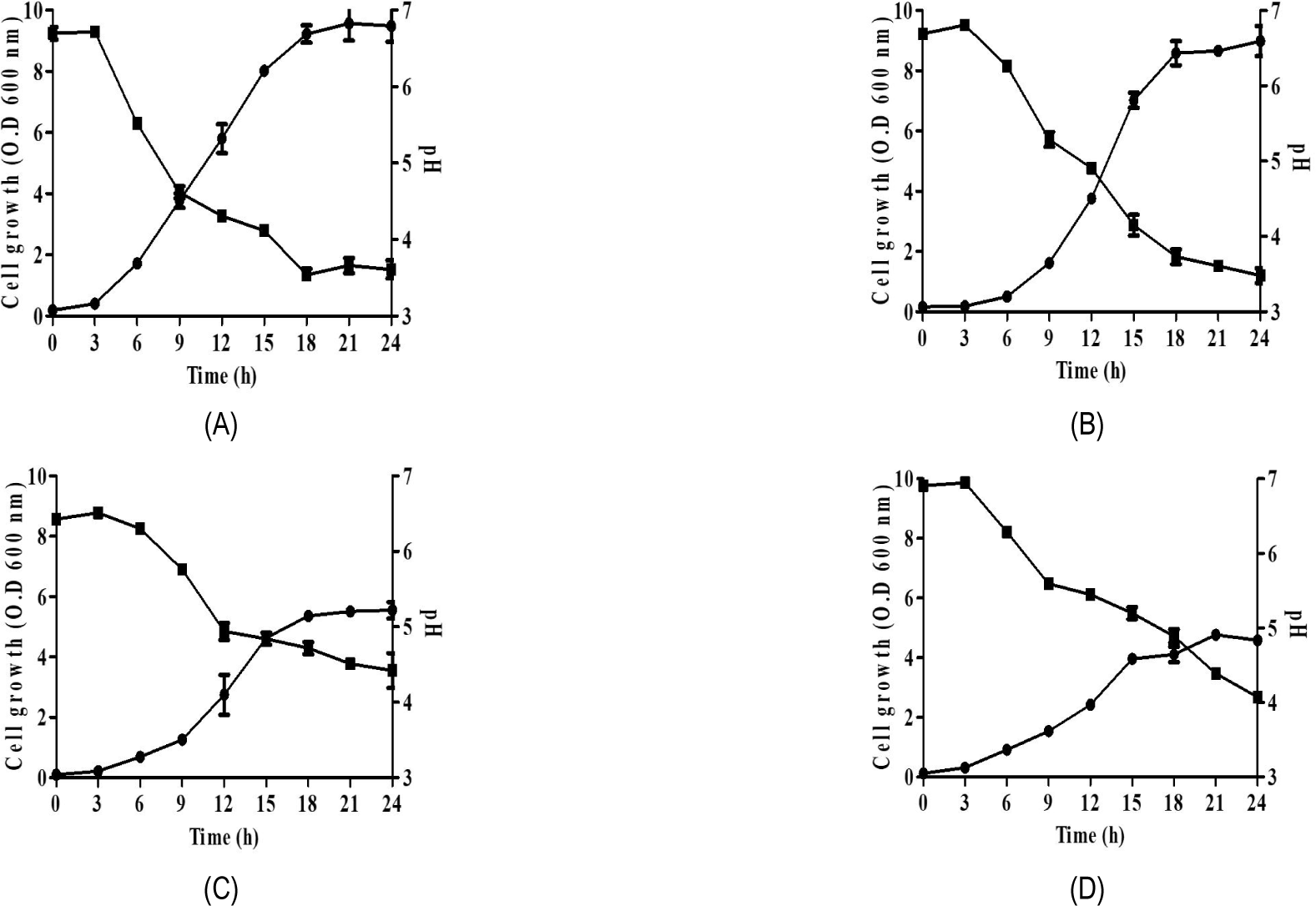
유산균을 이용한 발효유는 유산균이 생장하면서 만들어내는 젖산에 의한 낮은 pH가 장내 유해세균을 억제하고 유익한 세균의 성장을 촉진할 뿐만 아니라 숙주의 면역력을 높여주고, 성인병 예방에 기여하는 등의 건강 증진 효과가 있다. 따라서 본 연구에서는 배양시간에 따른 흡광도 및 pH 측정 결과를 기반으로 하여 분리된 각 균주의 생육특성을 확인함으로써 발효유 스타터로서의 이용 가능성을 확인하였다(Fig. 2). L. pentosus LK013 균주는 배양 6시간부터 대수 증식기에 접어들어 21시간에서 24시간 사이에 최대 증식을 나타내었으며, 이때의 pH는 젖산 및 초산과 같은 산의 생성으로 인해 3.61까지 낮아지는 것을 확인할 수 있었다. P. pentosaceus LK019 균주 또한 21시간에서 24시간 동안 균의 성장률이 최대치에 도달하였으며, 이에 따라 pH가 3.48까지 낮아지는 것을 확인할 수 있었다. L. brevis LK030 및 P215 균주는 6시간부터 대수 증식기에 진입하여 24시간에 최대 증식을 보였다. L. pentosus LK013, P. pentosaceus LK019, L. brevis LK030 및 P215 균주의 균수는 각각 배양 18시간차에 3.23±0.07×109 CFU/mL, 4.17±0.40×109 CFU/mL, 3.87±0.35×109 CFU/mL 및 2.55±0.13×109 CFU/mL인 것으로 확인되었다. 특히 L. brevis LK030 및 P215 균주는 본 연구에서 분리한 다른 균주와 비교하였을 때, 증식에 비해 상대적으로 낮은 pH를 나타내었다. Bae 등 (2004)에 따르면 유산균의 종에 따라 생장 양상 및 pH의 경향이 다르게 나타난다고 보고한 바 있다. LK030과 P215 균주의 생육이 다른 두 균주에 비해 낮은 이유도 이와 같은 결과와 일치하는 것으로 판단된다. Lonner와 Preve(1989)의 연구에 따르면 이형발효 특성을 가진 L. brevis가 다른 균주보다 산 생성량이 가장 많다고 보고한 바 있다. 이러한 분리 균주들의 산 생산에 따른 낮은 pH는 발효유 제조 시 병원성 세균 및 이취를 내게 하는 세균의 성장을 억제하는 효과를 가지고 있어 스타터 균주로서 가치가 있다고 판단된다.
Fig. 2.
Growth profile of (A) Lactiplantibacillus pentosus LK013, (B) Pediococcus pentosaceus LK019, (C) Levilactobacillus brevis LK030, and (D) Levilactobacillus brevis P215. ●; cell growth, ■; pH. Data are presented as mean ± SD (n=3).
Download Original Figure
요약
본 연구에서는 발효유 제조용 스타터 균주 개발의 기초자료로 사용하기 위해 전통발효식품인 김치로부터 유산균을 분리 및 동정하고, 탄수화물 이용성과 효소 활성 및 생육 특성을 조사하기 위해 실시하였다. 김치에서 분리한 4주의 유산균은 16S rRNA 유전자 염기서열 분석에 따라 각각 Lactiplantibacillus pentosus LK013, Pediococcus pentosaceus LK019, Levilactobacillus brevis LK030 및 Levilactobacillus brevis P215로 명명하였다. 탄수화물 이용성에 관해서 P. pentosaceus LK019는 본 연구에서 분리한 다른 균주에 비해 L-arabinose, L-rhamnose, N-acetylglucosamine, amygdalin, arbutin, esculin, salicin 및 gentiobiose와 D-form 탄수화물의 이용성이 더 높았으며, L. brevis LK030과 L. brevis P215는 pentose인 L-arabinose 및 D-ribose 등과 hexose인 D-galactose 및 D-glucose 등을 이용할 수 있었고, L. pentosus LK013은 L-arabinose, N-acetyl-glucosamine, esculin, D-ribose, D-glucose, D-fructose, D-cellobiose 및 D-maltose 등을 이용할 수 있었다. 또한 효소 활성에 대해서는 P. pentosaceus LK019는 leucine arylamidase, valine arylamidase 및 β-glucosidase 활성이 우수한 것으로 확인되었고, L. brevis LK030과 L. brevis P215는 지질 가수분해 효소인 esterase 및 esterase lipase에 대한 활성이 우수했다. 또한 인간의 소화기관에서 소화, 흡수되지 않는 raffinose와 stachyose를 분해하는 α-galactosidase에 대한 활성을 가지고 있는 것으로 확인되었다. 본 연구에서 분리한 4주의 유산균에 대한 생육 특성 확인 결과, 모든 균들이 대수 증식기를 거쳐 최종적으로 3.48-4.42의 pH를 유지하는 것을 확인할 수 있었다. 이상의 결과를 미루어 볼 때 김치로부터 분리한 Lactiplantibacillus pentosus LK013, Pediococcus pentosaceus LK019, Levilactobacillus brevis LK030 및 Levilactobacillus brevis P215는 발효유 제조 시 스타터 균주로서 개발 가능성이 있다고 판단된다.
감사의글
이 성과는 정부(과학기술정보통신부)의 재원으로 한국연구재단의 지원을 받아 수행된 연구임(2022R1F1A1066873).
References
Benishin CG (1992) Actions of ginsenoside Rb1 on choline uptake in central cholinergic nerve endings.
Neurochem Int.21, 1-5.



Bae HC, Paik SH and Nam MS (2004) Fermentation properties of rice added yogurt made with various lactic acid bacteria.
J. Anim. Sci. &
Technol.
46, 677-686.


Bajpai VK, Han JH, Rather I A, Park C, Lim J, Paek WK, Lee JS, Yoon JI and Park YH (2016) Characterization and antibacterial potential of lactic acid bacterium
Pediococcus pentosaceus 4I1 isolated from freshwater fish
Zacco koreanus.
Front. Microbiol.
7, 2037.


Choi HN, Oh HH, Yang HS, Huh CK, Bae IH, Lee JS, Jeong YS, Jeong EJ and Jung HK (2013) Antifungal activity against cheese fungi by lactic acid bacteria isolated from kimchi.
Korean J. Food Preserv.
20(5), 727-734.


Cho JS (1991) Changes of microflora and chemical composition during the kimchi fermentation.
K. J. Dietary Culture.
6, 479-501.

Chun JY, Jeong WJ, Kim JS, Lim JK, Park CS, Kwon DY, Choi I and Kim JH (2008) Hydrolysis of isoflavone glucosides in soymilk fermented with single or mixed cultures of
Lactobacillus paraplantarum KM,
Weissella sp. 33, and
Enterococcus faecium 35 isolated from humans.
J. Microbiol. Biotechnol.18(3), 573-578.

Dobrogosz WJ and Demoss RD (1963) Induction and repression of L-arabinose isomerase in
Pediococcus pentosaceus.
J. Bacteriol.
85(6), 1350-1355.




Ewies AA (2002) Phytoestrogens in the management of the menopause: Up-to-date.
Obstet. Gynecol. Surv.
57, 306-313.



Hofvendahl K and Hagerdal-Hahn B (2000) Factors affecting the fermentative lactic acid production from renewable resources.
Enzyme Microb. Technol.26, 87-107.



Isolauri E, Salminen S and Ouwehand AC (2004) Probiotics.
Best Pract. Res. Clin. Gastroenterol.18(2), 299-313.



Kim KH and Chung KH (2017c) Assessment of dental erosion potential by the type of fermented milk.
J. Korean Soc. Dent. Hyg.17, 657-667.


Ko KH, Liu W, Lee HH, Yin J and Kim IC (2013) Biological and functional characteristics of lactic acid bacteria in different kimchi.
J. Korean Soc. Food Sci. Nutr.
42(1), 89-95.


Kim IB, Shin S, Lim BL, Seong GS and Lee YE (2010d) Bioconversion of soybean isoflavone by
Lactobacillus plantarum and
Bifidobacterium longum.
Korean J. Food Cookery Sci.
26, 214-219.

Kim MJ and Kim GR (2006a)
In vitro evaluation of cholesterol reduction by lactic acid bacteria extracted from kimchi.
Culi. Sci. Hos. Res.
12, 259-268.

Kandler O (1983) Carbohydrate metabolism in lactic acid bacteria.
Antonie van Leeuwenhoek.
49, 209-224.



Kim Y, Yoon Y, Lee S (2019b) Serum cholesterol-lowering effect of fermented milk and effect of intestinal microflora composition on function of fermented milk
. J. Milk Sci. Biotechnol.37, 27-32.


Lönner C and Preve-Akesson K (1989) Effects of lactic acid bacteria on the properties of sour dough bread.
Food Microbiol.6(1), 19-35.


Lee H, Cha SS, Lee MY, Chang HC and Lee JJ (2013c) Acute toxicity of
Leuconostoc citreum GR1 isolated from kimchi in mice.
Korean J. Food Preserv.20, 121-126.


Lee HY, Lee JS, Kim DH, Lee SG, Lee YJ and Kim MD (2012a) Extraction methods influence inhibitory effects of
Agrimonia pilosa on the growths of meat-poisoning lactic acid bacteria.
Food Eng. Prog.16, 180-184.

Lee WH, Choi JI, Lee JI, Lee WP and Yoon SS (2017b) Identification of
Lactobacillus spp. associated with nematodes in peach farm soil.
Korean J. Microbiol.53(3), 163-169.

Mei B, Wang YE, Wu JX and Chen WZ (1994) Protective effect of ginsenosides on oxygen free radical induced damages of cultured vascular endothelial cells in vitro.
Yao Hsueh Hsuuh Pao.29, 801-808.

Oh H, Ryu M., Heo J, Jeon S, Kim YS, Jeong D and Uhm TB (2014) Characterization of biogenic amine-reducing
Pediococcus pentosaceus isolated from traditionally fermented soybean products.
Korean J. Microbiol.50(4), 319-326.


Ondee T, Pongpirul K, Visitchanakun P, Saisorn W, Kanacharoen S, Wongsaroj L, Kullapanich C, Ngamwongsatit N, Settachaimongkon S, Somboonna N and Leelahavanichkul A (2021)
Lactobacillus acidophilus LA5 improves saturated fat-induced obesity mouse model through the enhanced intestinal Akkermansia muciniphila.
Sci. Rep.
11(1), 6367.




Park YJ (2017b) Isolation and characterization of kimchi lactic acid showing antibacterial activity.
Microbiol. Biotechnol. Lett.26, 547-558.


Shon MY, Nam SH and Lee SW (2007) Antioxidant, anticancer activities and nitric oxide production of
Euphoria longana fermented with lactic acid bacteria and
Bacillus subtilis.
Korean J. Food Preserv.14, 531-537.

Saito H and Nishiyama N (1988) Effect of ginseng and its saponins on experimental amnesis in mice and on cell cultures of neurons.
In: Proc. 5th Int'l. Ginseng Symp. Seoul, Korea. pp. 92-98.

Shim KS, Park GG and Park YS (2014) Bioconversion of puffed red ginseng extract using
β-glucosidase producing lactic acid bacteria.
Food Eng. Prog.
18, 332-340.


Si W, Liang H, Bugno J, Xu Q, Ding X, Yang K, Fu Y, Weichselbaum RR, Zhao X and Wang L (2022)
Lactobacillus rhamnosus GG induces cGAS/STING-dependent type I interferon and improves response to immune checkpoint blockade.
Gut.
71(3), 521-533.




Tsai WH, Chou CH, Chiang YJ, Lin CG and Lee CH (2021) Regulatory effects of
Lactobacillus plantarum-GMNL6 on human skin health by improving skin microbiome.
Int. J. Medical Sciences.
18(5), 1114.




Vitale DC, Piazza C, Melilli B, Drago F and Salomone S (2013) Isoflavones: estrogenic activity, biological effect and bioavailability.
Eur. J. Drug. Metab. Pharmacokinet.38, 15-25.



Wu CH, Hsueh YH, Kuo JM and Liu SJ (2018) Characterization of a potential probiotic
Lactobacillus brevis RK03 and efficient production of
γ-aminobutyric acid in batch fermentation.
Int. J. Mol. Sci.19(1), 143.




Zommiti M, Bouffartigues E, Maillot O, Barreau M, Szunerits S, Sebei K, Feuilloley M, Connil N and Ferchichi M (2018)
In vitro assessment of the probiotic properties and bacteriocinogenic potential of
Pediococcus pentosaceus MZF16 isolated from artisanal Tunisian meat “Dried Ossban”.
Front. Cell. Infect. Microbiol.
9, 2607.